Zralé maso – chutné maso
| 1. 8. 2016Po smrti jatečných zvířat se ze svalů stává maso. Připravit z něj v tu chvíli pokrm by strávníky zasytilo, do gastronomického ideálu ale ještě něco podstatného chybí. Chce to čas, správnou teplotu a součinnost mnoha okem neviditelných jevů, jež popisuje tento odborněji laděný článek.
Při jeho konzumaci masa požadujeme křehkost, šťavnatost a samozřejmě chutnost. Tyto vlastnosti jsou z velké části ovlivněny změnami, ke kterým dochází po poražení jatečných zvířat a které se označují termínem zrání masa. Tento proces zahrnuje obecně složité biochemické a fyzikální změny. Doba zrání je docela rozdílná pro různé druhy zvířat. U drůbeže jsou to 1–2 dny, u prasat by mělo zrání masa trvat déle než dva dny. Pro telecí je považováno jako minimum sedm dní, pro hovězí maso se doporučují minimálně dva týdny, má-li mít maso požadovanou křehkost. Zrání masa se neuskutečňuje činností mikroorganismů, nýbrž účinkem proteolytických enzymů přítomných ve svalových buňkách.
Po porážce maso tuhne
Zpravidla rozlišujeme tři fáze zrání masa. První z nich zahrnuje období od poražení zvířete do okamžiku nástupu posmrtného tuhnutí (rigor mortis). Zpravidla trvá 1–8 hodin podle druhu zvířat a ostatních vnějších podmínek. Na konci této fáze maso zcela ztrácí pružnost svaloviny a získává tuhou konzistenci. Jde o dobu, kdy jsou po vykrvení do jisté míry svaly stále smrštitelné (kontraktilní), neboť je k dispozici kreatinfosfát na obnovu ATP 1). Po vyčerpání jeho zásob získává sval energii štěpením glykogenu. Tento proces ale probíhá v prostředí bez přístupu kyslíku a jeho efektivita pro tvorbu ATP je velice nízká. Jakmile jsou energetické rezervy vyčerpané, hladina ATP rychle klesá, což vede ke ztrátě schopnosti uvolnění (disociace) myosinu z aktomyosinového komplexu. Vytvářejí se stabilní, tzv. „rigor“ vazby mezi aktinem a myosinem (angl. rigor bonds).
Metabolismus, při kterém se ve svalech po porážce uvolňuje energie, způsobuje pokles hodnot pH díky hromadění iontů H+ a rovněž vede k produkci metabolického tepla. Teplota svalů ale klesá, jednak přerušením přívodu krve a zejména působením vnějších chladírenských teplot. Rozsah poklesu hodnot pH a teplota svalu během období rigor mortis představují pravděpodobně dva nejdůležitější posmrtné faktory, které ovlivňují kvalitu masa s ohledem na barvu, schopnost vázat vodu a křehkost.
Svaly se zkracují
Druhá fáze zrání masa je stádiem rigoru mortis. Dominantním znakem svalu v tomto stavu je zkrácení svalových vláken. Podmínkou pro nástup posmrtného ztuhnutí je snížená hladina ATP a nižší hodnota pH. V tomto procesu se základní oddíly svalu, sarkomery, zkracují. Tím se zkracuje i celý sval, přičemž míra tohoto zkrácení závisí na okolní teplotě. Při teplotě 0–10 °C nastává zkrácení sarkomer na 50 procent jejich délky. Při uchování masa v 15–20 °C se sarkomery zkrátí na nejnižší hodnotu (10 procent) a při teplotách 20–40 °C sarkomery dosáhnou jen 30 procent původní délky.
Vzhledem k nemožnosti regenerace ATP a tím přísunu energie svalovému vláknu dochází k nevratnému zkrácení sarkomer. Absence energie neumožňuje zpětné odčerpání iontů vápníku ze sarkoplazmy zpět do sarkoplazmatického retikula. Po dobu rigoru mortis je spojení aktinových a myosinových vláken nevratné. V průběhu rigoru mortis klesá pH na svoji nejnižší hodnotu.
Maso zvláční
Třetí fáze zrání je charakteristická ztrátou tuhé konzistence masa, naopak maso postupně křehne. Tato fáze zrání masa je proces uvnitř buňky, při kterém se působením proteolytických enzymů odbourávají nejprve struktury uvnitř svalových buněk. Vliv na křehkost masa má odbourávání myofibrilárních proteinů. Bílkoviny pojivové tkáně nacházející se vně svalových buněk (endomysium) zůstávají v tomto stadiu zrání téměř nezměněné a proteolýzou nedotčené.
Poslední výzkumy v oblasti proteolytických změn naznačují, že se na zrání masa podílejí skupiny různých endogenních proteáz, a že tento proces začíná již bezprostředně po porážce zvířete.
Proteolýza svalových bílkovin (rozklad – hydrolýza bílkovin účinkem proteolytických enzymů, tzv. proteáz) má hlavní vliv na křehkost masa při jeho zrání. Proteázy představují skupinu enzymů, které štěpí proteiny. Patří do třídy hydroláz. Hydrolyzují peptidické vazby aminokyselin, pomocí kterých aminokyseliny drží v peptidickém řetězci. Proteázy se dělí dle místa, kde štěpí bílkoviny, na exoproteázy a endoproteázy:
• exoproteázy odštěpují aminokyseliny od terminálních konců proteinů
• endoproteázy štěpí proteiny uvnitř peptidického řetězce a narušují jeho terciární strukturu
Při proteolýze v procesu zrání masa se uplatňují čtyři významné proteolytické systémy:
• lysosomální proteázy (katepsiny)
• kalpainy (tzv. kalpainový systém)
• proteazomy
• kaspázy
Jejich odhalování a důkazy o zapojení do procesu zrání masa probíhaly postupně. Katepsiny byly objeveny v 50. letech, kalpainy (peptidázy závislé na vápníku) v roce 1964, proteazomy v roce 1980. Ve starších publikacích se proto lze setkat jen s popisem některých z nich, kalpainy bývají v textech z 80. let ještě uváděné pod výrazem CAF (calcium activated factor). Někteří autoři považují za „tvůrce“ křehkosti masa právě kalpainy. Jejich podíl na proteolýze myofibrilárních bílkovin v procesu zrání masa je nesporný, proto začneme výklad o endogenních proteázách touto skupinou.
Kalpainy
Kalpainy byly poprvé identifikovány v roce 1964 a patří do skupiny cysteinových proteáz. Aktivují je vápenaté ionty. Jaká je funkce kalpainů v buňkách? Kosterní svalovina představuje největší uskupení tkání v těle. Četné mechanismy chrání svalové buňky před poškozením a stresem, ke kterým dochází v každodenním životě. K zajištění integrity myofibril je nezbytné odstraňovat poškozené proteiny z buněk. A právě k tomu slouží endogenní proteázy.
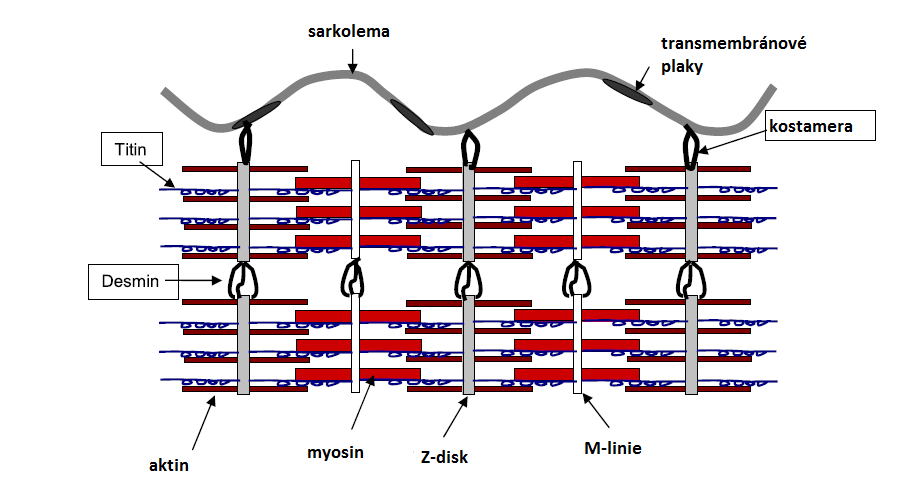
Kalpainový systém je tvořený 15 isoformami enzymu kalpainu a jeho endogenního inhibitoru – kalpastatinu. Nejlépe popsanými isoformami jsou µ-kalpain a m-kalpain. Jsou považovány za primární enzymy zapojené do proteolytické tenderizace (zkřehčování) masa. Ve svalové tkáni se kalpainový systém skládá ze tří kalpainů. Kromě výše jmenovaných forem sem patří ještě p94 (kalpain 3). Tento kalpain však nemá velkou roli v posmrtné proteolýze a tím vliv na křehkost masa. Množství vápníku potřebné k dosažení poloviny maximální aktivity µ-kalpainu je 3–50 µM, pro m-kalpain je to 400–800 μM. Aktivita m-kalpainu je významně rychlejší při 25 °C ve srovnání s 0 °C, optimální hodnota pH je kolem 7,5. Aktivnější je µ-kalpain při pH 6,5 než 7,5. Oba enzymy štěpí stejné myofibrilární proteiny, u kterých způsobují během zrání masa degradaci, ta se ale netýká aktinu ani myosinu. Proteolýza atakuje bílkoviny tzv. cytoskeletu, kam patří např. titin nebo desmin (viz. obrázek). Vzhledem k menším nárokům na koncentraci vápenatých iontů se v posmrtných procesech zrání masa uplatňuje více µ-kalpain.
Oba druhy kalpainů se skládají ze dvou podjednotek – katalytické (o velikosti 80 kDa) a regulační (28 kDa). Aktivitu enzymu ovlivňuje hodnota pH a iontová síla prostředí. Rychlost poklesu hodnot pH může hrát důležitou roli v proteolýze myofibrilárních bílkovin způsobenou kalpainovým systémem. Urychlení poklesu hodnot pH v časném stádiu post-mortem urychluje autolýzu a aktivaci μ-kalpainu. Maso, které vykazuje optimální pokles hodnot pH, získává křehkost rychleji a může mít i lepší schopnost vázat vodu. Jestliže ale hodnota pH klesá příliš rychle, jak je tomu např. u PSE masa, účinek může být opačný. Rychlý pokles hodnot pH (za 3 hod < 5,7) snížil aktivaci μ-kalpainu a následně degradaci desminu a titinu. Naznačuje to, že při výskytu vady PSE může dojít k denaturaci μ-kalpainu, tak jako je tomu i u jiných sarkoplazmatických bílkovin. Následkem je vyšší tuhost masa.
Kalpastatin
Je endogenním inhibitorem kalpainových enzymů a byl nalezen ve všech tkáních, které obsahují kalpainy. Aby došlo k vazbě kalpastatinu na kalpain, jsou opět nutné ionty vápníku. Velikost molekuly bovinního kalpastatinu je 76 kDa. Vazba kalpastatinu na kalpain je vratná. Ve svalech je po smrti kalpastatin degradován kalpainem. Dnes již existují spolehlivé důkazy o zapojení kalpainů do procesu tenderizace masa. Korelace ukazují, že rychlost křehnutí masa mezi druhy mas jatečných zvířat (hovězí<skopové<vepřové) je v opačném vztahu k poměru kalpastatin : kalpain (hovězí>skopové>vepřové). Vysoké hladiny kalpastatinu jsou spojené s horší kvalitou masa – dochází k redukci proteolýzy, která je důležitá pro křehkost masa. Roli v aktivitě kalpastatinu hrají androgenní hormony. U býků je zvýšená aktivita kalpastatinu ve svalech v porovnání k volům. Rovněž u jedinců zebu (Bos primigenius indicus) je posmrtná aktivita kalpastatinu větší, než je tomu u tura domácího (Bos primigenius f. taurus). Důsledkem je, že maso pocházející ze zebu potřebuje delší dobu zrání. Aktivita kalpastatinu klesá s věkem zvířat.
Proteazom
Proteazom je válcovitá vnitrobuněčná struktura nacházející se v prokaryotických (bakteriálních) i eukaryotických buňkách. Je místem, kde dochází k hydrolytickému štěpení bílkovin. O proteazomu publikoval Vesmír zajímavý článek autorů Jany Kadlčíkové-Tisančinové a kol. (Vesmír 86, 383, 2007/6). K tomu, aby mohla být bílkovina „strávena“, musí se na ni navázat malý protein nazvaný ubikvitin. Proces podléhá poměrně přísnému řízení – na cílový substrát se musí navázat minimálně čtyři ubikvitinové bílkoviny. Takto označené proteiny jsou následně rozeznány proteazomem.
Úlohu proteolytických systémů při zrání pštrosího masa analyzoval se svou skupinou Adele R. Thomas v roce 2004. Zjistili relativně stabilní aktivity proteazomu během celého procesu zrání, které dosahovaly i 12. den od porážky 74–82% aktivit první hodiny po smrti.
Katepsiny
Katepsiny jsou lysosomální cysteinové proteázy, které hrají důležitou úlohu v mnoha fyziologických procesech, nejenom v degradaci bílkovin. Výzkum katepsinů patří mezi nejvíce se rozvíjející oblasti proteolýzy. Důvodem je zásadní účast těchto enzymů při mnohých patologických stavech, jako jsou nádorová onemocnění, artritida, osteoporóza, neurodegenerativní a imunitní onemocnění. Velký zájem dále přitahují katepsinové proteázy nalezené u významných parazitů člověka a hmyzích škůdců, které hrají klíčovou roli v jejich metabolismu.
Katepsiny jsou zapojené i do procesu hojení ran. U člověka je známo 11 katepsinů (B, H, L, S, C, K, O, F, V, X a W). Nejčetnější jsou katepsiny B, H a L, v případě zrání masa se nejčastěji analyzuje aktivita katepsinů B, L, H a D. Katepsin L hydrolyzuje největší množství myofibrilárních bílkovin (troponin T, I a C, nebulin, titin, tropomyosin). Většina katepsinů jsou monomerní proteiny s jedinou výjimkou, kterou je kapesin C, jenž může vytvářet funkční oligomer. Aktivita katepsinů je optimální v mírně kyselém prostředí. V neutrálním pH jsou neaktivní. Podobně jako v případě kalpainů i katepsiny mají své endogenní inhibitory (cystatiny a thyropiny).
Katepsiny se uplatňují svojí proteolytickou aktivitou nejen při zrání masa, ale také při zrání sušených šunek. Zatímco kalpainy ztrácejí svoji aktivitu po fázi solení a také aktivita katepsinu D klesá nejrychleji během výrobního procesu, na druhé straně katepsiny B, L a H si udržují svoji aktivitu po celou dobu procesu. Při analýzách čínských šunek Jinhua bylo zjištěno, že katepsiny B a L zůstaly aktivní v průběhu celého procesu výroby. Na konci finálního zrání vykazoval katepsin B 9,31 procenta své počáteční aktivity, katepsin L 13,66 procent (Gaiming Zhao et al., 2005).
Katepsiny byly prvním enzymatickým systémem, na který byla zaměřená pozornost při studiích věnovaných mechanismu zrání masa a jeho vlivu na křehkost. Později si vědci začali více všímat kalpainů, neboť se zjistilo, že ovlivňují sílu Z-linií v sarkomeře, i když tato změna není v korelaci s křehkostí masa.
V buňkách jsou katepsiny uloženy v lysosomech, buněčných organelách s kyselým prostředím mezi pH 4,6–5,0. Lysosomy obsahují nejenom katepsiny, ale také další hydrolázy. V případě buněčného stresu při některých patologických stavech může dojít k uvolnění obsahu lysozomu do nitra buňky (tzv. cytosolu), kde indukují buněčnou smrt – apoptózu (Klaudia Brixová et al., 2008). Ta je ve tkáních přísně řízená, aktivuje se pouze v případě určité buňky a jen v pravý čas. V jejím průběhu se uplatňuje další skupina cysteinových proteáz – tzv. kaspázy.
Kaspázy
Jejich jméno je odvozené z funkce, kterou v buňkách vykonávají. C značí zařazení k cysteinovým proteázám, asp vyjadřuje místo, kde dochází ke štěpení peptidické vazby (za aminokyselinou, kterou je kyselina asparagová se zkr. asp), ase vyjadřuje příponu vlastní všem enzymům (anglicky je kaspáza caspase).
Kaspázy byly objevené v roce 1989. Dnes známe 14 kaspáz, které se vyskytují v řadě rozdílných tkání a typů buněk. Výjimku představuje kaspáza 13, která se dosud prokázala pouze u skotu a kaspáza 11 detekovaná u myší a krys.
V roce 2006 skupina vědeckých pracovníků z francouzského ústavu INRA přišla s hypotézou, že podmínky ve tkáních zvířat v okamžiku bezprostředně po porážce (hypoxie a ischémie, tj. nedostatek kyslíku) mohou aktivovat kaspázy a navodit apoptózu ve svalových buňkách. Od té doby se podařilo nashromáždit řadu důkazů, které potvrzují tuto myšlenku (Caroline M. Kempová a Tim Parr, 2012). Znamená to, že ve svalových buňkách se spouští po vykrvení mechanismus apoptózy se zapojením proteolytických enzymů (kaspáz). K přeměně svalů na maso dochází tedy již po několika minutách po poražení.
Při sledování posmrtných změn v příčně pruhované svalovině byly zjištěné interakce mezi proteolytickým systémem kalpainů a kaspázami. Nejsou omezené jen na substráty, které obě skupiny proteáz štěpí. Kaspáza 12 může být aktivována kalpainy. Kaspázy 3 a 7 zase štěpí kalpastatin, což aktivuje aktivitu kalpainů.
Jak na zrající maso
Zmíněné biochemické – enzymatické procesy při zrání masa probíhají – ostatně jako každé chemické reakce – při vyšších teplotách rychleji. Z hygienických důvodů musí být červené maso vychlazeno pod teplotu 8 °C. Enzymatické procesy naopak ustávají při tvorbě krystalků ledu pod –1,5 °C. Maso musí být proto uchováno v této teplotní oblasti. K zajištění co nejrychlejšího průběhu zrání masa je optimální nastavení teploty pro uchování masa mezi 3 a 5 °C. Po ukončení procesu zrání masa se může skladovací teplota snížit na 0 až 1 °C. Zráním masa se také optimalizuje jeho chuť. Vznikající látky však podléhají dalším reakcím. Poklesem teplot na 0 až 1 °C se i tyto chemické reakce zpomalují, ale ne zcela zastavují.
Notes
1) Adenosintrifosfát (ATP) má zásadní důležitost pro funkci všech buněk těla. Při jeho rozkladu na adenosindifosfát (ADP) a ionty fosforu (Pi) se uvolňuje obrovské množství energie.