Slepice jako laboratorní zvíře
Historie Ústavu molekulární genetiky je spjata se dvěmi význačnými osobnostmi naší vědy, Milanem Haškem a Janem Svobodou. Oba také stáli blízko získání Nobelovy ceny – Milan Hašek za jednoznačný experimentální průkaz fenoménu imunologické tolerance a Jan Svoboda za důkaz perzistence provirové DNA v buňkách infikovaných virem Rousova sarkomu.
Začalo to tolerancí
 Milan Hašek vypracoval pro studium imunologické tolerance unikátní postup spojení krevních oběhů vyvíjejících se kuřecích embryí, tzv. parabiózu. Pro další rozvoj imunologické problematiky byl nutný geneticky dobře definovaný modelový organismus. A to byl podnět k vytvoření inbredních linií slepic. Jako vhodný základ se ukázaly dlouhodobě příbuzensky křížené (inbredizované) linie z chovatelské stanice v Reaseheath v Anglii. Zvláštní roli v této volbě sehrála práce D. G. Gilmoura z roku 1959, v níž ukázal, že tyto vysoce inbrední linie se stále odlišují v polymorfním systému B erytrocytárních antigenů, který byl již tehdy spojován s histokompatibilními funkcemi u slepic. Bylo rozhodnuto o dovozu těchto linií z Anglie do Prahy. Zde započalo pod vedením Milana Haška systematické testování krevně skupinových antigenů a transplantace kožních štěpů (viz článek na s. 394 a Vesmír 76, 489, 1997/9). Na základě selekce v slepičích rodinách podle délky přežívání kožních štěpů byly koncem šedesátých let ustaveny linie, u nichž se již štěpy neodhojovaly (obr. 1), zatímco při přenosu mezi jednotlivými liniemi docházelo k akutnímu odhojení.
Milan Hašek vypracoval pro studium imunologické tolerance unikátní postup spojení krevních oběhů vyvíjejících se kuřecích embryí, tzv. parabiózu. Pro další rozvoj imunologické problematiky byl nutný geneticky dobře definovaný modelový organismus. A to byl podnět k vytvoření inbredních linií slepic. Jako vhodný základ se ukázaly dlouhodobě příbuzensky křížené (inbredizované) linie z chovatelské stanice v Reaseheath v Anglii. Zvláštní roli v této volbě sehrála práce D. G. Gilmoura z roku 1959, v níž ukázal, že tyto vysoce inbrední linie se stále odlišují v polymorfním systému B erytrocytárních antigenů, který byl již tehdy spojován s histokompatibilními funkcemi u slepic. Bylo rozhodnuto o dovozu těchto linií z Anglie do Prahy. Zde započalo pod vedením Milana Haška systematické testování krevně skupinových antigenů a transplantace kožních štěpů (viz článek na s. 394 a Vesmír 76, 489, 1997/9). Na základě selekce v slepičích rodinách podle délky přežívání kožních štěpů byly koncem šedesátých let ustaveny linie, u nichž se již štěpy neodhojovaly (obr. 1), zatímco při přenosu mezi jednotlivými liniemi docházelo k akutnímu odhojení.
 Na vytvoření těchto kongenních linií, které se lišily pouze v oblasti chromozomu (haplotypu) kódujícího antigeny systému B, se významně podílel Karel Hála. V sedmdesátých letech byly všechny typické funkce známé ze studia myších a lidských histokompatibilních systémů ztotožněny se slepičím systémem B. Klasickou genetickou analýzou segregace antigenních znaků u velkého počtu kuřat z křížení F1 hybridů kongenních linií CB × CC (liší se pouze v B haplotypu) s nepříbuznou inbrední linií WB se podařilo získat malé procento rekombinantů mezi haplotypy F1 hybridů. Na jejich základě se pak podařilo definovat v systému B tři oblasti: B-F a B-L kódující typické histokompatibilní antigeny I. a II. třídy známé ze studia myší a lidské histokompatility, a dále oblast B-G, která je typická pouze pro ptáky. Její antigeny jsou převážně na erytrocytech a označují se jako třída IV (studium funkce této záhadné třídy genů je dodnes neuzavřenou kapitolou).
Na vytvoření těchto kongenních linií, které se lišily pouze v oblasti chromozomu (haplotypu) kódujícího antigeny systému B, se významně podílel Karel Hála. V sedmdesátých letech byly všechny typické funkce známé ze studia myších a lidských histokompatibilních systémů ztotožněny se slepičím systémem B. Klasickou genetickou analýzou segregace antigenních znaků u velkého počtu kuřat z křížení F1 hybridů kongenních linií CB × CC (liší se pouze v B haplotypu) s nepříbuznou inbrední linií WB se podařilo získat malé procento rekombinantů mezi haplotypy F1 hybridů. Na jejich základě se pak podařilo definovat v systému B tři oblasti: B-F a B-L kódující typické histokompatibilní antigeny I. a II. třídy známé ze studia myší a lidské histokompatility, a dále oblast B-G, která je typická pouze pro ptáky. Její antigeny jsou převážně na erytrocytech a označují se jako třída IV (studium funkce této záhadné třídy genů je dodnes neuzavřenou kapitolou).
Odhojení nádorů Rousova sarkomu
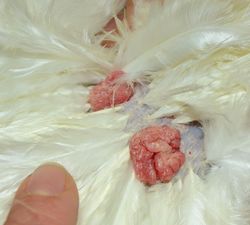
Důležité bylo zjištění, že linie CB a CC se značně liší v imunitní odpovědi na různé antigeny. Koncem sedmdesátých let významně vstupuje do hry Jan Svoboda. Chce vyzkoušet, jak se budou tyto linie chovat při infekci virem Rousova sarkomu (RSV). Tento úkol byl tehdy zadán studentu Jiřímu Plachému. Výsledek pilotního pokusu na několika slepicích linií CB a CC byl nadějný: u slepic CB se po podkožním naočkování viru RSV objevily jen malé nádory, které se po čase úplně odhojily. Všechny slepice linie CC naopak uhynuly s velkými progresivně rostoucími nádory. V dalších pokusech se ukázalo, že pozorovaný ústup nádorů koreloval výhradně s přítomností B-F genů pocházejících z linie CB, které byly přítomny u rekombinantů v systému B. To jasně potvrzovalo imunitní mechanismus odhojení nádorů vyvolaných virem Rousova sarkomu. Pozorovaná odolnost je podmíněna geny MHC třídy I (B-F) slepičího MHC, nejde tedy o odolnost na úrovni specifických receptorů pro vstup viru do buňky.
Při růstu Rousova sarkomu je stále produkován virus a nádor roste také infekcí nových buněk. Nádor je tedy polyklonální a virové částice nesou mnoho antigenních znaků kódovaných jednotlivými geny, především genem env pro obalové proteiny. Může být cílem imunitní odpovědi také protein kódovaný onkogenem v-src? Mohou onkogeny obecně působit jako nádorově specifické antigeny? Impuls pro řešení těchto otázek přišel opět od Jana Svobody. V jeho laboratoři byly koncem osmdesátých let připraveny molekulární klony provirové DNA, která obsahovala pouze gen v-src s příslušnými promotorovými sekvencemi (LTR, long terminal repeats). Co se tedy stane, když naočkujeme naše kongenní linie slepic místo RSV tímto konstruktem DNA? Ví se sice, že v-src je sám zodpovědný za transformaci buněk in vitro, ale bude vůbec možné takto vyvolat nádory u kuřat? Pokud ano, budou buňky těchto nádorů transplantovatelné na syngenní příjemce a porostou v tkáňové kultuře jenom po určitý počet pasáží, nebo neomezeně? Je gen v-src kromě transformace nadán také schopností učinit nádorové buňky nesmrtelnými?
Po delší době a méně často než u RSV nádory po naočkování konstruktu DNA s v-src skutečně vyrostly. Podařilo se také získat několik transplantovatelných nádorů, které také rostly dobře in vitro. Bylo prokázáno, že všechny tyto nádory obsahují začleněnou původní provirovou sekvenci (LTR – v-src – LTR), z níž je účinně exprimován gen v-src. Mezitím byla, především zásluhou Jima Kaufmana, objasněna struktura B-F molekul u různých slepičích linií, včetně CB a CC. Ukázalo se, že pouze B-F molekuly přítomné v MHC(B) systému u linie CB jsou schopny specificky vázat antigenní peptid z karboxylového konce v-src, což je jediná sekvence, která se liší od buněčného c-src, a může tedy být rozpoznána imunitním systémem hostitele. Imunizace tímto peptidem u kuřat linie CB vedla ke specifické stimulaci lymfocytů v in vitro testech a bránila růstu nádorů vyvolaných v-src DNA i RSV. Onkogen v-src, resp. jeho mutovaná část odpovídající za jeho přeměnu z buněčného protoonkogenu c-src, představuje tedy v daném modelu nádorově specifický antigen.
Model pro tvorbu metastáz
Při dalším in vitro pasážování buněk z původního nádoru vyvolaného Svobodovým DNA konstruktem u jedné ze zavedených nádorových linií indukovaných v-src DNA byly získány buněčné klony, které po zpětném očkování do syngenních kuřat buď tvořily plicní metastázy, nebo způsobovaly jenom primární nádory, které také rostly, ale bez tvorby metastáz. Tyto klony se liší morfologií struktury buněčného cytoskeletu a také ve fungování několika genů s možným vlivem na schopnost metastázování. Tento model prokázal např. rozhodující vliv transkripčního faktoru EGR1 nebo proteinu HOPX na metastatický potenciál příslušných buněk a dodnes probíhají další pokusy s cílem identifikovat geny účastnící se při metastázování nádorů.
Rezistence a receptory
Paralelním příběhem původně také navrženým Janem Svobodou je otázka receptorů pro vstup viru do buňky. Úzce příbuzná skupina ptačích sarkomových a leukózových virů, kam patří i RSV (viz článek na s. 394), je zajímavá rozrůzněním při využívání povrchových bílkovin jako receptorů pro vstup do kuřecích buněk. Můžeme soudit, že je to způsobeno koevolucí viru a hostitele, při níž hostitel uniká z dosahu škodlivého viru mutacemi genů pro receptorové bílkoviny. Virus se pak musí přizpůsobit nové variantě receptorů, nebo změnit své povrchové glykoproteiny natolik, že novou receptorovou bílkovinu rozpozná.
Inbrední drůbeží linie udržované v ÚMG zafixovaly různé varianty receptorových genů a liší se v citlivosti nebo rezistenci vůči jednotlivým kmenům virů. Díky těmto vlastnostem mohly být receptory pro retroviry na tomto modelu snadno studovány. Jeden z receptorů byl identifikován, u jiných byly nalezeny zajímavé částečně rezistentní varianty, které mohou představovat evoluční meziprodukt a příležitost pro další adaptaci viru.
Studium receptorů pro retroviry je zajímavé provádět i na příbuzných druzích hrabavých ptáků. Zde můžeme na základě sekvence receptorů předpovědět, které druhy divokých ptáků jsou citlivé na daný virový kmen, a mohou se tak stát přírodním rezervoárem viru. Vzhledem k tomu, že jeden z kmenů (ALV-J) je významným patogenem drůbeže v Číně a jihovýchodní Asii, mají tyto studie praktický význam.
Transgenní kuřata
Model drůbežích inbredních linií má jeden závažný nedostatek ve srovnání s inbredními liniemi myší – genetické studie lze provádět jen na základě existujících polymorfismů a jejich hybridizace přirozenou cestou. Donedávna neexistovala efektivní cesta k vytváření transgenních linií nebo vyřazení konkrétních genů (tzv. genový knockout) genovou manipulací. Je to proto, že nemáme přístup k raným embryím kuřat ve stadiu několika buněk. U myší tímto způsobem můžeme do raného embrya vnést embryonální kmenové buňky geneticky upravené in vitro. Čerstvě snesené slepičí vejce však obsahuje zárodek ve stadiu přibližně 50 tisíc buněk a vnesení upravených buněk z kultury již nevede k chimérám, které by přenesly genovou úpravu na potomstvo.
Je proto třeba pracovat s primordiálními germinálními buňkami (PGC), předchůdci celé samčí nebo samičí germinální linie. Tyto buňky se vyvíjejí ze středního zárodečného listu, v raném embryu obíhají v krvi předtím, než osídlí nově se zakládající pohlavní orgány. Odtud je lze z embryí extrahovat, namnožit v kultuře, geneticky manipulovat a poté vrátit zpět do krevního oběhu. Tato procedura je velmi neefektivní a takto vytvořené linie by se daly spočítat na prstech.
Převratné vylepšení přinášejí techniky vyvinuté ve společnosti Biopharm v Jílovém u Prahy. Pro využití těchto technik u kuřat jsme založili trojstrannou spolupráci Biopharm – Ústav molekulární genetiky a Technische Universität v Mnichově a přenesli jsme do sterilizovaných kohoutů PGC označené genem mCherry, který produkuje červenou fluorescenci. Kromě praktického řešení transgeneze nás zajímalo, zda PGC mohou v prostředí dospělých varlat absolvovat celý složitý vývoj germinální linie a dozrát v spermie schopné oplození, i když byly předtím vytrženy ze specifického zárodečného mikroprostředí. Experiment se podařil a získali jsme očekávaný poměr kuřat „divokého typu“ a kuřat s nápadnou červenou fluorescencí, kterým říkáme Robin (podle anglického názvu pro ptáka červenku, obr. 2). Celá procedura je stále ještě komplikovaná, avšak spolehlivě opakovatelná, časově úsporná a proveditelná s malými počty zvířat.
Pokud se v budoucnu podaří vytvořit ostatní nástroje, které jsou u inbredních myší obvyklé (např. systémy inzerční mutageneze, regulované exprese transgenů, CRISPR/Cas9 editování genů aj.), půjde využít všech výhod, které jinak model inbredních slepic poskytuje. Důležitost podtrhuje i fakt, že slepice je nejdůležitějším hospodářským zvířetem, u něhož probíhá promyšlená plemenitba na užitkovost a rezistenci k chorobám. Do kuřat by se mohly vnášet geny rekombinantních bílkovin pro využití v diagnostice nebo medicíně a jejich akumulace by šla nasměrovat do vaječného bílku, odkud se dají snadno extrahovat ve velkých kvantech. Velmi zajímavé vlastnosti mají např. kuřecí protilátky. Nedávno byl americkou lékovou agenturou FDA schválen první léčebný preparát vyprodukovaný jako rekombinantní protein ve vaječném bílku. S trochou nadsázky by pak slepice snášely zlatá vejce.
Ke stažení
 článek ve formátu pdf [267,29 kB]
článek ve formátu pdf [267,29 kB]















