Latence HIV a perspektivy vyléčení
| 13. 7. 2017Velmi rafinovaná strategie HIV vzdoruje jednoduchým léčebným zásahům. Zásadní překážkou vyléčení je zabudování genetické informace HIV do genomu hostitelské buňky, v níž se tento provirus může kdykoli probudit.
Retro virus HIV je původcem infekce, která před zavedením léčby téměř bez výjimky vedla k onemocnění zvanému AIDS (syndrom získané imunitní nedostatečnosti). Současná antiretrovirová terapie (ART) umožňuje nakaženým pacientům, aby dlouhodobě vedli kvalitní život. ART radikálně snižuje množství viru v organismu, nedokáže ale infekci odstranit a pacienta viru zbavit. Přerušení i velmi účinné léčby vede k rychlé obnově množení viru, a terapii proto nelze nikdy trvale vysadit. Dříve fatální onemocnění se v posledních dvou desetiletích stalo chronickým.
HIV infikuje T-lymfocyty a některé další buňky nesoucí na povrchu molekulu CD4. Tyto buňky jsou zásadní pro komunikaci mezi jednotlivými hráči imunitního systému. V T-lymfocytech CD4+ se virus HIV intenzivně množí a přitom tyto buňky zabíjí. Jejich počet tak během měsíců a let klesá, a tím klesá i schopnost imunitního systému vypořádat se s jakoukoliv infekcí. Zatímco dospělý zdravý člověk má v krvi 0,5 až 1,6 milionu T-lymfocytů CD4+ na mililitr krve, člověk se syndromem AIDS jich má 2krát až 10krát méně. Výsledkem je výrazně poškozená imunita a mizivá schopnost bránit se nejrůznějším infekčním nebo i nádorovým onemocněním.
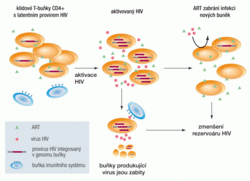 Brzy po identifikaci HIV jakožto původce pandemie AIDS se výzkum soustředil na vývoj terapie. Jakým mechanismem tedy ART účinkuje? Od počátku bylo zřejmé, že terapie musí působit pouze na virus a nesmí ovlivňovat zásadní funkce lidských buněk. Vývoj se proto zaměřil na virové proteiny účastnící se množení HIV, které jsou naštěstí výrazně odlišné od proteinů lidských. Účinnou antiretrovirovou terapii tvoří kombinace alespoň tří léčiv, která blokují různé virové proteiny a různé fáze virového replikačního cyklu (viz obr.). Kombinace léčiv brání vzniku virových populací rezistentních na terapii. Obrovský přínos dnešní antiretrovirové terapie spočívá v tom, že brání infekci nových buněk a dokáže dlouhodobě potlačovat virovou replikaci a její nežádoucí dopady na organismus; brání tedy i úbytku T-buněk CD4+ (viz též příspěvek na s. 400).
Brzy po identifikaci HIV jakožto původce pandemie AIDS se výzkum soustředil na vývoj terapie. Jakým mechanismem tedy ART účinkuje? Od počátku bylo zřejmé, že terapie musí působit pouze na virus a nesmí ovlivňovat zásadní funkce lidských buněk. Vývoj se proto zaměřil na virové proteiny účastnící se množení HIV, které jsou naštěstí výrazně odlišné od proteinů lidských. Účinnou antiretrovirovou terapii tvoří kombinace alespoň tří léčiv, která blokují různé virové proteiny a různé fáze virového replikačního cyklu (viz obr.). Kombinace léčiv brání vzniku virových populací rezistentních na terapii. Obrovský přínos dnešní antiretrovirové terapie spočívá v tom, že brání infekci nových buněk a dokáže dlouhodobě potlačovat virovou replikaci a její nežádoucí dopady na organismus; brání tedy i úbytku T-buněk CD4+ (viz též příspěvek na s. 400).
Důvod, proč antiretrovirová terapie nedokáže odstranit virus z organismu, spočívá z velké části v zásadním a z hlediska množení viru nutném kroku, při kterém je kompletní genetická informace HIV vložena (integrována) do genomu hostitelské buňky (obr.). Genom HIV, který se takto stává trvale součástí genomu infikované T-buňky CD4+, se označuje jako provirus. Teprve po integraci se na základě genetické informace proviru HIV vytváří virová RNA a virové proteiny a mohou vznikat tisíce nových virionů HIV, které zase mohou infikovat další T-lymfocyty CD4+. Teorii „proviru“, který dokáže okamžitě nebo i po dlouhé době vést k tvorbě viru, razil spolu s ostatními velikány retrovirologie v šedesátých letech minulého století Jan Svoboda – a další vývoj mu dal plně za pravdu.
I u úspěšně léčených pacientů, u kterých nebyly dlouhodobě detekovány virové partikule v krvi, se tvorba viru po zastavení terapie rychle obnovila. Pacienti tedy byli úspěšně léčeni, ale nebyli vyléčeni. To vedlo k definici rezervoáru HIV jako populace T‑buněk CD4+, jež ve svém genomu obsahují integrovaný provirus HIV. Rezervoár HIV infekce tak slouží jako zásobárna genetické informace pro tvorbu nových HIV virionů, které infikují další buňky.

























