Nenápadný hrdina 20. století
Pro experimentální obory jsou metody a přístroje zásadní. Proměny hmotnostního spektrometru od fyzikální aparatury se specifickým určením po současná sofistikovaná zařízení chrlící velké množství dat v mnoha různých oborech vědy jsou dokladem vynalézavosti a důvtipu experimentátorů.
Hmotnostní spektrometr stojí za revolučními změnami ve fyzice, chemii, biologii, medicíně, astronomii, ale třeba i v archeologii. Oproti takovému laseru nebo počítačovému procesoru je však povědomí širší veřejnosti o něm zanedbatelné. Přitom se hmotnostní spektrometrie uplatnila třeba u vývoje atomové bomby nebo vakcíny proti koronaviru, ale vždy byla pouze v pozadí – jako technický detail.
Hmotnostním spektrometrem můžeme zvážit částice nanosvěta a mikrosvěta (atomy, molekuly, ale třeba i nabité kapičky či virové partikule, viz rámeček Jak funguje hmotnostní spektrometr). Práce s nabitými částicemi v plynné fázi má historii skoro tak dlouhou jako časopis Vesmír. U jejího zrodu stáli prvotřídní experimentální fyzikové. Prvním náznakem hmotnostní spektrometrie byly experimenty Eugena Goldsteina z roku 1886, v nichž při pokusech s vakuovými trubicemi popsal částice odpuzované anodou, které exponovaly fotografickou desku. Nazval je Kanalstrahlen a dnes víme, že šlo o kladně nabité ionty. Wilhelm Wien začal tyto svazky iontů ohýbat magnetickým polem a ukázal, že anodické paprsky („kladná elektřina“) se zásadně liší od paprsků katodických: k jejich ohybu bylo zapotřebí podstatně silnějšího magnetického pole a skládaly se z více než jedné složky.
Jak funguje hmotnostní spektrometr?
Pohyb nabité částice v elektromagnetickém poli, ať už se jedná o pole magnetické, radiofrekvenční, elektrostatické, nebo o jejich různé kombinace, závisí na její hmotnosti a náboji. Z analýzy trajektorie nabité částice tak můžeme určit poměr hmotnosti a náboje. Zařízení – a že jich je – poskytující tento poměr nazýváme hmotnostním spektrometrem. Je zvykem vyjadřovat náboj nikoliv absolutně, ale takzvaným nábojovým číslem. Toto číslo vyjadřuje, kolik elementárních nábojů příslušný ion nese. Například organický ion CH5+ má nábojové číslo 1, ion mědi Cu2+ má nábojové číslo 2. Ion proteinu získaný elektrosprejovou ionizací může nést i desítky asociovaných protonů a tomu bude odpovídat jeho nábojové číslo. V hmotnostní spektrometrii se potom určuje poměr hmotnosti m a nábojového čísla z, což se obvykle označuje jako m/z. Hmotnostním spektrem pak nazveme závislost četnosti iontů na ose y na poměru m/z na ose x.
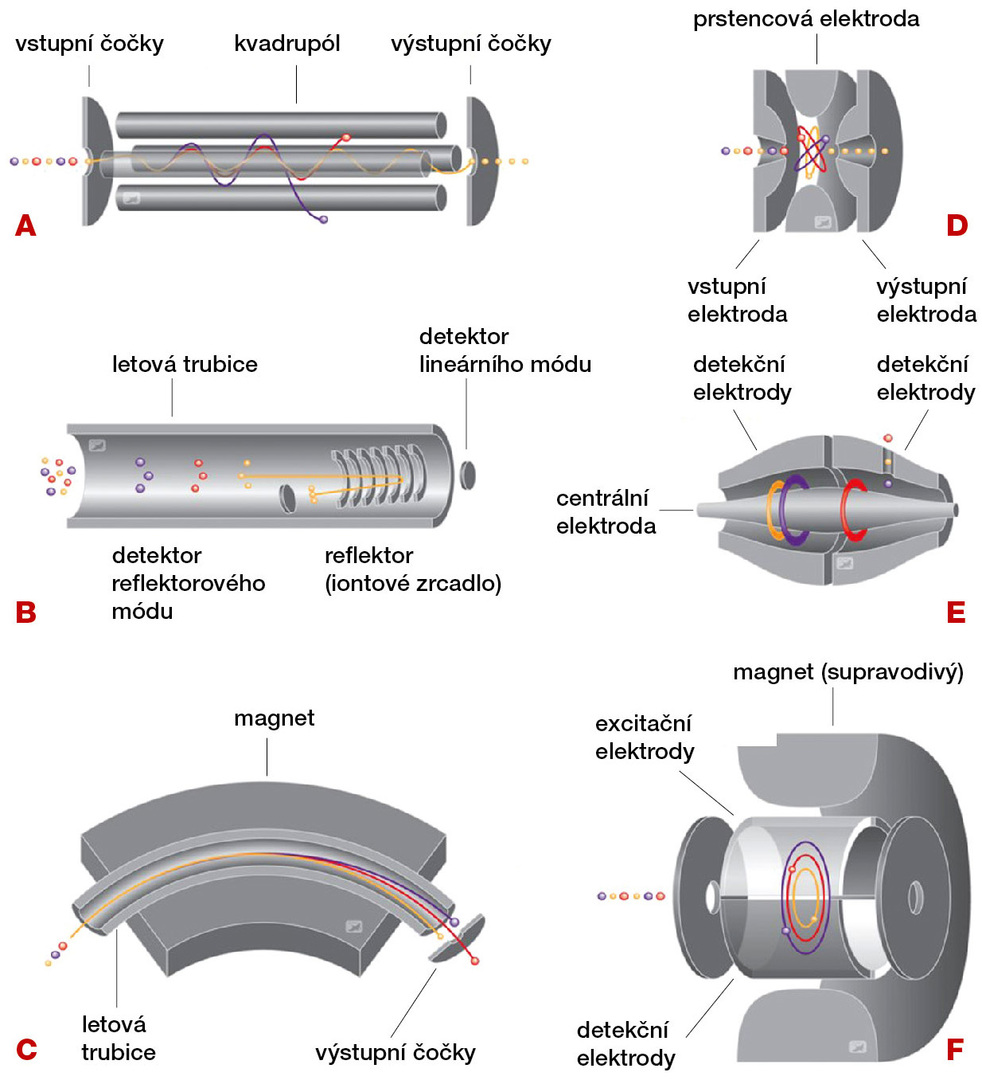
Hmotnostní analyzátory
Z našeho textu by se mohlo zdát, že vývoj hmotnostní spektrometrie je pouze sledem průlomů v ionizačních technikách. Ty jsou určitě důležité, neboť jen ionizované species může být zavedeno do hmotnostního spektrometru a tam dále analyzováno. Ionizace je vždy složitý a kontaktní proces. Doslova a do písmene špiní hmotnostní spektrometr a způsobuje řadu problémů, které vyvolávají velké nároky na jeho údržbu. Jaký to rozdíl od čistých spektrometrů optických! Naše orientace na ionizaci jako klíč k úspěchu v hmotnostní spektrometrii ale není úplně přesná. Srdcem každého hmotnostního spektrometru je totiž hmotnostní analyzátor, který třídí ionty podle poměru m/z (viz obr. 3). Hmotnostní spektrometrie je oproti jiným instrumentálním metodám unikátní tím, že k analýze je možné využít úplně odlišné fyzikální principy. První hmotnostní spektrometry využívaly analýzu trajektorie nabité částice v magnetickém poli v závislosti na poměru m/z, ale toto řešení se dnes již téměř nikde nepoužívá. Jeho popis však nalezneme prakticky v každé učebnici analytické či organické chemie s kapitolou o hmotnostní spektrometrii. Tato odtrženost didaktiky od hmotnostně spektrometrického života vede k řadě nedorozumění a stává se, že čerstvý absolvent či odborník na jinou problematiku se u hmotnostního spektrometru zvědavě dotazuje, zda magnet je uvnitř, a ukazuje přitom buď na obálku reflektronového zrcadla, či orbitrapové pasti. V praxi se komerčně využívá hned několik typů hmotnostních analyzátorů. Určení poměru hmotnost/náboj (m/z) může být dosaženo například nastavením různé stabilní dráhy v lineárních kvadrupólech a kvadrupólových iontových pastech, měřením frekvence periodického pohybu iontů v iontové cyklotronové rezonanci nebo v orbitrapu, měřením doby průletu (čili rychlosti) v analyzátoru doby letu či hybnosti v magnetických sektorech. Kombinace různých iontových zdrojů a různých hmotnostních analyzátorů dává vzniknout velké škále hmotnostních spektrometrů, ze kterých si potom každý hmotnostní spektrometrista může vybrat ten, který miluje, a ten, který nenávidí. O což se lze poté velmi úspěšně hádat na konferenčních setkáních.
Za kolébku hmotnostní spektrometrie je považována Cavendishova laboratoř v britské Cambridgi, kde první hmotnostně spektrometrické experimenty uskutečnil slavný objevitel elektronu J. J. Thomson. Ten podle svých současníků nebyl příliš zručný experimentátor, ale uměl si vybrat spolupracovníky. Také za úspěchem jeho hmotnostního spektrometru stojí jeho žák Francis W. Aston. Svůj první hvězdný moment si hmotnostní spektrometr užil v roce 1920, kdy Astonovy experimenty prokázaly existenci fenoménu izotopie – dvě atomová jádra stejného prvku (v tomto případě neonu) mohou mít rozdílnou hmotnost. Byl to naprostý průlom v přemýšlení o atomech – hmotnost najednou prokazatelně nebyla základním parametrem atomu! Vesmír k tomu v roce 1923 píše: Roku 1920 vymyslil anglický Aston důvtipný způsob k zjišťování isotop. Z látky dosud za prvek pokládané zjednal si kanálové paprsky, jež uchýlil elektrickým i magnetickým polem. Ve velikosti této úchylky obráží se atomová váha. Je-li prvek opravdu jednotný, paprsek se jen uhne. Je-li směsí, isotop rozestoupí se současně ve vějíř. Počet paprsků tohoto vějíře udává nám počet isotop. Vějíř přetne se fotografickou deskou. Každý paprsek zobrazí se skvrnou, z jejíž polohy lze přímo atomovou váhu isotopy vypočítat.
V třicátých a čtyřicátých letech byla veřejnost postupně vzrušována řadou objevů – přišlo se na to, že atomové jádro má vnitřní strukturu, vyrojila se spousta „elementárních“ částic a zjistilo se, že při štěpení jádra se uvolňuje energie. Všude bylo třeba hmotnostního spektrometru. Ten sehrál svůj part i v projektu Manhattan. Sloužil zezačátku k oddělování izotopů uranu, později ke zkoumání netěsností při separaci uranu 235U v ultracentrifugách. A také umožnil nejrůznější izotopové studie – najednou bylo možné určovat stáří hornin, později stáří organických zbytků pomocí techniky 14C či třeba stáří podzemních vod a archivního vína pomocí nejtěžšího izotopu vodíku, tritia. Pomocí značení sloučenin stabilními izotopy šlo odhalit mechanismy chemických reakcí nebo metabolické cesty.
Hmotnostní spektrometrie je ve Vesmíru několikrát zmíněna, ale v našich zemích žádný takovýto přístroj dlouho nebyl. Nikdo z těch nemnoha domácích fyziků se této oblasti nevěnoval – hmotnostní spektrometrie náležela do sféry „velké fyziky“. Přístroj se u nás vyrobil až po válce, kdy začal být zajímavý pro chemiky. Šlo o dílo čtyř tehdy mladých pracovníků budoucího Ústavu fyzikální chemie V. Čermáka (1920–1980), V. Hanuše (1923–2009), Č. Jecha (1925–2002) a J. Cabicara (1923–2000).