Neviditelné obaly
| 2. 4. 2024Jedním z klíčových vývojových kroků k vzniku živého organismu bylo vytvoření hranice mezi ním samým a jeho okolím. Ať už se tak stalo kvůli ochraně organismu, nebo udržení všech jeho součástí pohromadě. Během evoluce se zprvu jednoduché „slupky“ zdokonalovaly a začaly plnit další a další funkce. Dnes v éře buněčných a farmaceutických technologií se je snažíme co nejlépe napodobit.
Stejnou pestrost, jakou pozorujeme mezi rostlinnými a živočišnými druhy, můžeme najít také v mikrosvětě buněk, nebuněčných organismů, jejich schránek a membrán. Na mikrometrové a nanometrové úrovni se nejvíce ukazuje jejich nesmírná bohatost.
Nejprve rozebrat na součástky!
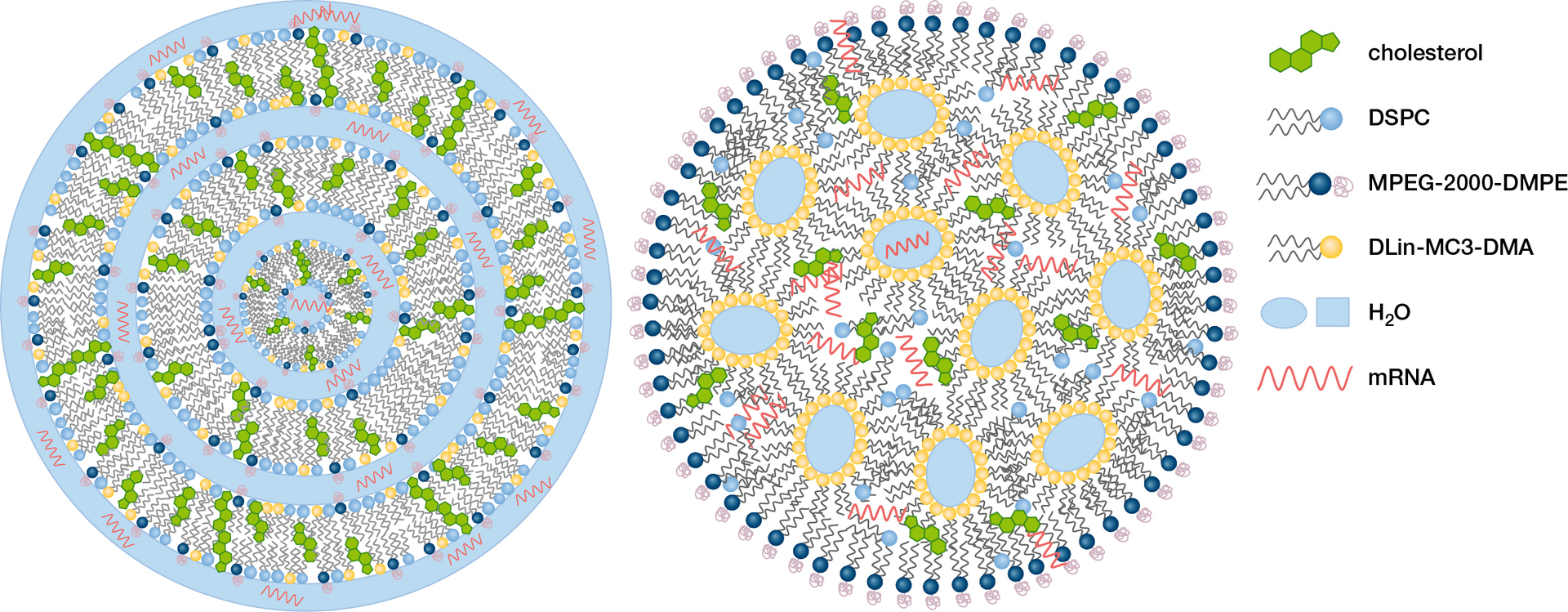
Základními stavebními kameny pro mikroorganismy – stejně jako pro naše těla – jsou nejen proteiny, sacharidy a lipidy, ale také mnohé anorganické materiály jako oxid křemičitý, uhličitan vápenatý či fosforečnan vápenatý. Ty se v pokročilejších organismech velmi často kombinují. Buňky napříč celou rostlinnou a živočišnou říší ve svých buněčných membránách (obr. 4) spojují fosfolipidy – přírodní surfaktanty (obr. 1) složené z mastných kyselin, kyseliny fosforečné a glycerolu či cholinu – s bílkovinnými receptory a membránovými proteiny. Tyto proteiny jsou schopny přes onu tenkou nepolární dvojvrstvu tvořenou lipidy, která připomíná mýdlovou bublinu, transportovat jak polární látky, tak ionty (viz také Vesmír 101, 156, 2022/3).
Na povrchu buněk můžeme rovněž najít sacharidy, ať už jednotlivě jako signální místa pro molekuly vážící se k receptorům, či v polymerech, jakými jsou celulóza, pektin nebo lignin, které tvoří buněčnou stěnu rostlin a bakterií. Viry jakožto nebuněčné organismy evolučně tíhly k používání bílkovin, s jejichž pomocí v napadených buňkách syntetizují kromě své nukleové kyseliny a pomocných enzymů také své pouzdro – kapsidu, do které se veškerý potřebný materiál pro vznik nové virové částice zabalí.
Trpělivost růže přináší
Ochrannou funkci „obalu“ plní i uhličitan vápenatý, který syntetizují koráli (Anthozoa) z vápenatých iontů a oxidu uhličitého, rozpuštěných v mořské vodě. Koráli jsou dokonce schopni pomocí biosyntézy konkrétních aminů z aminokyselin ovlivnit, která z forem uhličitanu vápenatého (kalcit, aragonit nebo vaterit), lišících se svou krystalovou strukturou, vzniká.
Jednobuněčné řasy rozsivky (Diatomeae) naopak dokážou z vody vyvazovat volnou kyselinu křemičitou (v nepatrném množství hydratovaný křemen, oxid křemičitý) a stavět z nich svoji dvoudílnou schránku. Tato schránka, frustula (viz Vesmír 102, 488, 2023/9), je složená ze dvou „misek“ pokrytých kyselým polysacharidem, které do sebe zapadají. Při nepohlavním rozmnožování rozsivek si mateřská a dceřiná buňka vezmou každá po jedné polovině a druhou si dotvoří. Pokud bychom rozsivkám odepřeli přísun materiálu na stavbu frustuly a přitom ponechali přísun ostatních živin, zastavily by dokonce své rozmnožování. Rozsivky tedy kvůli velmi nízké rozpustnosti kyseliny křemičité ve vodě rostou mnohem pomaleji než koráli, v geologické historii však měly času dostatek a jejich odumřelá těla nyní těžíme jako křemelinu – diatomit, složený ze dvou atomů – křemíku a kyslíku, SiO2. Dobýváme jej také v našich zemích, v Borovanech u Českých Budějovic a používá se jako filtrační materiál při výrobě filtrovaného piva, ale rovněž při průmyslové sorpci nebo jako izolační materiál.
Až po rozebrání pochopíme…
Ještě předtím, než vědecký svět důkladně poznal pestrost světa biomembrán, začal proti němu tak trochu mimoděk bojovat. Generace antibiotik, kterou objevil při svém výzkumu lékař Alexander Fleming, funguje právě na principu zabránění tvorby obalu bakterií. Plísně rodu Penicillum z aminokyselin vyrábějí molekuly strukturně podobné motivům přítomným ve spojeních jednotlivých vrstev buněčné stěny bakterií, přičemž tyto vrstvy jsou při stavbě buněčné stěny enzymaticky spojovány. Antibiotika mimikují onen strukturní motiv, proto se vážou na zmíněné spojující enzymy a brání další proliferaci bakterií. Tento motiv, zvaný β-laktamový kruh, má ve své struktuře velmi početná třída antibiotik, a působí tedy stejně jako přírodní peniciliny. Boj má však i svoji druhou frontu, na které bakterie tvoří enzymy schopné β-laktamová antibiotika enzymaticky rozkládat, ještě než poslouží svému účelu. Odpovědí vědců byla izolace látek, které se umějí navázat do aktivních míst enzymů, nevratně je inhibovat, a tím umetat cestu antibiotiku. Na tomto principu se osvědčila kombinace antibiotika – např. amoxicilinu – a inhibitoru enzymu, který antibiotikum štěpí – klavulonové kyseliny, známé na trhu dostupných léků jako Amoksiklav, Augmentin nebo Clavulin (viz Vesmír 102, 691, 2023/12).
Nyní vidíte 34 % článku. Co dál:
O autorovi
Stanislav Chvíla