Enzym buněčné nesmrtelnosti
| 12. 12. 2016Proč většina buněk řádně stárne, ale některé – pohlavní, kmenové, ale i určité nádorové – jsou „nesmrtelné“? Objevy, které vedly k poznání telomer a telomerázy, nám umožnily lépe porozumět procesu stárnutí.
Chromozomy v buněčném jádře objevil pomocí mikroskopu švýcarský biolog Karl Wilhelm von Nägeli v roce 1842. V roce 1910 Thomas Hunt Morgan získal u octomilek (Drosophila melanogaster), mušek s generační dobou dva týdny a s velkými chromozomy, první umělé mutanty (tím, že je a jejich vývojová stadia vystavoval horku, mrazu, kyselinám, zásadám, záření a dalším extrémním podmínkám). Další studium chromozomů různě mutovaných a křížených drozofil přivedlo Morgana přes lokalizaci prvních genů až k formulaci chromozomové teorie dědičnosti (a roku 1933 k Nobelově ceně).
Morganův žák Hermann Joseph Muller v roce 1926 experimentálně prokázal (rovněž na octomilkách) mutagenní účinek ionizujícího záření (Nobelova cena 1946). V souvislosti s tím později zjistil, že mutantní mušky vykazují ve svém genetickém materiálu řadu různých poškození. Vysvětlil to tím, že záření způsobuje zlomy chromozomů a jejich následné splynutí. Zároveň si všiml, že k fúzím mezi chromozomy nedocházelo, pokud si zachovaly přirozené konce. Své výsledky shrnul roku 1938 do přednášky, v níž zaznělo: „Koncový gen musí mít speciální funkci ´zalepovat´ konec chromozomu, protože bez této ochrany nemá chromozom možnost dlouhodobě existovat.“
V souladu s tehdejší cytologickou terminologií, která už obsahovala pojmy centromera a chromomera, Muller vymyslel pro zakončení chromozomu termín telomera (řecky télos, „konec“, a méros, „část“).
V přibližně stejné době Barbara McClintocková svými experimenty s křížením ozařovaných a zdravých semen kukuřice dokázala, že telomery skutečně představují speciální, nepostradatelnou část chromozomu zabezpečující jeho integritu, a že chromozom se poté, co o telomeru přijde, rozpadne. Zjistila také, že někdy se „poraněný“ konec chromozomu sám „zahojí“, a to tehdy, pokud se nachází v oplodněném vajíčku (zygota patří spolu s kmenovými, pohlavními a některými nádorovými k buňkám s aktivní telomerázou). V roce 1942 doporučila: „Experimenty v následujícím období by měly být zaměřeny na porozumění způsobu, jak dochází k hojení…“ (V roce 1983 dostala Nobelovu cenu za objev „skákajících“ genů.)
Staré buňky si tedy nějak „pamatují“, že jsou staré…
Dalším milníkem byl objev Leonarda Hayflicka a Paula Moorheada, kteří v roce 1961 prokázali, že normální lidské buňky se (na rozdíl třeba od bakterií) nemohou množit donekonečna a že zástava jejich růstu je naprosto přirozeným jevem, vyplývajícím ze samotné podstaty buněk (nikoli důsledkem změny životních podmínek apod.). Staré buňky si tedy nějak „pamatují“, že jsou staré…
Ocásky života a smrti
Muller a McClintocková probudili zájem o telomery a jejich funkci. Na víc než domněnky však tehdy neměli výzkumné nástroje. Ty přišly až ve druhé polovině sedmdesátých let s metodami sekvenace DNA (za jejich vývoj padly hned dvě Nobelovy ceny).
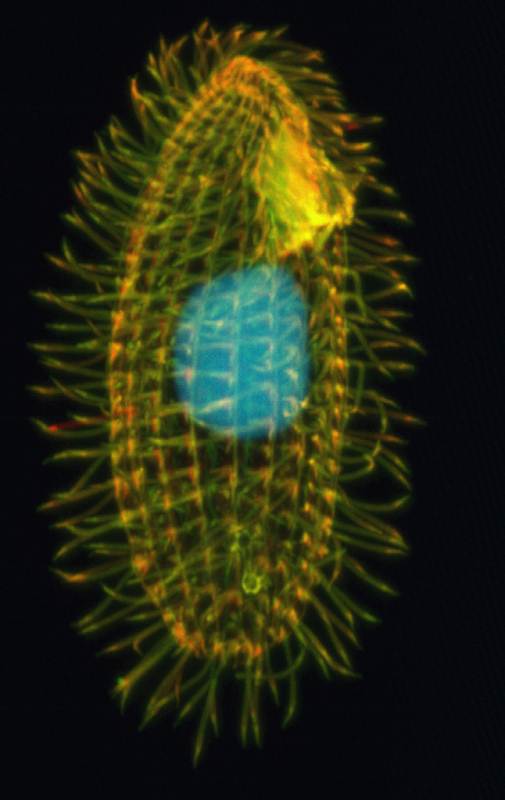
Prvním člověkem, který přečetl písmena telomer, byla australsko-americká molekulární bioložka Elizabeth Blackburnová. Podařilo se jí to u nálevníka Thetrahymena termophila, tehdy oblíbeného modelového organismu. Tento obrvený prvok totiž těsně před dělením naseká své chromozomy na až deset milionů krátkých kousků, které se tehdy líp sekvenovaly. A tak se doktorka Blackburnová v roce 1978 „dočetla“, že na konci každého mikrochromozomu se padesátkrát až sedmdesátkrát opakuje nesmyslný „text“ složený ze „slova“ TTGGGG.
Dnes víme, že na konci chromozomů všech savců a většiny dalších živočichů a části hub se vyskytuje tisíc- až několiktisíckrát se opakující stejný motiv TTAGGG. U rostlin má slovo na začátku jedno „T“ navíc: TTTAGGG. Ale kupříkladu nálevníci stojí stranou s poněkud odlišným slovem, nejčastěji TTTTGGGG nebo již zmíněné TTGGGG.
Přírodní výběr ustavil lidské telomery do takové délky (mezi sedmi až deseti tisíci písmeny), aby mohly přežít zhruba 50 až 100 dělení, což odpovídá 75 až 90 letům námahy, opotřebení, oprav.
To zajisté nabízí zajímavé evolučně biologické konsekvence, nicméně tématu příslušná otázka zní: Proč taková marnotratnost, nota bene u textu, který v buňce nic nekóduje ani nereguluje?
Odpověď už visela ve vzduchu; v roce 1972 James Watson (nobelovský spoluobjevitel struktury DNA) a nezávisle Alexej Olovnikov usoudili, že enzymy kopírující DNA (polymerázy) nemohou začít na samém konci vlákna DNA. Musí začít posunuté o několik slov do textu. Tudíž se text při každém zdvojování o maličko zkrátí. Takže přítomnost telomery umožňuje polymeráze odhryznout si svoji okrajovou libru DNA, aniž by přitom zkrátila životně důležitý text. Našince ihned napadne cimrmanovská analogie telomera – šmaknfošna, nevzdělaný zbytek světa se musí spokojit se suchou představou návlečky, maličkého kousku plechu či plastu chránícího konec tkaničky před roztřepením.
Po každé replikaci chromozomu se tedy kousíček telomery „ztratí“. Po několika stech kopírování se chromozom na konci může zkrátit natolik, že polymeráza aktuálně nejbližší geny zkreslí či pomine a vznikne zmetek.
Přírodní výběr ustavil lidské telomery do takové délky (mezi sedmi až deseti tisíci písmeny), aby mohly přežít zhruba 50 až 100 dělení, což odpovídá 75 až 90 letům námahy, opotřebení, oprav. Telomery v našich tělech se zkracují průměrnou rychlostí asi jednatřicet písmen za rok, v některých tkáních víc. U osmdesátiletého člověka oproti stavu při narození odhoří telomerová svíce života asi ze tří osmin.
Délka telomer je sice výrazně dědičná, ale ani dlouhé telomery nejsou k ničemu, když špatně funguje to ostatní; kupříkladu pokud se tělo nadprůměrně opotřebovává, telomery se brzy zkrátí následkem častějšího buněčného dělení potřebného k opravám/úzdravám tkání.
Laboratorní vánoční pohádka
Současně s rostoucími poznatky o telomerách si vědci nemohli neklást otázku: Proč většina buněk řádně stárne, ale některé – pohlavní, kmenové, ale i některé nádorové, zůstaneme-li u savců – jsou „nesmrtelné“? Podle nejpravděpodobnějšího vysvětlení tyto buňky disponují speciálním enzymem, který dokáže dělením obrušované telomery zase nastavovat. Přesněji řečeno, takové buňky obsahují aktivní gen pro syntézu telomerázy.
Doktorka Blackburnová se v roce 1980 domluvila s Jackem Szostakem, který patřil k pionýrům ve vnášení genetické informace do buněk. Ten připojil opakující se sekvence telomerové DNA z nálevníků k uměle vytvořeným chromozomům, které po vnesení do kvasinek vydržely funkční podstatně déle. To prokázalo, že telomery od nálevníků jsou schopny plnit stejnou funkci i v kvasinkách.
Další pokusy potvrdily, že telomeráza dokáže prodloužit aktivní život buněk a uchránit je před zestárnutím.
Ve stejné době dělala u Blackburnové na Kalifornské univerzitě v Berkeley doktorát Carol Greiderová. Samozřejmě na nálevnících, vždyť ti – třeba oproti člověku s dvaadevadesáti konci chromozomů – nabízejí na počátku svého dělení telomerových konců miliony. To znamená, že v tomto stadiu musí docházet k přirozeném klonování telomer, čili k aktivitě telomerázy. Lze tedy očekávat, že množství telomerázy v nálevnících bude rozhodně detekovatelnější než v savcích.
Jeden z tehdejších pokusů přesáhl až do vánoční doby a doktorandka měla na vybranou – buď ho přeruší (v podstatě eliminuje), nebo bude pracovat i o Vánocích. Na Štědrý den 1984 se tedy vydala do laboratoře a našla tam ve vzorku, jehož hlavní složkou byl extrakt z jader nálevníka Tetrahymena thermophila, původní mikrochromozomy prodloužené o celistvé násobky sekvence TTGGGG. Vzorek tedy obsahoval aktivní telomerázu. To musel být svatvečer!
Další pokusy potvrdily, že telomeráza dokáže prodloužit aktivní život buněk a uchránit je před zestárnutím. (Všichni tři jmenovaní dostali v roce 2009 Nobelovu cenu. Mimochodem, v rostlinách objevil telomerázu v roce 1996 brněnský biolog Jiří Fajkus se spolupracovníky.)
Z poznatků molekulární genetiky vyplývá, že pro každý buněčný enzym existují v jádře geny, které řídí jeho syntézu. První z těchto „genů pro telomerázu“, nazvaný TEP1 („s telomerázou asociovaná bílkovina 1“) a produkující bílkovinnou složku telomerázy, objevil v roce 1997 Japonec Jun-ichi Nakayama (Juniči Nakajama). (Druhou složkou telomerázy je RNA, která slouží jako matrice pro syntézu telomer.)
Tady nutno zdůraznit, že geny pro telomerázu nejsou pro dlouhověkost organismu všechno. Rozdíl mezi buněčnou nesmrtelností a lidskou nesmrtelností je stejně propastný, jako třeba rozdíl mezi amébou a člověkem.
Mezi nesmrtelností a rakovinou
Při normálním lidském vývoji se ve vyvíjejícím se embryu geny kódující telomerázu téměř ve všech tkáních inaktivují. Od té chvíle pak jako by jakýsi pomyslný hlídač v buňce odpočítával počet jejích dělení a v evolučně předem nastaveném bodě (při dosažení určité minimální délky telomer) dělení zastavil.
Proběhla řada pokusů, kdy buňky s vneseným genem pro syntézu telomerázy se zdravě dělily daleko za svoji přirozenou hranici.
Někdy se ovšem v normální buňce vypnuté geny pro telomerázu nějakým způsobem znovu samy aktivují – výsledkem je potom buňka nádorová. Zřejmě nejaktivnější telomerázu ze všech, které známe, mají slavné nádorové buňky HeLa. (V roce 1951 byla v USA založena linie buněk odebraných z velmi agresivního nádoru děložního hrdla právě zemřelé pacientky, jejíž jméno začínalo slabikami „He“ a „La“. HeLa je patrně nejstarší, nejživotaschopnější a rozhodně nejcitovanější buněčná linie na světě, viz také Nesmrtelná žena, Vesmír 95, 12/2016). Avšak jestliže do buněk HeLa přidáme protismyslnou RNA (obsahující přesný opak RNA-zprávy v telomeráze), přítomná telomeráza „oslepne“ a přestane účinkovat. Buňky ztratí nesmrtelnost, zestárnou a zemřou asi po pětadvaceti buněčných děleních.
Vývoj kolem telomerázy hezky ilustruje výzkumnou strategii typu plavby mezi Skyllou a Charybdou. V našem případě potřebujeme aktivovat telomerázu a prodloužit životnost zdravých buněk, ale zase ne tolik, aby se zvrhly v nádorové. A naopak: při léčbě rakoviny potřebujeme inhibovat produkci telomerázy jen natolik, abychom u pacienta neparalyzovali regeneraci ostatních buněk.
Věc je o to složitější, že nic z toho, co tu o telomeráze, stárnutí a nesmrtelnosti padlo, neplatí jednoznačně; v přírodě k téměř všem důležitým dějům existují procesy konkurenční, kompenzační, brzdicí, samozřejmě i záložní (jen způsobů péče o telomery známe u buněk víc než deset, a to i bez účasti telomerázy). V optimálním případě tedy musíme bezpečně a všemi alternativními způsoby umět krotit telomerázu v nádorech a stejně tak aktivovat telomerázu ve zdravých buňkách; teprve potom z toho složit terapii. Věřím, že to jednou dokážeme.
Závěrem si neodpustím malou poznámku o nepředvídatelnosti základního výzkumu: Kdo před čtyřiceti lety mohl tušit, že zrovna výzkum chromozomů jakéhosi obskurního mikroba povede k léčení rakoviny, přípravě kmenových buněk nebo dokonce k flirtování s nesmrtelností?