Terapie nemoci covid-19 z pohledu medicinálního chemika
| 1. 6. 2020Média jsou v poslední době plná zpráv o látkách, které by nám mohly pomoci v boji s onemocněním covid-19. Zpravidla se o nich píše jako o „lécích proti koronaviru“. Míří přitom na různé molekulární cíle a mechanismy svých účinků se mezi sebou liší. Podívejme se podrobněji na molekuly, které interagují s klíčovými enzymy koronaviru SARS-CoV-2. Včetně nejznámější z nich, remdesiviru.
Pro design nových přímo působících antivirotik (z angl. „direct-acting antivirals“), tedy látek, které působí na virové proteiny, je zásadní pochopit, jakým způsobem je strukturován genom koronavirů, jakým způsobem je replikován, přepsán do struktury virových proteinů a co tyto proteiny pro virus dělají. Díky výzkumu na virech SARS-CoV a MERS-CoV již dnes tyto principy do značné míry chápeme, i když množství dílčích informací nám stále chybí.
Koronaviry patří mezi jednovláknové RNA viry s pozitivní polaritou, jejichž genom patří k nejdelším mezi těmito viry (například SARS-CoV-2 obsahuje ve svém genomu zhruba 30 tisíc nukleotidů). Je dost možné, že kvůli omezené integritě a schopnosti korigovat strukturu genomu je tato velikost obecně limitní pro RNA viry jako takové. S tím pravděpodobně také souvisí poměrně složitá struktura genomu koronavirů a komplexita replikačních a translačních mechanismů.
„Už dnes je zřejmé, že hlavní slovo budou mít v terapii látky schopné inhibovat funkci RNA-dependentní RNA polymerázy.“
RNA těchto virů je na jednom konci (tzv. 5'-konci) zakončena tzv. „čepičkou“, která chrání virovou RNA před přirozenou imunitou buněk, před degradací buněčnými enzymy a zároveň zprostředkovává zahájení přepisu této RNA do struktury proteinu. Na druhé straně je virová RNA zakončena sekvencí za sebou následujících adenosinových nukleotidů (tzv. polyadenylová skupina). Tyto modifikace na obou koncích umožňují translaci a zvyšují stabilitu RNA v buňkách. Buňky ji pak vlastně považují za vlastní mRNA a podobně s ní i nakládají.
Možné terapeutické cíle
Vlastní genom koronavirů obsahuje řadu otevřených čtecích rámců, tedy oblastí, které kódují jednotlivé proteiny nebo polyproteiny. Asi třetina celého genomu nese informaci pro přípravu dvou polyproteinů. Ty jsou následně „rozstříhány“ dvěma virovými proteázami na 16 různých proteinů (označovaných jako nsp1–16, což je odvozeno z anglického „non-structural protein“, tedy nestrukturní protein). Tyto proteiny se následně účastní sestavení složitého proteinového komplexu, tzv. replikázy. Ta je odpovědná za kopírování koronavirové RNA a její přepis do struktury proteinů.
Na základě informací, které byly zjištěny při studiu jiných koronavirů, zejména SARS-CoV, víme, že řada těchto nestrukturních proteinů má katalytickou funkci, která je pro životní cyklus těchto virů nepostradatelná. Například proteiny nsp3 (PLpro) a nsp5 (3CLpro) mají funkci virových proteáz a jsou nezbytné pro dříve zmíněné rozštěpení polyproteinů na jednotlivé nestrukturní proteiny.
Podobně jako u ostatních RNA virů je pro replikaci virového genomu zásadní zejména RNA-dependentní RNA polymeráza (RdRp), tedy enzym, který je schopný přepsat virový genom z původní +RNA do –RNA a vytvořit kopie +RNA, které jsou následně zabaleny do virové kapsidy a dalších virových obalů. U SARS-CoV-2 a dalších koronavirů je tato funkce spojena s nsp12.
Další nestrukturní protein je zodpovědný za aktivitu RNA helikázy (nsp13), tedy enzymu schopného enzymaticky rozplést strukturu dvoušroubovice RNA, která vzniká při kopírování genetické informace viru. Bylo také prokázáno, že nsp14 je exoribonukleáza, která umožňuje viru do jisté míry kontrolovat správnost replikované RNA. Je totiž schopna odstranit nesprávně zařazené nukleotidy na konci nově vznikajícího řetězce RNA v průběhu jejího kopírování pomocí RNA-dependentní RNA polymerázy (nsp12, viz výše). Kromě této funkce je protein nsp14 schopen také metylovat guaninovou nukleobázi, která tvoří již zmíněnou čepičku na začátku virové RNA molekuly. Metyltransferázovou aktivitu má i nsp16. Slouží k metylaci cukerné části prvního nukleotidu virové RNA, tedy další modifikace, která je součástí čepičky.
Protein nsp15 má aktivitu endoribonukleázovou, která slouží k rozkladu virové RNA po replikaci, a virus ji zřejmě využívá k tomu, aby se vyhnul časnému rozpoznání hostitelskými buňkami, zejména makrofágy.
Obecně lze říci, že všechny tyto proteiny mají alespoň určitý potenciál stát se cíli pro design nových léčiv, a to díky své katalytické funkci a často také dobře definovanému místu vázajícímu substrát pro danou reakci (přestože například nsp15 není v mnoha buňkách pro virovou replikaci nezbytný). Další nestrukturní proteiny hrají většinou podpůrnou a aktivační roli. Například koronavirová RdRp pro svou funkci potřebuje řadu podpůrných proteinů, které výrazným způsobem zvyšují její aktivitu, jedná se o proteiny nsp7-9. Nsp10 je pak důležitým aktivačním kofaktorem pro nsp14 a 16. Přerušení protein-proteinových interakcí mezi těmito proteiny může proto také vést k pozastavení replikace těchto virů. Je samozřejmě také možné cílit na strukturní proteiny SARS-CoV-2, které jsou kódovány poslední třetinou virové RNA. Těmto proteinům se ale tento text podrobněji nevěnuje.
Lze předpokládat, že hlavními proteiny, na které se bude zaměřovat pozornost medicinálních chemiků v blízké budoucnosti, budou zejména RdRp, obě proteázy a virová helikáza. Vývoj látek inhibujících funkce nsp14-16 bude zřejmě spíše okrajový.
Pojďme se proto podívat na látky, eventuálně typy látek, které by do budoucna mohly hrát důležitou roli v terapii SARS-CoV-2.
Remdesivir a další nukleosidová analoga
Už dnes je zřejmé, že hlavní slovo budou mít v terapii látky schopné inhibovat funkci RNA-dependentní RNA polymerázy. Jako nejnadějnější se v současné době jeví látky, které nepůsobí jako pravé terminátory řetězové polymerační reakce, ale spíše dochází k jejich inkorporaci do RNA a následnému „opožděnému“ ukončení polymerační reakce, jako je tomu u nukleotidového derivátu remdesiviru.
Přestože tato látka zatím není plně schválena, americký Úřad pro kontrolu potravin a léčiv (FDA) ji jako zatím první přímo působící antivirotikum schválil pro tzv. nouzové použití (Emergency Use Authorization). Učinil tak na základě nadějných dat z klinické studie provedené Národním institutem zdraví (NIH) na 1063 pacientech. Tato studie ukázala, že remdesivir zkracuje dobu onemocnění covid-19. Další klinická studie také ukázala, že desetidenní léčba remdesivirem nepřináší statisticky významný zdravotní benefit v porovnání s léčbou jen pětidenní. Evropská léková agentura (EMA) pak vydala stanovisko, ve kterém doporučuje použití remdesiviru pro tzv. program pro soucitné použití (compassionate use), jež je podporováno také Státním ústavem pro kontrolu léčiv České republiky (SÚKL).
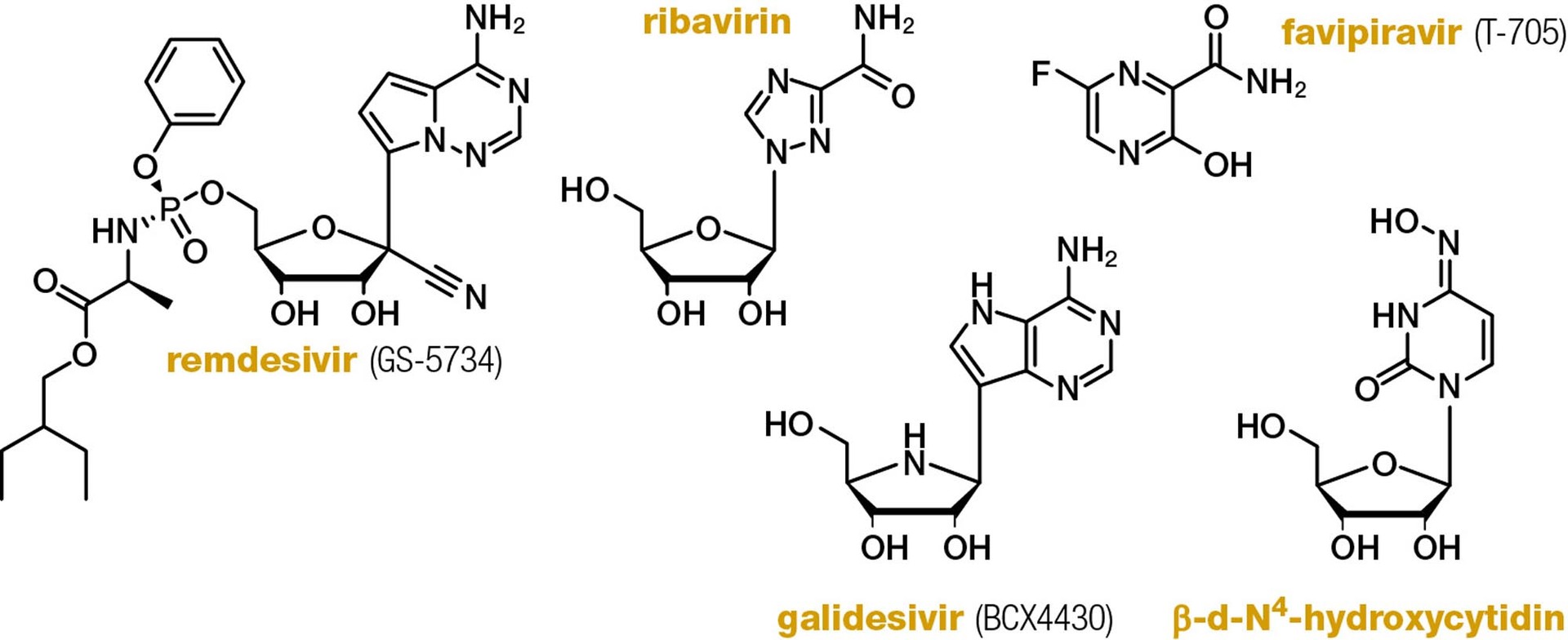
Podobný mechanismus účinku by mohl mít také galidesivir (BCX4430), který ale na buněčných kulturách nevykazuje zdaleka tak výraznou aktivitu proti koronavirům SARS-CoV a MERS-CoV jako remdesivir (obr. 1).
Další možností je tzv. letální mutageneze, která je předpokládaným mechanismem účinku favipiraviru. Letální mutageneze je děj, při kterém mutagen nebo v tomto případě léčivo indukuje takové množství mutací ve virovém genomu, které je neslučitelné s udržitelností kompaktnosti genetické informace nutné pro životní cyklus viru. Virus zmutuje do takové míry, že není schopen další replikace a v principu umírá. Favipiravir je látka, která byla původně vyvinuta proti chřipce a je pro tuto indikaci schválena a registrována v Japonsku. Látka prošla několika menšími klinickými studiemi v Číně, ve kterých vykazovala znatelné zlepšení pacientů léčených v úvodních stadiích onemocnění covid-19. Favipiravir je možné použít také v České republice na základě zvláštního povolení ministerstva zdravotnictví.
Na podobném principu fungují také některá další antivirotika, např. ribavirin, který ale zatím neprokázal významnější aktivitu ani proti SARS-CoV, ani SARS-CoV-2, přestože některé klinické studie s touto látkou stále pokračují. β-d-N4-hydroxycytidin je v současné době také jedním z potenciálních nadějných nukleosidových analogů. Rovněž u něj je předpokládaným mechanismem účinku letální mutageneze. Tato látka byla zatím úspěšně testována na lidských buňkách a experimentálních myších modelech nakažených SARS-CoV-2.
Tato data obecně naznačují, že nová nukleosidová nebo nukleotidová analoga, která budou v nejbližší době designována jako specifická léčiva proti SARS-CoV-2, pravděpodobně nebudou klasickými terminátory polymerázové reakce. To může být způsobeno určitým korekčním mechanismem, který si tyto viry vybudovaly a který je spojen s výše zmíněnou exonukleázovou aktivitou nsp14. Přestože je v dnešní době repertoár nukleosidových derivátů s potenciální aktivitou proti koronavirům poměrně omezen, lze předpokládat, že díky enormnímu úsilí, které bude v následujících měsících a letech výzkumu těchto látek věnováno, bude objevena řada nových nebo již dříve známých derivátů s potenciálem SARS-CoV-2 inhibovat a dostat se do klinické praxe.
Inhibitory proteáz
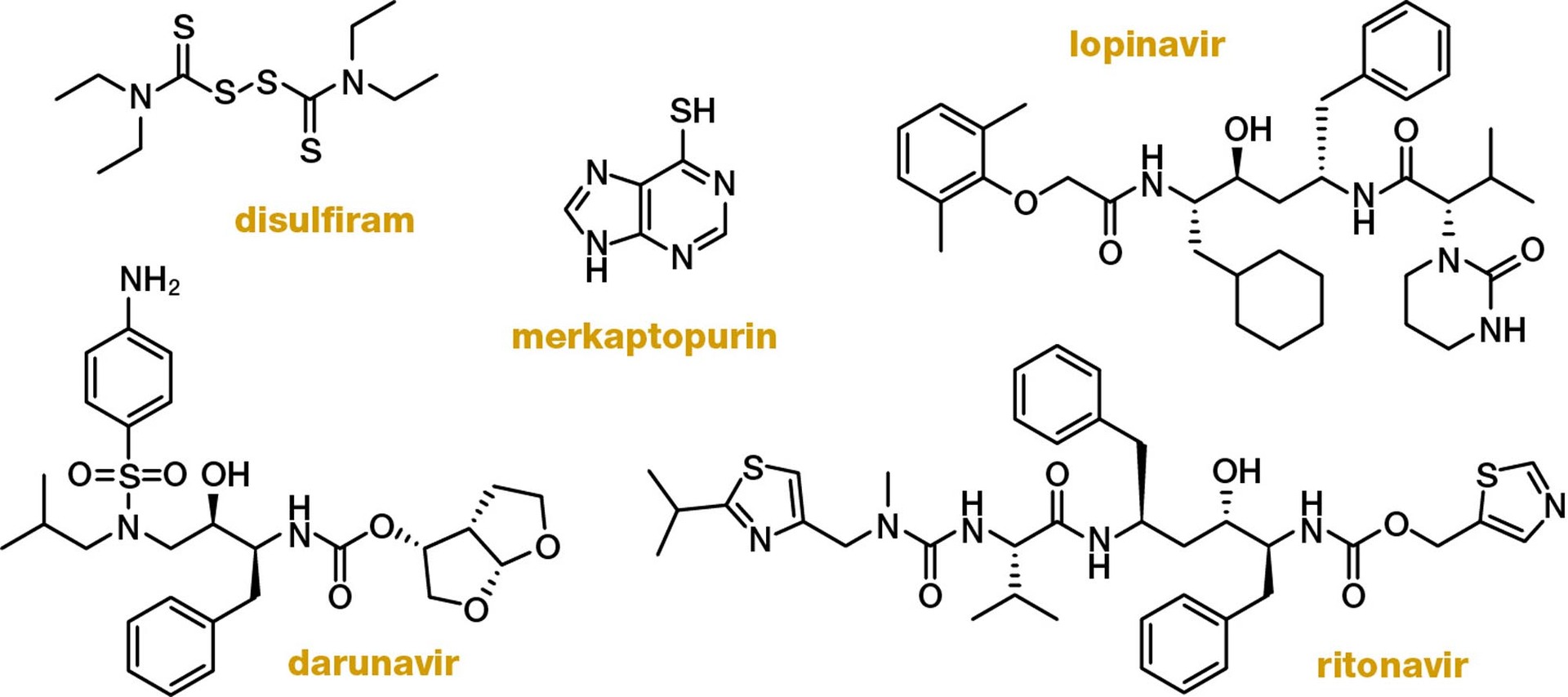
Druhou skupinou látek, která jistě najde své místo v léčbě covid-19 nebo podobných koronavirových infekcí, budou inhibitory proteáz těchto virů. Tyto látky jsou v současné době hledány především mezi již známými léčivy. Mezi inhibitory první z proteáz (PLpro, nsp3) může patřit například disulfiram, využívaný v klinické praxi jako podpůrná léčba u alkoholismu, případně některé deriváty merkaptopurinu, který je využíván k léčbě pacientů s autoimunními onemocněními a rakovinou. Obě tyto látky jsou schopny inhibovat PLpro SARS-CoV nebo MERS-CoV a mohly by najít uplatnění také v tomto případě.
Velká pozornost bude zřejmě věnována výzkumu inhibitorů 3CLpro (nsp5), která je hlavní proteázou těchto virů a je zodpovědná za odštěpení největšího počtu proteinů z původních polyproteinů vzniklých translací. V současné době si pozornost získaly zejména látky schválené pro inhibici HIV proteázy. Jmenovitě lopinavir, ritonavir, darunavir v kombinaci s combicistatem a některé další experimentální preparáty (obr. 2). Přestože některé z těchto látek mají prokazatelnou aktivitu jak na buněčných kulturách, tak na zvířecích modelech SARS-CoV nebo MERS-CoV, jejich účinnost na pacientech s covid-19 zatím nebyla prokázána.
Je zcela zjevné, že obě proteázy jsou vhodným cílem pro protivirovou terapii, a je zřejmé, že se stanou důležitou součástí terapie koronavirových onemocnění a předmětem intenzivního studia, a to jak na půdě akademické, tak ve farmaceutickém průmyslu. V tomto případě bude pravděpodobně výzkum znatelně potencován strukturně biologickými studiemi a molekulovým modelováním.
Inhibitory helikázy a jiné možnosti
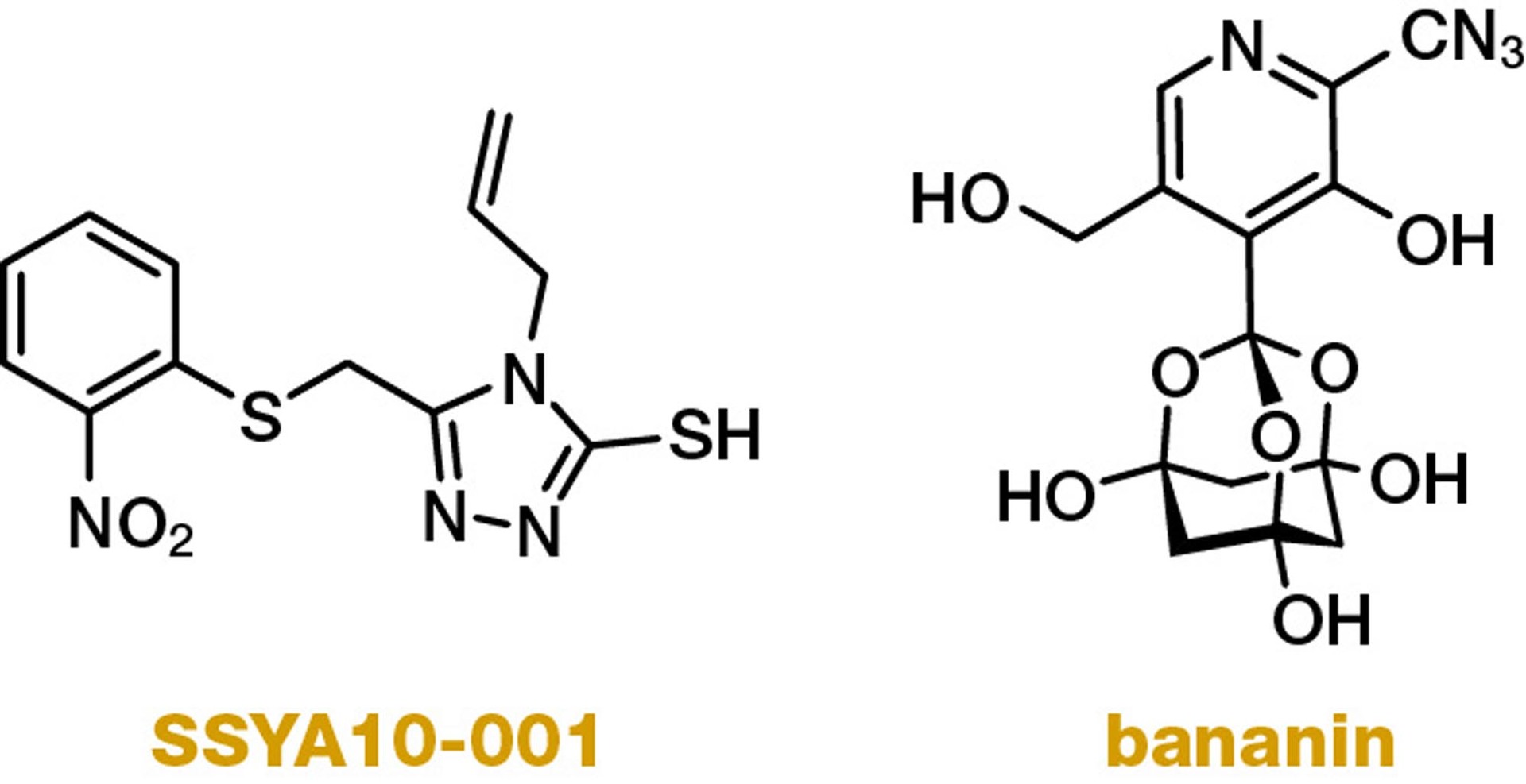
Důležitou úlohu v patogenezi koronavirových onemocnění hraje také koronavirová helikáza. Přesto je vývoj většiny látek spojených s tímto cílem ve velmi raných stadiích a je známo jen několik málo látek, které jsou schopny tento enzym efektivně inhibovat. Jedná se například o látku SSYA10-001, inhibitor, který prokázal účinnost proti helikázové aktivitě SARS-CoV nsp13, bez ovlivnění spojené ATPázové aktivity. Naproti tomu adamantanová analoga zvaná bananiny vykazují aktivitu jak proti helikázové, tak proti ATPázové aktivitě tohoto proteinu (obr. 3). Obecně se ale virové helikázy považují za vhodné cíle pro protivirovou terapii, a proto lze očekávat, že budou vyvíjeny nové inhibitory i pro tento enzym.
Toto je jen krátký přehled možných přístupů k terapii koronavirových infekcí s ohledem na nestrukturní proteiny těchto virů. Nejsou zde zohledněny strukturní proteiny, jako například spike glykoprotein, nebo struktury hostitelských buněk, které jsou nepostradatelné pro virovou replikaci. I v tomto případě bude zřejmě na prvním místě studium látek, které jsou již v aktivní klinické praxi a jejich schválení může být proto výrazně rychlejší. Jedním z takových příkladů je hydrochlorochin – látka, která inhibuje acidifikaci endozomu během infekce a zabraňuje vstupu viru do buněk (viz s. 346). SÚKL umožnil tuto látku testovat v kombinaci s antibiotikem azithromycinem v klinických hodnoceních u pacientů s nemocí covid-19 na intenzivní péči.
Všechny tyto potenciální molekulární cíle ale pravděpodobně budou v nejbližší době využity pro nalezení účinné terapie pro covid-19 a další, obdobně závažná koronavirová onemocnění. Je také velmi pravděpodobné, že v budoucnosti budeme při zvládání nemoci covid-19 používat kombinace takto získaných léčiv a případně přistupovat k terapii v závislosti na průběhu onemocnění a stavu pacientů. Antivirovou léčbu bude nutné aplikovat co možná v nejranějším stadiu onemocnění, zatímco pozdější stadia budou spojena s přehnanou imunitní odpovědí organismu, tzv. cytokinovou bouří, (z anglického „cytokine storm“). Zde bude zřejmě vhodné aplikovat léčiva typu protilátek proti receptorům pro interleukin IL-6, jako například tocilizumab nebo sarilumab (opět viz s. 346), případně proti dalším receptorům, např. CCR5.
Psáno pro Učenou společnost České republiky a pro Vesmír (aktualizováno, upraveno)
Viz rovněž články Současné možnosti léčby nemoci covid-19 a Paradoxy infekce způsobené SARS-CoV-2.
Ke stažení
 článek ve formátu pdf [472,81 kB]
článek ve formátu pdf [472,81 kB]
O autorovi
Radim Nencka