Malé RNA: Mocní trpaslíci
| 2. 2. 2015Malé molekuly RNA plní ohromující množství biologických rolí a navzdory malé velikosti jsou nepostradatelné pro organismy od prvoků až po člověka. Přesto až do konce 90. let unikal tento skrytý svět naší pozornosti. V novém tisíciletí však malé RNA způsobily v biologických vědách hotovou revoluci a v posledních letech nacházejí výsledky výzkumu na tomto poli uplatnění také v humánní medicíně.
V roce 2002 je časopis Science zcela právem označil jako „průlom roku“ a v roce 2006 byla za klíčový objev v oblasti malých RNA udělena Nobelova cena. Pokusíme se přiblížit některé z plejády mechanismů malých RNA včetně těch epigenetických. Nejprve si ale připomeňme nejdůležitější informace o RNA obecně:
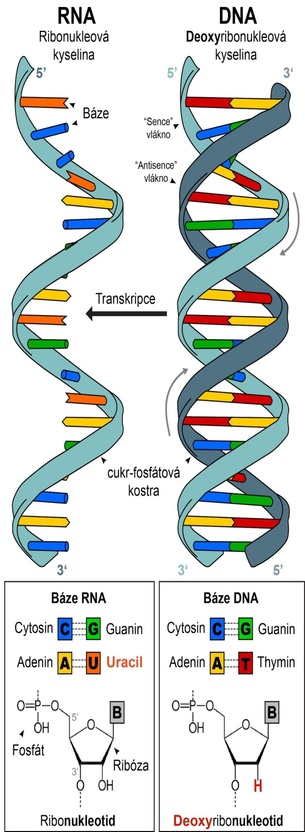
Život, jak ho známe, je založen na informacích uložených v nukleových kyselinách. Jejich klíčovou vlastností je komplementarita nukleotidů (viz Nukleové kyseliny a princip komplementarity). Navzájem komplementární sekvence se k sobě váží a vytvářejí dvouvláknové šroubovice. Toto uspořádání není vyhrazeno jen deoxyribonukleové kyselině (DNA), která se vyskytuje v jádře a je nositelkou dědičné informace. Podobné uspořádání může zaujmout i ribonukleová kyselina (RNA), která je obvykle jednovláknová, podílí se na přenášení informace zakódované v DNA a má spíše dočasný charakter. Různé druhy molekul RNA se liší svou funkcí, nejznámější messengerové RNA (mRNA) přenášejí instrukce k výrobě proteinů, a plní tak roli jakýchsi poslíčků mezi DNA a výrobou proteinů.
Nukleové kyseliny a princip komlpementarity
Molekuly nukleových kyselin (DNA a RNA) jsou různě dlouhé řetězce nukleotidů (písmen genetického kódu). Nukleotidy se skládají z fosfátu, cukru (ribózy) a báze (B). Zásadní rozdíl ve stavbě RNA a DNA je chybějící atom kyslíku v ribóze – jde tedy o deoxyzribózu.
Báze, které tvoří písmena genetické abecedy pro zápis informace do DNA jsou čtyři: adenin (A), thymin (T), guanin (G) a cytosin (C). V RNA je místo thyminu uracil (U).
Báze nukleotidů vytvářejí vodíkové můstky (přerušované čáry mezi bázemi) pouze s jedním z ostatních nukleotidů, a to tak, že pár tvoří A-T a C-G. Tento princip se nazývá komplementarita a umožňuje nám na základě znalosti sekvence jednoho vlákna určit i sekvenci toho druhého. Díky komplementaritě mohou buňky zkopírovat genom při každém dělení a v případě poškození jednoho z vláken použít to druhé jako předlohu k opravě. V procesu zvaném transkripce (přepis) je podle sekvence v DNA vyrobena konkrétní molekula RNA. (Grafika vpravo upravena z Wikimedia Commons, autor předlohy: Sponk, licence CC BY-SA 3.0)
Malé RNA jsou biologicky aktivní krátké řetězce ribonukleových kyselin složené pouze z 20-30 nukleotidů. Pro srovnání: kompletní genetickou informaci člověka uloženou v jeho DNA tvoří více než 3 miliardy nukleotidů. Malé RNA plní nejčastěji obrannou a regulační funkci a mohou fungovat v cytoplazmě i v jádře.
Pradávný obranný mechanismus RNA interference
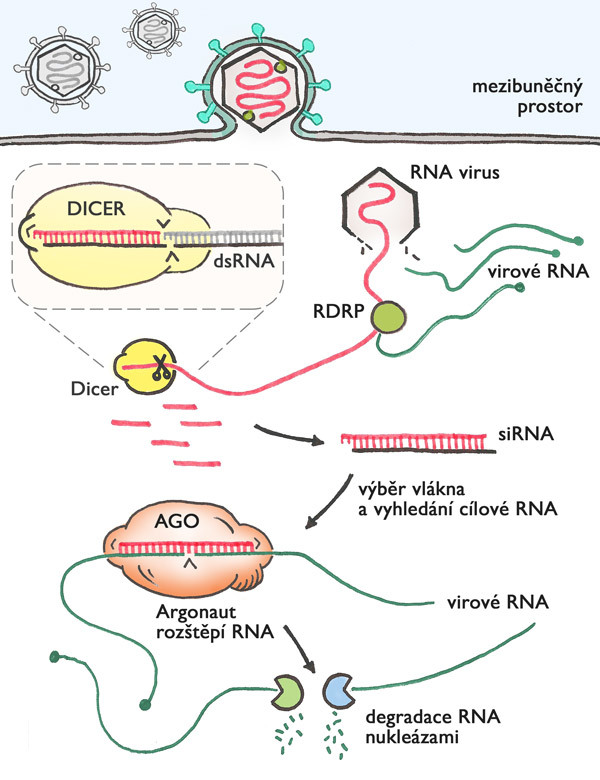
Dvouvláknová molekula RNA (dsRNA) se v buňkách organismů příliš nevyskytuje. Zato se objevuje v životním cyklu virů s genetickou informací zakódovanou v RNA – a takových virů je většina. Přítomnost dsRNA v buňkách je proto signálem ohrožení, který spouští obranné mechanismy. Jedním typem takového mechanismu je „RNA interference“ (RNAi). Základy tohoto mechanismu musel mít už předek všech mnohobuněčných organismů, protože dnešní RNAi funguje velice podobně u prvoků, rostlin, hub i živočichů.
Mechanismus antivirové obrany skrze RNAi je elegantně jednoduchý (obr.1) – množící se RNA virus vytváří dvoušroubovici RNA, která je rozpoznána a nasekána na krátké fragmenty (malé RNA označované jako siRNA). Obojí provede enzym s příznačným jménem dicer („ten, který nakrájí“). Jedno z vláken useknuté malé dvoušroubovice RNA si vybere a naváže protein argonaut, který s ním putuje buňkou. Když najde pomocí malé RNA komplementární virovou RNA molekulu, naváže se na ni, přeštípne ji a tím ji zlikviduje. Jedna molekula virové dsRNA dá vznik několika malým siRNA, které jsou po navázání na argonaut proteiny použity opakovaně pro vyhledání a zničení mnoha a mnoha molekul virové RNA. Díky tomu je buněčná obrana pomocí RNAi efektivní. Dicer funguje jako molekulární řezačka, která z dsRNA vytváří malé RNA o délce mírně přes dvacet nukleotidů. (Viz také Terezie Imrichová: O diceruO, Vesmír 93, 334, 2014/6.) Kombinace dvaceti písmen v řadě je dlouhá dost na to, aby RNAi v buňce dokázala odlišit vlastní užitečné molekuly RNA od virových.
Revoluce ve studiu genů a (možná) i v medicíně
RNAi způsobila naprostou revoluci ve studiu genů. Původně obranný systém RNAi lze totiž ošálit a podstrčit mu dsRNA anebo siRNA komplementární k vybranému buněčnému genu. RNAi poslušně vyhledá komplementární RNA molekuly (v tomto případě produkty genu) a zlikviduje je. Pokud tedy vědci například potřebují během experimentu snížit aktivitu konkrétního genu v kultivovaných lidských buňkách, mohou si dnes na internetu objednat synteticky připravenou siRNA a dopravit ji do buněk. O zbytek se postará mechanismus RNAi. Zde je nutné přiznat, že účinné použití RNAi technologie je o něco komplikovanější, než by se mohlo zdát z výše uvedeného příkladu, nicméně RNAi je často ten nejlepší nástroj, který je k dispozici.
Zatímco u rostlin a jednodušších organismů lze dopravit do buněk přímo dlouhou dsRNA, ze které se vytvoří mnoho krátkých siRNA, u savců a ptáků je to problém. Během evoluce se u nich totiž objevila interferonová imunitní odpověď na dsRNA (virovou i uměle dodanou), která zastaví všechny důležité procesy v postižené buňce včetně RNAi. Tento fakt lze obejít pouze přímým použitím krátkých siRNA, které tuto reakci nevyvolávají.
RNAi se rychle dostala také do hledáčku aplikovaného výzkumu a farmacie. Výzkum se soustřeďuje na použití RNAi v antivirové a nádorové terapii. V roce 2013 publikovali španělští vědci výsledky první klinické studie s využitím krátkých siRNA zacílených proti dvěma hyperaktivovaným genům u pacientů s rakovinou. Pacienti léčbu dobře snášeli a v některých případech došlo nejen k zastavení růstu nádoru, ale i k vymizení jejich metastáz v játrech. Kritickým problémem zůstává doprava siRNA do buněk. V této studii vědci využili lipidových nanočástic, kterými malé RNA obalili. Takové nanováčky zvláště dobře pronikají do jaterních buněk, na většinu tkání však bohužel nestačí. Vědci se proto snaží nacházet nové způsoby dopravy siRNA do tkání a buněk. Účinnost léčby rakoviny zvyšuje zacílení více onkogenů najednou a pečlivé předchozí testování účinnosti vybraných siRNA na myších modelech rakoviny.
Pestrá evoluce mechanismů malých RNA
V průběhu evoluce vznikla z původní obranné RNA interference celá rodina příbuzných mechanismů, adaptovaných k rozličným funkcím. Dnes tyto mechanismy nazýváme souhrnně „RNA silencing“ nebo mechanismy malých RNA. Všechny mají nejméně dva společné faktory: malou RNA a nějakou formu argonautu. Obvykle je přítomen i dicer, ale není to nutně pravidlem. Řada organismů využívá ještě speciální RNA polymerázu (RDRP = RNA-dependentní RNA polymeráza) – enzym, který umí vytvářet z vybrané jednovláknové RNA dvouvláknovou, a tím dokáže buď celý umlčovací proces nastartovat, nebo posílit.
Pro ilustraci, jak komplikované systémy malých RNA se vyvinuly během evoluce, můžeme zmínit, že rostliny využívají čtyři různé dicery, osm argonautů a tři různé RDRP. Háďátku stačí jeden dicer, ale má 27 různých argonautů a čtyři různé RDRP. Funkce jednotlivých enzymů se často překrývají, někdy jsou však velmi specializované. U savců, kde je situace jednodušší, je obvykle jeden sicer, osm argonautů, a žádná RDRP. Kvasinka Schizosaccharomyces pombe má jenom jeden dicer, jeden argonaut a jednu RDRP. Zajímavé je, že nejznámější a lidmi nejoblíbenější kvasinka Saccharomyces cerevisiae malé RNA nepoužívá vůbec – a tím je jednou z mála známých výjimek.
Malé RNA fungují v cytoplazmě i v jádře. Výše zmíněná RNAi a níže popsané mikroRNA fungují především v cytoplazmě. V jádře malé RNA hrají roli v procesech, které mění přímo genetickou informaci, anebo DNA „umlčují“ tím, že ji opatřují tzv. epigenetickými značkami.
Regulace genové aktivity pomocí mikroRNA
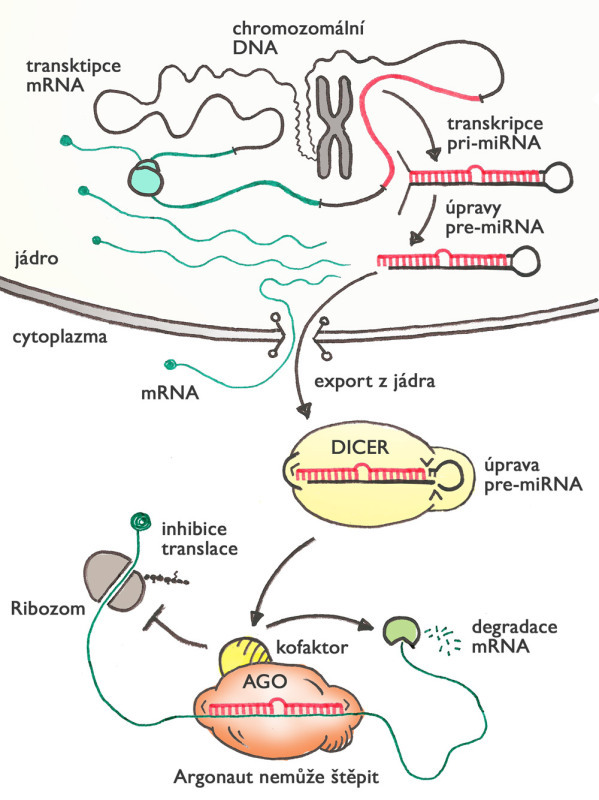
Jeden z mechanismů malých RNA, který se vyvinul (pravděpodobně paralelně) u rostlin a živočichů, je regulace genové aktivity prostřednictvím mikroRNA. Princip tohoto mechanismu je podobný jako u RNAi, ale liší v několika aspektech. Zaprvé, mikroRNA jsou zakódované přímo v genomu, a tak mají vždy přesně definovanou sekvenci nukleotidů. Za druhé, mikroRNA nemusí být stoprocentně komplementární, aby zakotvila argonaut na cílové molekule mRNA. Díky tomu může jediná mikroRNA blokovat i více různých mRNA (a tedy i genů).
Na rozdíl od RNAi argonaut obvykle cílovou RNA nepřesekne, ale zablokuje produkci proteinu, který cílová mRNA kóduje. Když buňka potřebuje snížit aktivitu různých genů, nemusí přímo kontrolovat syntézu RNA v jádře, ale může zapnout produkci konkrétních mikroRNA, které se o zbytek postarají v cytoplazmě. Nejde přitom o nějaký druhořadý mechanismus – u lidí bylo dosud popsáno více než 2500 mikroRNA (u myší 2000) a odhaduje se, že až 60 % genů může být regulováno tímto způsobem. MikroRNA se podílejí prakticky na všech myslitelných buněčných procesech, a hrají také roli v různých chorobách, mimo jiné v nádorech.
Malé RNA měnící genetickou informaci
Přímá kontrola obsahu genetické informace řízená malými RNA byla pozorována u jednobuněčných nálevníků (Ciliophora), u kterých dochází během jejich životního cyklu k eliminaci části genetického materiálu v „provozním“ jádře (macronucleus). Tato eliminace je řízena malými RNA molekulami, které označí genetický materiál určený buď ke zničení (u trepky Paramecium), nebo k ochraně před zničením (u skupiny Oxytricha). Eliminace DNA je evidentně vysoce odvozený mechanismus, který se objevuje jen u jedné speciální skupiny organismů. Její existence však zároveň dokládá evoluční potenciál malých RNA, které zde získaly naprosto unikátní roli.
piRNA – dvouúrovňová obrana genomu před parazitickou DNA
„Umlčení“ genetické informace je dalším projevem obranné role malých RNA. Komplexní eukaryotické genomy obsahují velké množství nekódující DNA (u člověka asi 98 %), tedy sekvencí, které nenesou informaci pro výrobu proteinů. Takové sekvence byly někdy souhrnně nazývány jako „junk DNA“, českým ekvivalentem může být „DNA haraburdí“. Mezi DNA haraburdí patří úseky mobilní DNA, které se dokážou v genomu množit a přeskakovat z místa na místo, proto se také označují jako parazitická DNA. Z velké části jde o tzv. retrotranspozony – pozůstatky retrovirů, které se během evoluce integrovaly do DNA, avšak ztratily schopnost vytvářet infekční virové částice a opustit infikovanou buňku. Místo toho se šíří po genomu a přenášejí se z generace na generaci.
Aby nedošlo k poškození genů a k nekontrolovanému zvětšování genomu, musí se buňky šíření parazitické DNA bránit a využívají k tomu i malé RNA. Životní cyklus retrotranspozonů se neobejde bez RNA meziproduktů a musí probíhat během vývoje pohlavních buněk, protože jen změny DNA v zárodečných buňkách mají šanci se přenést do další generace. A právě zde se u živočichů objevuje další třída malých RNA nazývaných piRNA („PIWI Interacting“). PIWI proteiny jsou druhem argonautů, který je přítomen v pohlavních buňkách. PIWI s pomocí navázané piRNA vyhledávají molekuly RNA pocházející z retrotranspozonů a likvidují je podobně jako antivirová RNAi likviduje virové RNA. Jasné důkazy, že piRNA skutečně kontrolují mobilní DNA, přinesly experimenty, během nichž vědci PIWI proteiny zmutovali. Chybějící obrana vedla v pohlavní linii buněk k masivní aktivaci retrotranspozonů, která zapříčinila genomovou nestabilitu a v důsledku neplodnost.
Na rozdíl od antivirových siRNA a regulačních miRNA jsou molekuly piRNA produkované přímo z jednovláknového RNA meziproduktu přepsaného podle úseků parazitické DNA. Nevyžadují tedy dicer. Od prvních dvou zmíněných se piRNA liší také větší délkou – typicky 26-31 nukleotidů – a speciálně upraveným 3’ koncem, který zvyšuje jejich stabilitu. Přesný mechanismus jejich vzniku z dlouhých jednovláknových RNA dosud není zcela znám.
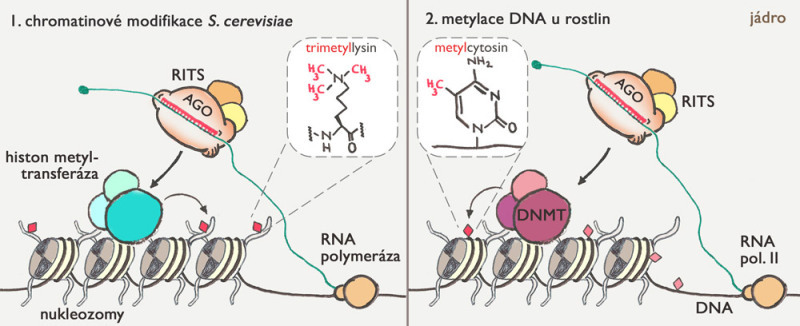
Vedle likvidace retrotranspozonové RNA mají piRNA ještě další funkci. Mutace genů pro PIWI proteiny u savců ukázaly, že piRNA v jádře dokážou označit přímo DNA retrotranspozonů a blokovat syntézu retrotranspozonové RNA. Děje se tak pomocí chemické modifikace cytosinu (jednoho z výše zmíněných nukleotidů) pomocí metylové skupiny (-CH3) – viz obr. 3. Metylace cytosinu je zachovávána i během replikace, takže hovoříme o epigenetické informaci – to je taková, která se přenáší při dělení buňky, ale není kódovaná pořadím nukleotidů v DNA. Metylace cytosinu je blokovací značka – zjednodušeně říká, že tento úsek DNA nemá být využíván pro zahájení tvorby RNA. Retrotranspozony jsou v savčí DNA běžně označené těmito značkami. U myší postrádajících PIWI proteiny však tyto značky z DNA pohlavních buněk zmizely. Jakým způsobem jsou piRNA zapojeny v procesu metylace DNA retrotranspozonů zatím nevíme, je však zřejmé, že piRNA umí nejen likvidovat RNA, ale také blokovat retrotranspozony přímo v genomu.
Malé RNA a epigenetika – dva různé příklady na závěr
Epigenetika studuje informace, které se přenášejí z generace na generaci (buněk či organismů), ale nejsou uložené přímo v DNA. Klasický příklad epigenetické informace představuje výše zmíněná metylace cytosinu, která funguje u rostlin a obratlovců. DNA je v jádře navinutá na nukleozomy, což jsou poměrně velké struktury připomínající špulku, která je složená z osmi proteinových podjednotek, nazývaných histony (obr. 3 dole). Buňky označují histony různými chemickými značkami, které mění „utažení“ navinutí DNA, což má vliv na transkripci (přepis z DNA do RNA). Pokud nukleozom nese blokovací značku, DNA, která je na něm navinutá, nebude použita pro zahájení syntézy RNA. Mluvíme o takzvaném histonovém kódu – dalším druhu epigenetické informace.
Epigenetická informace je regulovatelná a představuje buněčnou paměť, která buňce mj. umožňuje znovu nastavit zapnutí a vypnutí genů po buněčném dělení a hlídat, které oblasti genomu (například obsahující parazitickou DNA) zůstanou „umlčené“ jako tzv. heterochromatin. Heterochromatinové úseky DNA jsou těsně zabalené a buňky je nadále nepoužívají a nepřepisují podle nich žádné molekuly mRNA. Protože jde o rozpoznání konkrétních sekvencí, asi nepřekvapí, že k označení úseků určených k umlčení slouží opět malé RNA.
Mezi nejlépe prozkoumané epigenetické regulace řízené malými RNA patří metylace DNA u rostlin a vznik heterochromatinu u Schizosaccharomyces pombe (obr. 3). Oba mechanismy se s vysokou pravděpodobností vyvinuly nezávisle na sobě, ačkoliv oba využívají homology diceru, argonautů a RDRP. V obou případech se zdá, že malá RNA se neváže přímo na DNA, ale rozpoznává RNA molekulu tvořící se v umlčované oblasti. Zdá se paradoxní, že umlčení tvorby RNA závisí na tvorbě RNA. Ale souhlasí to s dnešním pohledem na aktivitu genomu, kdy některé typy RNA vznikají i v umlčených částech genomu.
V případě metylace DNA u rostlin (obr. 3 vpravo) vznikají malé RNA v jádře, v jadérku se spojují s argonauty a vyhledávají cílová místa v genomu, kde potom způsobí metylaci cytosinu. Další mechanismy pak zajišťují, že tato metylace zůstane zachována během dělení buněk. Tento proces slouží v rostlinách také jako obrana proti cizorodé DNA (takzvaná Co-suppression) a byl objeven v petůniích dokonce řadu let před objevem RNAi.
Protože rostliny nemají žádnou stálou linii pohlavních buněk, ale vytvářejí je až v květech přeprogramováním buněk jejich zelených částí, je u nich DNA metylace také prostředkem tzv. adaptivní evoluce. Pokud dojde v jedné z buněk rostoucí části rostliny k umlčení vhodného genu tak, že to poskytne dcerám této buňky výraznější výhodu pro další růst, může se taková získaná epigenetická modifikace přenášet v květu na pyl, a tak do dalších rostlin. U savců se totiž mutace v DNA ani změny v epigenetické informaci v tělních buňkách nemohou nijak přenést do linie pohlavních buněk, proto u nich adaptivní evoluci prakticky nepozorujeme. O zajímavé výjimce psal Jaroslav Petr v článku Jak předávají otcové svá traumata potomkům? (Vesmír 93, 332, 2014/6).
Posledním příkladem je vznik heterochromatinu v Schizosaccharomyces pombe, kde malé RNA navádějí umlčující komplex do správných míst v genomu, kde potom dochází ke vzniku umlčovací chromatinové značky odborně označované H3K9me3 – pro zvídavé: jde o tři metylové skupiny navázané na lysin číslo 9 v histonu 3 které vytváří vazebné místo pro heterochromatinový protein 1.
Vztah mezi epigenetickými regulacemi a malými RNA u živočichů (a zejména savců) patří mezi nejméně prozkoumané (a nejvíce kontroverzní) role malých RNA. O této ožehavé problematice na stránkách Vesmíru někdy příště.
K dalšímu čtení
Ketting, R. F.: The Many Faces of RNAi (Review). Developmental Cell, 2011. DOI: 10.1016/j.devcel.2011.01.012