Džungle epigenetických modifikací u rostlin
| 2. 2. 2015U rostlin se setkáváme s mnohem širším spektrem drah podílejících se na regulaci epigenetických modifikací, než je tomu u většiny jiných organismů. Jedním z možných vysvětlení je, že v říši rostlin, kde je habitat pevně určen ve chvíli vyklíčení, byla v evoluci více akcentována nutnost vyrovnat se se změnami okolního prostředí, a to jak přechodnými, tak dlouhodobými.
Za takových podmínek je výhodné zachovat si zvýšenou plasticitu genomu, která může být zdrojem vyšší variability, ale na druhou stranu je pak nutné k jeho regulaci zapojit sofistikovanější mechanismy, aby nedocházelo k jeho zvětšování nad únosnou mez nebo ke ztrátě jeho integrity.
Reverzibilní epigenetické modifikace pro rostlinu představují možnost jak regulovat dynamické změny ve svém genomu, díky tomu poměrně pružně reagovat na měnící se životní podmínky, změněné nastavení genové exprese následně ekonomicky udržovat (není třeba degradovat již vytvořenou RNA či proteiny) a zároveň jej i předávat dceřiným buňkám či dokonce do potomstva. Kromě toho epigenetické modifikace také významně regulují některé vývojové události v životě rostliny, především ty související s rozmnožováním.
Slovníček pojmů
Histon – bazická bílkovina, která se těsně váže na DNA. Osm histonů + 160 párů bází DNA tvoří základní organizační strukturu chromatinu zvanou nukleozom.
Chromatin – komplex nukleových kyselin a proteinů v jádře eukaryotické buňky. Nejvyšší organizační jednotkou chromatinu je chromozom, nejnižší nukleozom (viz heslo Histon).
Malá RNA je krátká jednovláknová molekula RNA (u rostlin většinou o délce 21-24 nukleotidů). Sekvence malé RNA určuje to, co bude cílem působení RNA interference (RNAi). Například pokud je sekvence malé RNA komplementární k transkriptu nějakého genu, pak exprese tohoto genu může být regulována procesem RNAi. Existuje ale mnoho rozličných procesů souvisejících s nukleovými kyselinami, které může RNAi řídit – například metylace DNA (popsáno v textu).
Promotor je regulační sekvence genu, ze které je zahajována transkripce. Vázat se na ní mohou jak obecné transkripční faktory s RNA polymerázou, tak specifické aktivátory nebo represory transkripce.
Palindrom (z řeckého palindromos, běžící pozpátku) je obecně sled znaků, které lze číst oběma směry, aniž by došlo ke změně významu, např. věta: I Zeman ležel na mezi. V případě palindromatické sekvence DNA jde tedy o takovou sekvenci, která je na komplementárních vláknech stejná, pokud je z obou čtena ve směru od 5´ ke 3´ konci. Pokud je tak na jednom vlákně sekvence CG, pak na tom komplementárním je také CG.
Retrotranspozon je typ transponovatelného elementu (TE) využívající ke své replikaci RNA intermediát, který je během transpozice přepsán zpět do DNA. To znamená, že sekvence jednoho aktivovaného retrotranspozonu se prostřednictvím RNA transkriptu může opakovaně “nakopírovat a vložit” do nových míst v genomu. Sekvence LTR retrotranspozonů je z obou stran ohraničena tzv. dlouhými koncovými repeticemi (long terminal repeats), které hrají roli při replikaci a transpozici tohoto typu retrotranspozonů.
Vlásenka je molekula RNA (případně i DNA) obsahující sekvence, které jsou vůči sobě komplementární, tedy vytvoří dvouvláknový úsek v rámci jediné molekuly.
Typy epigenetických modifikací chromatinu
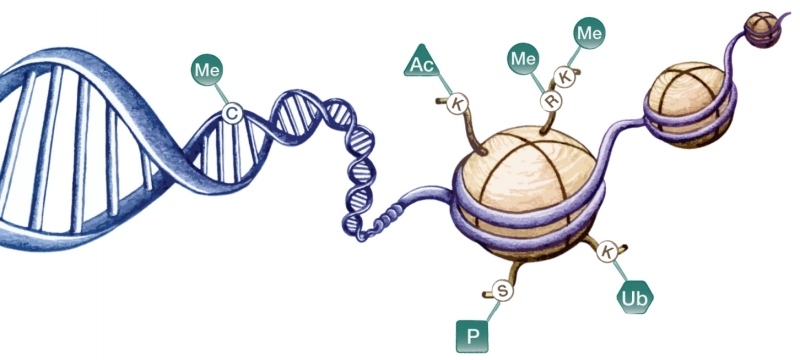
Posttranslační kovalentní histonové modifikace, ke kterým dochází na N-koncích histonů vyčnívajících z jinak kompaktní struktury nukleozomů, představují nejvariabilnější typ epigenetických modifikací (viz Jana Švorcová, Anton Markoš: Epimutace proteinů. Může docházet k mono- až trimetylaci, acetylaci, fosforylaci, ubikvitinaci, sumoylaci či ADP-ribozylaci různých aminokyselinových zbytků na různých typech histonů.
Tyto modifikace mohou vést ke změnám v interakcích mezi DNA a histony, vytvářet nebo naopak blokovat vazebná místa pro jiné proteiny podílející se na regulaci genové exprese. V některých případech je výsledný efekt na přístupnost či nepřístupnost chromatinu pro transkripční faktory poměrně jednoznačný již na základě druhu modifikace. Tak je tomu např. u acetylace histonů, kdy vazba acetylové skupiny snižuje celkový kladný náboj histonu, a tím oslabuje vazbu mezi histony a záporně nabitou DNA, což usnadňuje vazbu transkripčních faktorů. Naopak u jiných modifikací závisí jejich efekt i na kontextu ostatních přítomných modifikací či na přesné pozici modifikace na proteinu (typicky u metylace histonů), přičemž účinek téže modifikace na různých místech může být zcela opačný.
Dalším způsobem epigenetického značení je využívání různých histonových variant. Jedná se především o varianty základních histonů H2A a H3, které vedou ke změnám ve vlastnostech nukleozomu. Např. varianta H3.3 je nejhojněji zastoupena v promotorových oblastech aktivně transkribovaných genů, naopak varianta H3.1 se preferenčně vyskytuje v heterochromatinu. Histonová varianta H2A.Z se vylučuje s metylací DNA a zdá se tedy, že chrání geny před nežádoucí metylací v oblastech iniciace transkripce.
Jak již bylo zmíněno, epigenetické značky jsou umísťovány nejen na asociované proteiny, ale i na samotnou DNA (viz též Aleš Kovařík: Metylace cytosinu jako přidaná hodnota DNA, Vesmír 2/2015). Zatímco u savců dochází k metylaci cytosinů (C) téměř výhradně v kontextu CG sekvencí (výjimku tvoří embryonální kmenové buňky), u rostlin se běžně setkáváme s metylací DNA v libovolných sekvenčních kontextech, které lze rozlišit na tři různé typy v závislosti na přítomnosti guanosinu (G) za metylovaným cytosinem: CG, CHG a CHH (kde H značí A,C nebo T). Tyto sekvenční kontexty se liší i z hlediska mechanismu udržování metylace. Metylace palindromatické CG sekvence (na komplementárním vlákně DNA dvoušroubovice je také sekvence CG) je snadno udržována po replikaci DNA prostřednictvím proteinů, které rozpoznávají hemimetylovanou DNA (CG sekvence je metylována pouze na mateřském vlákně) a následně na ní navádějí DNA metyltransferázu, která doplní metylaci i na dceřiné vlákno.
Metylace DNA je typická represivní značka pro promotorové oblasti genů, nekódující oblasti genomu hojné na repetitivní sekvence a na transponovatelné elementy, které je třeba udržovat v transkripčně neaktivním stavu. Nachází se však také uvnitř kódujících oblastí stabilně transkribovaných genů, kde se typicky vyskytuje jen jako CG metylace, a hraje zde jinou, doposud ne zcela objasněnou roli.
Metylace DNA a modifikace histonů jsou spolu úzce provázány. Příkladem může být aktivita rostlinně specifických udržovacích metyltransferáz metylujících v kontextu GHG a CHH, které jsou naváděné na cílové sekvence prostřednictvím metylace histonů H3 (konkrétně metylovaných na lysinovém zbytku K9, které představují také represivní značku pro transkripci). Naopak jedna skupina histonových metyltrasferáz obsahuje doménu rozpoznávající CHG a CHH metylované sekvence, čímž vzniká pozitivní zpětnovazebná smyčka vzájemně udržující metylaci DNA a histonů.
Na odlišném principu pak funguje tzv. metylace DNA řízená malými RNA (RdDM = RNA-directed DNA methylation) (viz Petr Svoboda, Radek Jankele: Malé RNA: Mocní trpaslíci). Tento mechanismus je založen na dráze RNA interference, kde malé RNA (21-24 nukleotidů dlouhé) jsou štěpeny z delších dvouvláknových RNA molekul, které mohou vznikat párováním dvou různých transkriptů, utvořením vlásenky v rámci jedné RNA molekuly nebo činností některé z rostlinných RNA-dependentních RNA polymeráz. Malé RNA pak na základě komplementarity své sekvence s transkripty rostlinně specifické (DNA-dependentní) RNA polymerázy V navedou příslušnou DNA metyltransferázu na místo určení. Vzniklé chromatinové modifikace mohou být následně udržovány s pomocí druhé rostlinně specifické (DNA-dependentní) RNA polymerázy IV, která cíleně přepisuje části inaktivního chromatinu, a z jejích transkriptů jsou produkovány další malé RNA.
Mechanismus metylace DNA prostřednictvím malých RNA se zřejmě původně vyvinul v průběhu evoluce z důvodu ochrany rostlinného genomu proti invazivní DNA, která je představována především transponovatelnými elementy (TE). Dojde-li k vložení nové kopie TE do genomu, může být snadno zametylována a transkripčně umlčena in trans právě díky komplementaritě malých RNA vznikajících z původní kopie TE. Jako cizorodá DNA může být ale rozpoznán např. také transgen vnesený do rostliny při genetické modifikaci. V takovém případě jde sice primárně o degradování transkriptu prostřednictvím malých RNA, tedy umlčení na posttranskripční úrovni, to však může po čase přejít na transkripční umlčení zprostředkované modifikacemi chromatinu. Ostatně právě pokusy na transgenních petúniích na začátku 90. let stály u počátků výzkumu, který vedl k popsání řady procesů RNAi u rostlin a následně i k rozklíčování základního principu spouštění RNAi na háďátku Caenorhabditis elegans, za což byla v roce 2006 udělena Nobelova cena.
Udržovací DNA metylace v řadě případů spolupracuje s RdDM za účelem maximální spolehlivosti a minimalizace spotřeby energie. Takovým příkladem je transkripční umlčování transponovatelných elementů (TE), kdy umlčování krátkých TE a okrajových částí dlouhých TE zprostředkuje metylace DNA řízená malými RNA, zajišťující rychlé umlčení případných nových kopií TE. Umlčování středových částí dlouhých TE je zajišťováno zpětnovazebnou smyčkou udržovacích DNA metyltransferáz a metylace histonů. Udržování metylace na kratších úsecích prostřednictvím informace z modifikovaných histonů může být problematické, protože na kratší genetické elementy (kolem 150 bp) připadá jen jediný nukleozom. Naproti tomu přesnost zacílení RdDM je limitována v podstatě jen délkou malé RNA.
Epigenetika a obranné reakce rostlin
Rostliny jsou nuceny se během svého života vyrovnávat s řadou biotických a abiotických stresů. I v průběhu jediného dne musí např. rostlina zvládat velké teplotní výkyvy nebo reagovat na herbivory. Tyto okamžité reakce jsou zprostředkovány především fytohormony, které mohou vyvolat reakci na úrovni transkripční, posttranskripční i proteinové. Pokud však některé faktory působí na rostlinu déle nebo opakovaně, může dojít také k epigenetickým změnám, které mají dlouhodobě udržitelný charakter. V řadě případů spolu fytohormonální a epigenetické regulace v odpovědi na stres spolupracují a vzájemně se ovlivňují.
Aktivace obranných mechanismů proti rostlinným patogenům vyžaduje rozsáhlé změny v transkripci, například napadení huseníčku (Arabidopsis thaliana) bakteriálním patogenem vede ke změnám v metylaci DNA. Zvýšená hladina kyseliny salicylové, která se podílí hlavně na obraně proti biotrofním patogenům, je charakterizována především sníženou úrovní metylace a také zvýšenou tvorbou určité skupiny malých RNA zřejmě souvisejících s derepresí TE. Zdá se však, že role RdDM při biotickém stresu je komplexnější. V případě napadení nekrotrofní plísní Botrytis cinerea dochází u rostlin mutantních v genu pro Pol V (což je jeden ze stěžejních enzymů dráhy RdDM) ke zvýšené citlivosti na tento patogen. Naproti tomu táž mutace vyvolává zvýšenou odolnost proti biotrofní bakterii Pseudomonas syringae. Zdá se tedy, že metylací DNA řízené zvyšování nebo naopak snižování exprese genů závisí na typu patogenu.
Metylace DNA řízená malými RNA se podílí také na potlačení virové infekce vyvolané DNA viry. Malé RNA odvozené z transkriptů viru navedou DNA metyltransferázu na virovou DNA a tím zabrání transkripci a následné replikaci viru. Malé RNA hrají významnou roli i v boji proti rostlinným RNA virům, v tomto případě však na posttranskripční úrovni znemožněním jejich translace a replikace. V průběhu evolučního boje si však RNA i DNA viry vyvinuly řadu strategií, jak vyřadit rostlinný obranný systém z provozu. Například ssDNA viry z rodiny Geminivirů využívají svůj protein Rep ke snížení transkripce udržovacích DNA metyltransferáz. Podobně také již zmiňovaná plíseň Botrytis cinerea dokázala zneužít aparát malých RNA hostitele ve svůj prospěch. Zásahy patogenů do obranného systému využívajícího malé RNA jsou často důvodem, proč jsou virová onemocnění rostlin doprovázena výraznými morfologickými defekty – malé RNA totiž kromě obrany řídí i řadu vývojových procesů u rostlin, které jsou působením patogenů rovněž zasaženy.
Epigenetická regulace odpovědi rostlin na stres samozřejmě není dána pouze metylací DNA, ale celou řadou dalších procesů, jako je metylace či acetylace histonů nebo činnost chromatin remodelujících faktorů. Některé stresem indukovatelné geny si do určité míry zachovávají epigenetické modifikace vyvolané stresem i po jeho odeznění, takže pokud je rostlina vystavena stresu opakovaně, jejich reaktivace je rychlejší a rostlina zvládá stres snáze. U některých rostlin bylo dokonce popsáno, že zvýšená odolnost (připravenost ke stresu) je epigeneticky předávána i na potomstvo (viz dále).
Jak již bylo v úvodu řečeno, vznik tak složitých epigenetických regulačních procesů u rostlin souvisí s vysokou dynamičností jejich genomů. Ta je dána z části tím, že většina vyšších rostlin podstoupila v průběhu evoluce několik celogenomových duplikací, které v konečném výsledku vedly k duplikaci řady genů, což poskytlo prostor pro diverzifikaci jejich funkcí. Vysoká proměnlivost rostlinných genomů je dále dána přítomností často obrovského množství transponovatelných elementů (TE), které je třeba regulovat. TE představují invazivní DNA, jež sice přinášejí v dlouhém časovém horizontu z evolučního hlediska řadu výhod, ale z hlediska jedince je nutné jejich aktivitu pečlivě hlídat, neboť mají schopnost množit se opakovaným vkládáním do hostitelského genomu, což by – pokud by tento proces nebyl hostitelem regulován – vedlo ve výsledku ke ztrátě integrity genomu, poškození genů a k zániku buňky, příp. jedince.
TE tedy odedávna znamenají hrozbu, se kterou se rostlinné i živočišné genomy potýkají. Právě epigenetické modifikace jsou jedním z hlavních mechanismů udržujících TE v neaktivním stavu. Na druhou stranu, i na úrovni jedince se TE mohou pozitivním způsobem podílet na regulaci genové exprese a na zvyšování variability přispívající k adaptaci. Regulační význam TE předpokládala již Barbara McClintock, nositelka Nobelovy ceny z roku 1983 za objev TE a vysvětlení mechanismu jejich transpozice, a to právě na rostlinném modelu.
Ke změnám v genové expresi zapříčiněné TE může docházet na několika úrovních. Například metylace TE může mít negativní vliv také na genovou expresi přilehlých genů. Dále řada genů obsahuje ve svých promotorech sekvence transpozonů, které jsou regulovány pomocí drah RdDM, nebo naopak některé TE mohou v důsledku chyby v transpozici získat část regulační sekvence genu. Tak tomu bylo v případě ONSEN rodiny LTR retrotranspozonů v genomu huseníčku, která získala regulační element zodpovědný za aktivaci genů při tepelném stresu. To znamená, že ve chvíli, kdy je rostlina nucena se bránit proti zvýšené teplotě aktivací příslušných genů, dojde i k nežádoucí aktivaci ONSENretrotranspozonů. Po odeznění stresu je však rostlina schopná opět ONSEN umlčet prostřednictvím malých RNA a dráhy RdDM.
Podobně také při demetylaci vyvolané bakteriální infekcí dochází k aktivaci některých LTR retroelementů. Aktivace TE při abiotickém a biotickém stresu je tedy často pouze nežádoucím vedlejším produktem epigenetické aktivace obranných genů. Na druhou stranu ale toto chování TE může vést i k modulaci genové exprese, která ve výsledku může být rostlinám prospěšná. To opět dokumentuje příklad retrotranspozonů typu ONSEN, který – pokud je nově začleněn do regulační oblasti genu – zapříčiní, že se tento gen stane aktivovatelný tepelným stresem, tedy získá novou regulační schopnost.
Známy jsou také TE ležící v regulačních oblastech genů, u kterých je výsledná genová exprese určena globálnějšími změnami v epigenetických modifikacích ovlivňujících aktivitu TE. Kromě některých genů odpovědi na stres se to týká i významné části genů regulujících vývoj pohlavních buněk. Při jejich vzniku se tak exprese některých genů, které tento proces regulují, realizuje ve vazbě na mechanismus zajišťující spolehlivé umlčení TE v gametách a tím i v následné generaci. Tento proces je zajištěn prostřednictvím malých RNA, které jsou produkovány ve vegetativní buňce pylového zrna nebo v centrální buňce zárodečného vaku v důsledku rozsáhlé demetylace genomu a celkového úbytku heterochromatinu vedoucí k reaktivaci TE. Tyto buňky, jejichž genetická informace se již nijak neuplatňuje v další generaci, jsou tedy „obětovány“, aby malé RNA odvozené z reaktivovaných TE zprostředkovaly spolehlivou metylaci DNA a umlčení TE v samčích a samičích gametách.
S tímto procesem úzce souvisí imprinting, tedy jev, kdy se exprese genu liší v závislosti na tom, od kterého z rodičů pochází. U rostlin k imprintingu dochází téměř výhradně v endospermu, což je pletivo sloužící k výživě embrya, nevznikají z něj tedy žádná pletiva dospělé rostliny. V endospermu je řada genů exprimována pouze z mateřských chromosomů (část sekundárně z otcovských), a to díky tomu, že při vývoji zárodečného vaku (ze kterého oplodněním vzniká endosperm) dochází k rozsáhlým, výše zmíněným, demetylacím. Ty mají za následek aktivaci řady genů, typickým příkladem je FWA, který obsahuje v promotorové oblasti sekvenci TE (SINE retroelement).
Epigenetika a rostlinná paměť
Epigenetické modifikace představují určitou stabilní změnu v aktivitě genové exprese, přičemž výhodou je, že tato informace může být z principu relativně snadno předána dceřiné buňce, u metylace cytosinů v palindromatických sekvencích CG je to proces triviální – prostě dojde ke zkopírování metylačního stavu z mateřského vlákna DNA na dceřiné, u nepalindromatických sekvencí a modifikacích histonů je to proces složitější, jak bylo zmíněno. Epigenetické modifikace tak dávají buňkám a celé rostlině paměť. Jednotlivým buňkám například umožňují si pamatovat, k jakému pletivu patří (ostatně pojem epigenetika původně vzešel z vývojové biologie), a i když u rostlin při určení identity buněk hrají významnější roli jiné faktory (fytohormony, poziční efekt apod.), tak epigenetické modifikace mají důležitou úlohu například v určení identity dělivých pletiv.
Nejznámějším a nejlépe prostudovaným příkladem epigenetické paměti u rostlin je však proces vernalizace, tedy proces, který zajišťuje, aby rostlina vykvetla na jaře až poté, co proběhne zima. Klíčovým regulátorem tohoto procesu je gen FLC (FLOWERING LOCUS C). FLCinhibuje dráhy, které u rostlin spouštějí kvetení. Při nízkých teplotách přes zimu se exprese FLC vypíná, kvetení přestane být blokováno a rostlina může vykvést (pokud tomu nebudou bránit jiné faktory). Tento proces funguje u řady rostlin žijících v zeměpisných šířkách, kde se střídají roční období. Exprese FLC je regulována celou škálou mechanismů – poté, co je rostlina vystavena chladu, jsou z FLC napřed odstraněny histonové značky pozitivně regulující expresi a následně jsou v jednom z úseků FLC ustaveny histonové značky, které expresi umlčují. Tyto modifikace vyžadují na ustavení určitý čas (řady týdnů – podle druhu), aby rostlina nebyla matena podzimními mrazíky a nevykvetla ještě před zimou. Pokud je tedy rostlina vystavena chladu dostatečně dlouho, pak po nástupu vyšších teplot dojde k rozšíření umlčujících značek a vazbě represních proteinů podél celého genu, čímž je inaktivní stav genu stabilizován. U rostlin, které kvetou jednou za život, je epigenetické blokování FLC resetováno při vývoji embrya, u trvalek je méně stabilní a po čase vymizí.
V tomto konkrétním případě není epigenetický stav přenášen na další generaci, avšak obecně je to možné. Ostatně i u FLC může dojít k částečnému předání epigenetické informace následující generaci, pokud je daná rostlina mutantní v genu zodpovědném za resetovaní jeho stavu v embryogenezi. Obecně se má za to, že dědičnost epigenetické informace u rostlin je spíše doménou metylace DNA než modifikací histonů. Například u savců dochází k rozsáhlému resetování DNA metylace během embryogeneze, u rostlin k tomu ale nedochází (alespoň ne plošně), naopak v některých případech je metylace během gametogeneze posílena (zejména u transponovatelných elementů, viz výše). U rostlin je také časté vegetativní rozmnožování. Asexuálně vzniklé potomstvo tak neprochází reorganizacemi epigenomu spojenými s rozmnožováním pohlavním, a má větší šanci zachovat si podobné epigenetické modifikace, jako měl rodič. Dědičnost epigenetické informace vytváří další úroveň variability k variabilitě genetické a můžeme se krom alel (různých variant genů lišících se sekvencí DNA) setkávat i s epialelami (geny lišící se úrovní metylace DNA).
Vzhledem k tomu, že existují různé typy epigenetických modifikací, které mohou vznikat různými cestami, tak i jednotlivé epialely se mohou chovat různě. Tyto rozdíly je možné názorně ukázat na konkrétních příkladech epialel, přičemž s většinou z nich se můžeme setkat i ve volné přírodě. Jedním takovým případem je lnice květel (Linaria vulgaris), kde květy této rostliny mohou mít odlišnou symetrii podle toho, jak je metylován gen řídící proces vývoje květů. Paradoxní je, že tato epigenetická mutace je pravděpodobně vůbec první mutací popsanou ve vědecké literatuře, když si ji roku 1749 všiml již Carl Linné.
Druhým a relativně dobře známým příkladem, který ocení zejména fanoušci komiksu, je případ genu SUPERMAN (SUP). Mutant huseníčku v tomto genu má vyšší počet tyčinek (odtud název) a stejného efektu lze dosáhnout, i pokud je tento gen metylován (epialela clark kent – clk). Studií této epialely bylo objeveno několik složek účastnících se epigenetických modifikací, a tak například jedna z histonových metyltransferáz nese název KYP(KRYPTONITE).
Mezi ty, které mají i hospodářský význam, spadá epialela genu zodpovědného za regulaci zrání rajčat (cnr), jež je zodpovědná za jejich nažloutlou barvu a moučnatost.
Uvedené příklady se pravděpodobně týkají tzv. pravých epialel, tedy epialel, které vznikají ztrátou či získáním metylace víceméně náhodou v určité oblasti bez ohledu na strukturu DNA v daném místě. Ovšem velká část epialel je ovlivněna okolním chromatinem a genetickým pozadím. Často jde o případy, kdy se do blízkosti nějakého genu dostane transponovatelný element, jeho aktivita je zablokována pomocí metylace DNA, která však může zasáhnout i geny přilehlé, jejichž epialely pak mohou vznikat ztrátou metylace tohoto TE a tím i změnou exprese přilehlých genů. S takovýmito epialelami se můžeme setkat například u genu řídícího pohlaví květů u melounu (WIP1) či genu, který řídí čas kvetení u huseníčku (FWA).
Sekvence, která ovlivňuje existenci epialely, nemusí ležet přímo v její blízkosti, ale může se nacházet prakticky kdekoliv v genomu a ovlivňovat ji pomocí malých RNA. Známým příkladem tohoto typu epialel je tzv. paramutace. Jde o jev, kdy je metylovaná epialela zdrojem malých RNA (viz popis RdDM výše), a pokud se taková (paramutagenní) epialela setká v genomu s nemetylovanou epialelou (paramutovatelnou) téhož genu (na homologním chromozómu), malé RNA způsobí její metylaci a umlčení. Tato metylace je poměrně stabilní a zůstává i po odkřížení paramutagenní epialely, jež metylaci způsobila. Navíc tato nově metylovaná epialela se sama může stát zdrojem malých RNA. Paramutace jsou nejlépe známy z kukuřice, kde jsou například odpovědné za rozdíly v pigmentaci.
Výše uvedené informace jsou pouze konkrétními příklady vlivu epigenomu na dědičnost. Současné pokroky zejména v možnostech sekvenování metylomu (analýz přítomnosti metylovaných cytosinů na úrovni celého genomu), však umožňují mnohem komplexnější analýzy (ostatně rostliny byly prvními vyššími organismy, u nichž byl metylom zmapován s přesností na jeden nukleotid). Například porovnání metylomu huseníčku v rozmezí třiceti generací ukázalo v určitých ohledech vysokou variabilitu, ale jinde zase relativně velkou stabilitu.
Ačkoliv je tedy pravděpodobnost epimutace – změny v metylomu o čtyři řády vyšší než v sekvenci DNA, tak například oblastí s odlišnou hladinou metylace spojených s tvorbou malých RNA vzniká zhruba stejně jako mutací DNA (u huseníčku jedna za generaci). Analýzy linií s uměle vytvořenou epigenetickou variabilitou (získanou mutací v některém z genů zodpovědných za udržování metylace a následným odkřížením mutované alely), zas odhalily velké množství epialel, které vyvolaly podobnou fenotypovou variabilitu, s jakou se setkáváme u huseníčku v přírodě. Ačkoliv tyto fenotypy vykazovaly nižší dědivost, než znaky běžně v přírodě vykazují, řada z nich byla dostatečně stabilní na to, aby bylo možné zamapovat jednotlivé oblasti v genomu, které jsou za ně zodpovědné. Získané poznatky tak ukazují na to, že s epigenetikou je třeba počítat například i při šlechtění rostlin a že přinejmenším některé epialely jsou dostatečně stabilní, aby mohly podléhat přirozenému výběru, tak jak jej popsal Darwin.
Dědičnost epigeneticky podmíněných vlastností u rostlin také vyvolává otázku, jestli by se na jejich evoluci kromě přirozeného výběru nemohla uplatňovat i dědičnost získaných znaků, a tedy i evoluce, jak ji navrhoval Lamarck. U rostlin je tato otázka obzvláště nasnadě, vzhledem k tomu, že rostliny nemají oddělenou linii zárodečných buněk, ale ty vznikají v průběhu života rostliny z pletiv, která se musí během života rostliny přizpůsobovat vnějším vlivům. Není tomu tedy tak jako u živočichů, kdy dochází k oddělení zárodečné linie již během vývoje embrya a možný přenos informací o tom, jak se živočich na své prostředí adaptoval, je tak značně ztížen. I přes veškerý pokrok ve výzkumu však tato otázka zůstává spíše kontroverzní.
U rostlin je známo, že v důsledku různých stresů může docházet k celkem rozsáhlým změnám v metylomu. Velký vliv mají například vyšší teploty, hladina UV záření, nebo působení vyšších koncentrací solí. Epigenetické změny zřejmě stojí i za aklimací, tedy adaptací na změnu prostředí. Se změnou v metylaci je také spojen tzv. priming – příkladem může být napadení rostliny patogenem. V odpovědi na napadení klesne hladina metylace v genech zodpovědných za obranné reakce, a ty se pak v případě opakovaného napadení mohou rychleji aktivovat. Nicméně skoro všechny tyto změny mají spíše krátkodobější charakter trvání v rámci týdnů, maximálně měsíců.
Jak časté je, aby byly tyto změny stabilně děděny, zůstává otázkou. Řada studií v této oblasti není často schopna prokázat, že dané změny jsou skutečně epigenetické, že jsou děděny po více generací, že jsou děděny na pohlavně a ne vegetativně vzniklé potomstvo, nebo že nejsou způsobeny změnami v genomu (pokles metylace je často doprovázen reaktivací TE, které při začlenění způsobují genetické mutace). Dědičnost stresem vyvolaných epigeneticky podmíněných znaků byla pozorována například u pampelišky, kde byly děděny jak změny vyvolané škůdcem, tak změny vyvolané podvýživou, pozorování se ale týkalo jen jedné generace a pampelišky jsou apomiktické (tedy nepohlavně se množící).
Dalším příkladem může být napadení huseníčku bakterií Pseudomonas syringae, kde byla zvýšená odolnost v důsledku epigeneticky zvýšené exprese obranných genů děděna po další dvě generace. U huseníčku, který byl dlouhodobě po několik generací vystaven stresu z působení vyšší koncentrace solí, se do následné generace předá asi 75 % změn v metylaci DNA, které vznikly v důsledku působení tohoto stresu, není ale známo, jestli tyto změny mají nějaký vliv na expresi genů a jak moc jsou nenáhodné.
Zatím nejlépe prozkoumaným případem je vliv regenerace z buněčné kultury na metylom u rýže. V důsledku kultivace v buněčné kultuře dochází na řadě míst k poklesu metylace, přičemž tyto změny jsou relativně stabilní (do 6. generace se zachová 84 % z nich). Navíc oproti změnám, které nastávají spontánně, zde převládají změny týkající se regulačních oblastí genů, a jsou tak spojeny se změnami v jejich expresi. Jaký adaptivní význam by mohl tento proces mít, ale není zřejmé, neboť většina ovlivněných genů je pravděpodobně zasažena náhodně.
Lze tedy shrnout, že epialely jsou u rostlin významným zdrojem variability v populaci, nicméně většina z nich se svým chováním zásadněji neliší od alel podmíněných geneticky. Vykazují sice nižší dědivost a také schopnost vrátit se do původního stavu před mutací (což je pro geneticky podmíněné znaky vzácné), ale jinak většina z nich podléhá Mendelovým zákonům – až na výjimku epialel schopných vyvolávat paramutace (ty jsou však minoritní, i když ne nevýznamnou skupinou). Epialely budou v evoluci také podléhat přirozenému výběru, ale jednoznačné důkazy pro to, že by u rostlin mohla být evoluce v některých případech řízena lamarckistickým modelem, zatím nalezeny nebyly. Naše chápání vlivu prostředí na změny na úrovni chromatinu u rostlin je stále spíše na počátku, ale o to více se jeví slibně vzhledem ke vzrůstajícímu množství materiálů, které hovoří o možnosti využívat epigenetických modifikací při získávání rostlin s hospodářsky výhodnějšími vlastnostmi.