Plíživá globální hrozba
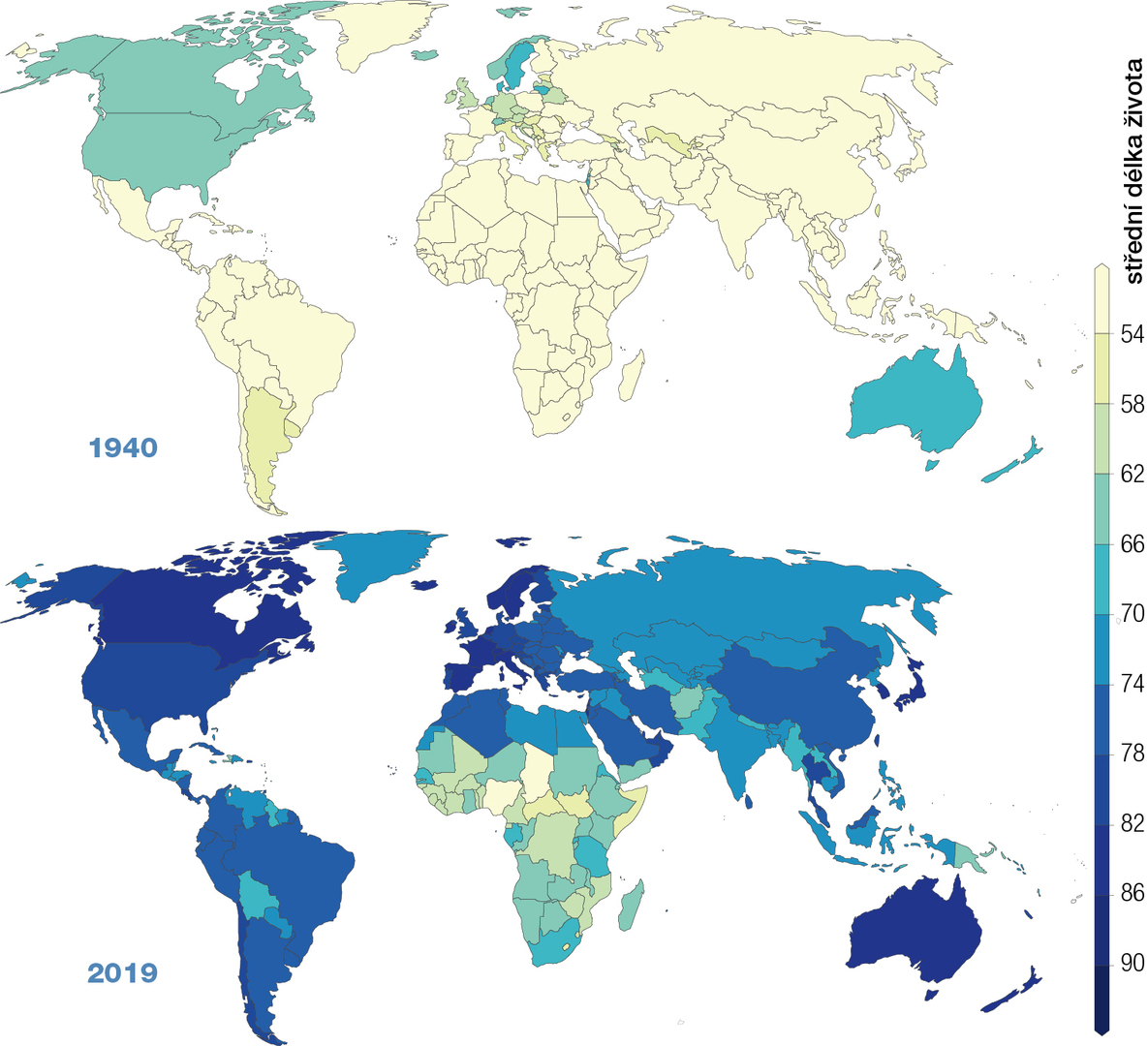
| 4. 12. 2023Zavedení antibiotik do léčebné praxe snížilo počet úmrtí na infekční choroby a spolu se zavedením vakcinace a se zlepšením socioekonomických podmínek prodloužilo průměrnou délku života až o třicet let (obr. 1). Zvyšující se rezistence patogenů vůči antibiotikům proto představuje závažný problém. Kvůli ztrátě léčivých účinků antibiotik ročně zemře více než milion lidí.
V roce 2019 Světová zdravotnická organizace (WHO) prohlásila antibiotickou rezistenci za jednu z deseti největších celosvětových hrozeb v oblasti zdraví, v roce 2022 ji Evropská komise spolu s členskými státy označila za jednu ze tří nejzávažnějších zdravotních hrozeb v EU.
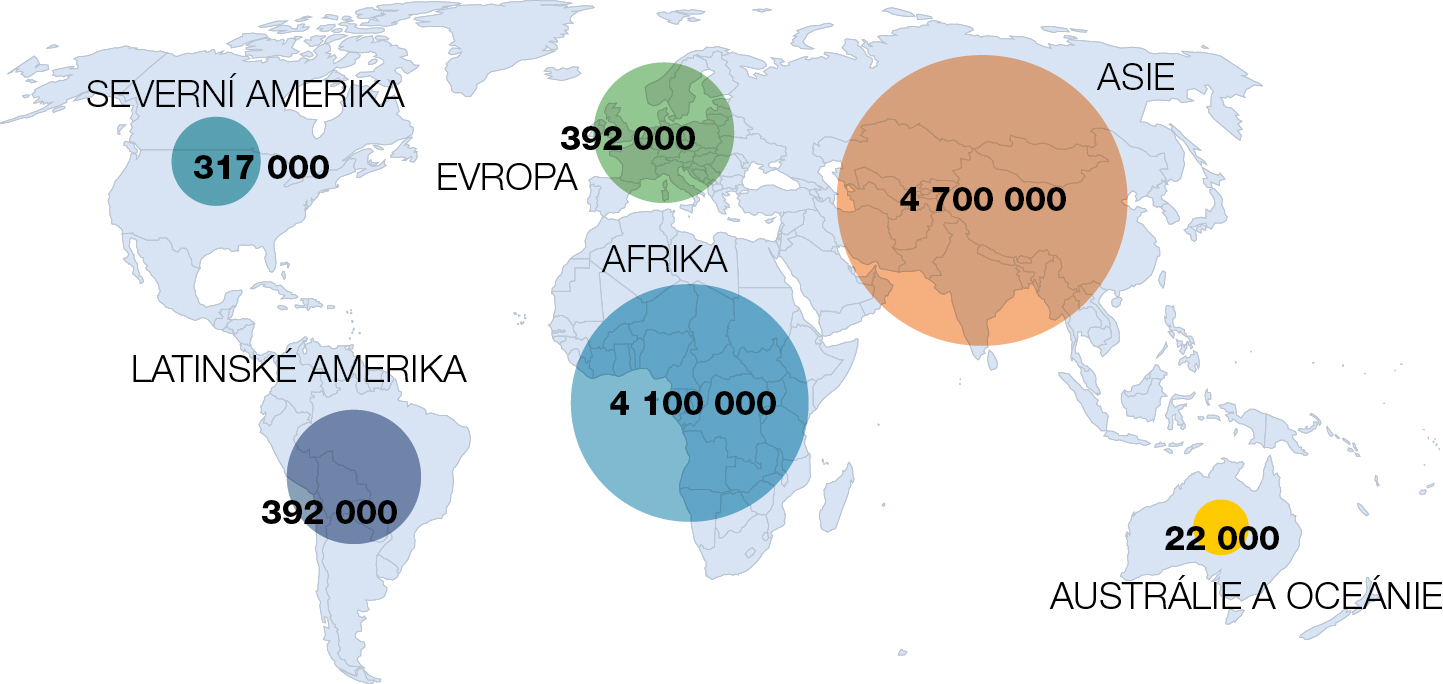
Statistický model publikovaný v časopise Lancet uvádí, že v roce 2019 bylo celosvětově odhadem 4,95 milionu úmrtí spojených s infekcemi rezistentními kmeny, včetně 1,27 milionu úmrtí, která lze připsat přímo důsledkům rezistence.1)[1] Tato studie ukázala, že rezistence vůči antibiotikům je zdravotní problém rozsahem minimálně srovnatelný s dalšími infekčními nemocemi, jako je HIV a malárie, a potenciálně mnohem větší (obr. 2).
Zjednodušeně lze říci, že antibiotická rezistence se šíří celosvětově, ale míra jejího výskytu se regionálně velmi liší. V roce 2019 byla nejpostiženějším regionem subsaharská Afrika (27,3 úmrtí na 100 000 obyvatel), naopak nejnižšího počtu úmrtí v souvislosti s antibiotickou rezistencí dosáhla Austrálie (6,5 úmrtí na 100 000 obyvatel).
Šest hlavních hráčů
Za více než 73 % (929 000) úmrtí způsobených antibiotickou rezistencí bylo zodpovědných pouhých šest hlavních patogenů. Jedná se o Escherichia coli, Staphylococcus aureus, Klebsiella pneumoniae, Streptococcus pneumoniae, Acinetobacter baumannii a Pseudomonas aeruginosa. Jsou mezi nimi bakterie, které se nejčastěji vyskytují u komunitních infekcí, tedy takových, kterými se nakazíme mimo zdravotnické zařízení, ale patří sem i typické „nemocniční“ patogeny, např. K. pneumoniae, P. aeruginosa nebo A. baumannii.
Narůstající rezistence ale nezasahuje jen klasické bakteriální patogeny. S ohledem na specifickou terapii se samostatně sleduje také výskyt rezistence k antituberkulotikům u původce tuberkulózy. Celosvětově se v roce 2021 vyskytlo odhadem 450 000 případů multirezistentní nebo rifampicin rezistentní tuberkulózy (rifampicin je antibiotikum, které se používá téměř výhradně k léčbě TBC) a 191 000 souvisejících úmrtí, s rostoucím trendem v několika regionech a zemích s vysokou zátěží [2]. Jelikož tuberkulóza patří k onemocněním, která provázejí nákazu HIV, výskyt rezistentních variant je častý především v zemích s vysokou incidencí tohoto onemocnění. Obavy také celosvětově vyvolávají narůstající trendy invazivních mykotických onemocnění (vyvolaných kvasinkami nebo plísněmi), a to zejména u imunokompromitovaných pacientů, kteří jsou k nákaze těmito původci vnímavější.
Antibiotická rezistence je přirozený fenomén, nicméně používání antibiotik je jejím hlavním motorem. Šíření rezistentních bakterií je ovlivněno úrovní prevence a kontroly infekcí ve zdravotnických zařízeních, dostupností diagnostiky, hygienickými standardy, úrovní sanitace, intenzitou cestování a migrace. Svou roli také hraje nedostatek povědomí o míře problému či jeho přehlížení. Infekce vyvolané rezistentními bakteriemi jsou hůře léčitelné, k jejich léčbě je třeba použití alternativních antibiotik, která mohou být toxická, a jejich volba nákladnější. Následky infekce vyvolané rezistentními bakteriemi mohou být velmi závažné, neboť včasná a účinná antibiotická terapie je rozhodujícím faktorem ovlivňujícím prognózu kriticky nemocných pacientů.
Antibiotická rezistence představuje rovněž vysokou ekonomickou zátěž. Odhaduje se, že jen v Evropské unii dosahují náklady na léčbu infekcí vyvolaných rezistentními bakteriemi spolu se ztrátami produktivity 1,5 miliardy eur ročně. Ztráta účinnosti antibiotik ve veterinární medicíně ohrožuje zdraví zvířat, zvyšuje finanční náklady živočišné výroby a zvyšuje i riziko nevyléčení infekcí včetně těch, jejichž původci způsobují zoonózy s potenciálním dopadem do humánní oblasti.
Bakterie rezistentní k antibiotikům se šíří stejně jako bakterie k antibiotikům vnímavé. Znamená to, že se přenášejí mezi lidmi, zvířaty, potravinami a prostředím. Tato vzájemná provázanost podmiňuje interdisciplinární přístup k řešení problému antibiotické rezistence. Ten se označuje termínem One Health (Jedno zdraví, viz s. 686). Šíření antibiotické rezistence přesahuje hranice států a ovlivňuje většinu oblastí života. Postihuje systémy zdravotní péče i produkci potravin. I proto by se na řešení této problematiky mělo podílet co nejvíce zemí, odvětví a institucí.
Evropská data
Systematickým sledováním antibiotické rezistence se od roku 1998 zabývá Evropská síť pro sledování antibiotické rezistence u izolátů z invazivních infekcí (European Antimicrobial Resistance Surveillance Network; EARS-Net). EARS-Net je koordinována Evropským střediskem pro prevenci a kontrolu nemocí (ECDC) s cílem shromažďovat, analyzovat a hlásit údaje o antibiotické rezistenci prostřednictvím sítě národních koordinátorů v zemích EU/EHP. Hlavním úkolem této agentury Evropské unie se sídlem ve Švédsku je epidemiologická kontrola infekčních onemocnění a s nimi souvisejících zvláštních zdravotních problémů, ke kterým kromě antibiotické rezistence patří i spotřeba antibiotik a infekce spojené se zdravotní péčí.
Data, která ECDC shromažďuje, ukazují, že v Evropě v důsledku infekce rezistentními bakteriemi zemře 35 000 lidí ročně. Incidence těchto infekcí se v Evropě bohužel zvyšuje. Souvisí to s narůstající rezistencí některých patogenů (např. E. coli, K. pneumoniae), negativní vliv má ale i stárnutí populace. Studie A. Cassiniho a kol. ukázala, že ačkoliv podíl meticilin rezistentních S. aureus (MRSA) izolovaných z infekcí krevního řečiště statisticky významně klesl, incidence MRSA paradoxně vzrůstá [3]. K nárůstu přispělo absolutní navýšení záchytů stafylokokových infekcí, zejména u dětí a dospělých starších 55 let. S prodlužováním života a lepší úrovní neonatální péče mohutní i populace, která je k infekcím MRSA náchylnější.
Co nás čeká?
Pokud by současné trendy ve spotřebě antimikrobiálních látek, v hospodářském a populačním růstu pokračovaly i v budoucnu, lze předpokládat, že se rezistence ve většině zemí OECD, EU/EHP a G20 bude v následujících letech dále zvyšovat [5]. Výskyt bakterií s rezistencí i na antibiotika druhé linie, např. cefalosporiny třetí generace, vede k častému používání rezervních antibiotik, např. karbapenemů. Vůči cefalosporinům třetí generace však byla již v roce 2015 rezistentní více než třetina K. pneumoniae v zemích EU/EHP a téměř polovina v zemích G20. V České republice je dlouhodobě rezistentní dokonce polovina K. pneumoniae (viz EARS-Net, ECDC). Podávání karbapenemů ale ještě více zvyšuje selekční tlak na mikrobiální populaci a podporuje vznik a šíření bakterií rezistentních i k těmto antibiotikům. Rezistence na karbapenemy u K. pneumoniae je na úrovni Evropy stále relativně nízká, avšak setrvale narůstá, což naznačuje, že potřeba nových antibiotik je již kritická.
Strategie vedoucí ke snížení antibiotické rezistence musí být komplexní. Důležitá je nejen celková spotřeba antibiotik, ale i volba konkrétních skupin. Ne všechna antibiotika se na rozvoji rezistence podílejí stejnou měrou. Avšak samotné odstranění selekčního tlaku antibiotik není dostatečné. Přístup by měl zahrnovat znalost mechanismů rezistence a jejího šíření pomocí mobilních genetických elementů, důsledné uplatňování prevence infekčních onemocnění zejména ve zdravotnických zařízeních a vývoj nových diagnostik a antibiotik. Je zapotřebí integrovaný přístup napříč sektory zdravotnictví, zemědělství a životního prostředí.
Poznámky
1) Jinými slovy: nebýt infekcí způsobených rezistentními kmeny, nezemřelo by 4,95 milionu lidí. Pokud by tyto infekce sice proběhly, ale způsobily by je kmeny citlivé na antibiotika, podařilo by se zachránit 1,27 milionu lidí.
Literatura
[1] Antimicrobial Resistance Collaborators: Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet 399, 629–655, 2022/10325, DOI: 10.1016/S0140-6736(21)02724-0.
[2] WHO: Global tuberculosis report, 2022, ISBN 978-92-4-006173-6.
[3] Cassini A. et al.: Attributable deaths and disability- ‑adjusted life-years caused by infections with antibiotic-resistant bacteria in the EU and the European Economic Area in 2015: a population-level modelling analysis. Lancet Infect. Dis. 19, 56–66, 2019, DOI: 10.1016/S1473-3099(18)30605-4.
[4] Hamers R. L. et al.: Global knowledge gaps on antimicrobial resistance in the human health sector: A scoping review. Int. J. Inf. Dis. 134, 142–149, 2023, DOI: 10.1016/j.ijid.2023.06.004.
[5] Cravo Oliveira Hashiguchi T. et al.: Resistance proportions for eight priority antibiotic-bacterium combinations in OECD, EU/EEA and G20 countries 2000 to 2030: a modelling study. Euro Surveill. 24, 1800445, 2019/20, DOI: 10.2807/1560-7917.ES.2019.24.20.1800445.
Ke stažení
 článek ve formátu pdf [729,66 kB]
článek ve formátu pdf [729,66 kB]
O autorovi
Helena Žemličková