Fluor v organických sloučeninách
| 31. 5. 2021Z přírody známe jen asi dvacet organických sloučenin obsahujících atomy fluoru. Člověk jich ale syntetizoval mnohem víc a organofluorová chemie dnes představuje významný obor s aplikacemi v technice, farmacii, agrochemii, makromolekulární chemii a dalších oblastech. Nesmíme však zapomínat ani na rizika, jež některé z těchto sloučenin představují pro životní prostředí.
Atom fluoru má mezi ostatními atomy výjimečné postavení, za které vděčí své malé velikosti, vysoké elektronegativitě a velmi nízké polarizovatelnosti. Tyto vlastnosti mají za následek vysokou stabilitu fluoridového aniontu a značnou pevnost vazby uhlík–fluor.
Léčiva
Fluorovaná léčiva dnes představují asi 20 % z celkového počtu registrovaných léčiv. Registrováno jich je 340 – včetně těch, která byla stažena z důvodů později nalezených nepříznivých vedlejších účinků.
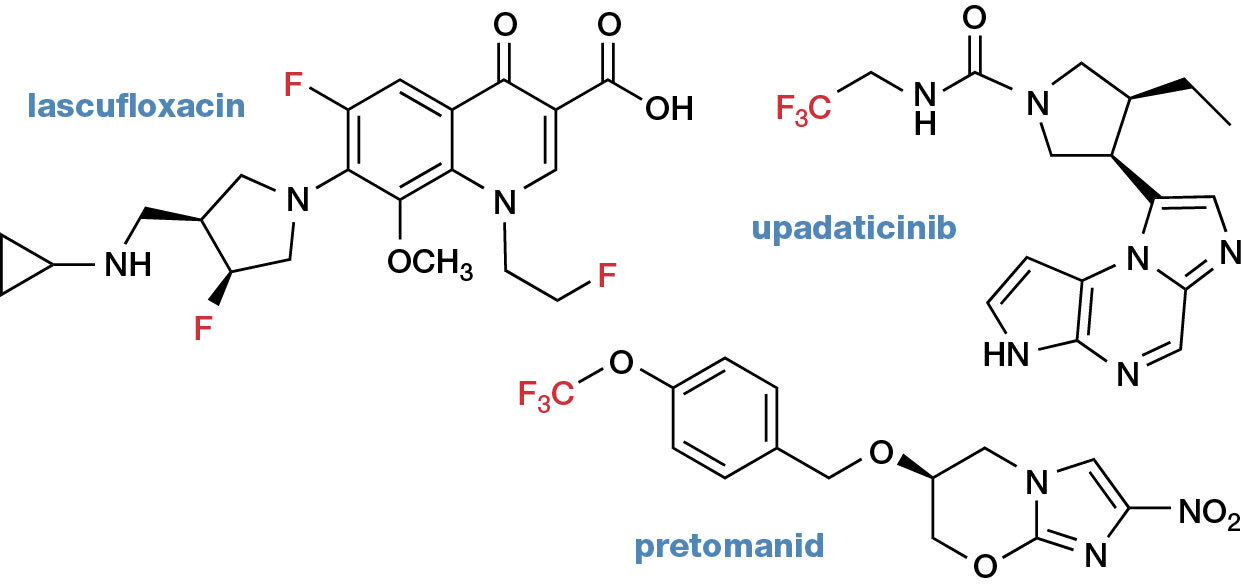
V kategorii nejvíce vydělávajících léčiv (tzv. blockbusterů) lze v posledních letech pozorovat razantní nástup drahých bioléčiv. Mezi nejlepšími dvanácti léčivy je tak nyní pouze pět „malých“ molekul. Tři z nich jsou fluorované. Významný nárůst počtu fluorovaných léčiv je patrný zvláště v posledních letech (obr. 1). Jejich podíl mezi „malými“ sloučeninami dosahuje téměř 50 % a atom fluoru se v oblasti nově studovaných bioaktivních sloučenin řadí mezi heteroatomy (tedy atomy jiné než uhlík a vodík) na druhé místo hned za atom dusíku.
Mezi tradiční fluorované modifikátory biologicky aktivních látek patří samotný atom fluoru nebo trifluormetylová skupina na aromatickém jádře. Modifikace atomem fluoru typicky cílí na náhradu atomu vodíku s cílem obrátit polaritu substituovaného atomu uhlíku a následně blokovat činnost enzymu interagujícího s modifikovanou molekulou. Další možností je náhrada hydroxylové skupiny –OH. Vazba uhlík–fluor má analogickou polaritu s vazbou uhlík–hydroxyl, atomu fluoru ale chybí připojený atom vodíku, kterým se hydroxyl typicky váže vodíkovou vazbou k enzymu způsobujícímu metabolizaci léčivé látky. Důsledkem je prodloužený léčivý účinek. Modifikace trifluorometylovou skupinou je pak většinou prováděna s cílem zvýšit lipofilitu léčivé látky, a tím zlepšit její průchod přes membrány buněk. Velmi často však substituce atomem fluoru nebo trifluormetylovou skupinou vede k zvýšení léčivé aktivity bez znalosti mechanismu jejího působení.
Sedm léčiv nově registrovaných v roce 2019 obsahuje monofluorarylovou, polyfluorarylovou nebo heteroarylovou skupinu a čtyři léčiva jednu nebo více trifluormetylových skupin. Je zajímavé, že v posledních letech se dramaticky zvětšuje počet atypických modifikací novými fluorovanými substituenty, jako například fluoretylovou, trifluoretylovou nebo trifluormetoxyskupinou (obr. 2).
Podrobnější informace o fluorovaných léčivech čtenář nalezne v článku Stanislava Rádla.
Agrochemikálie
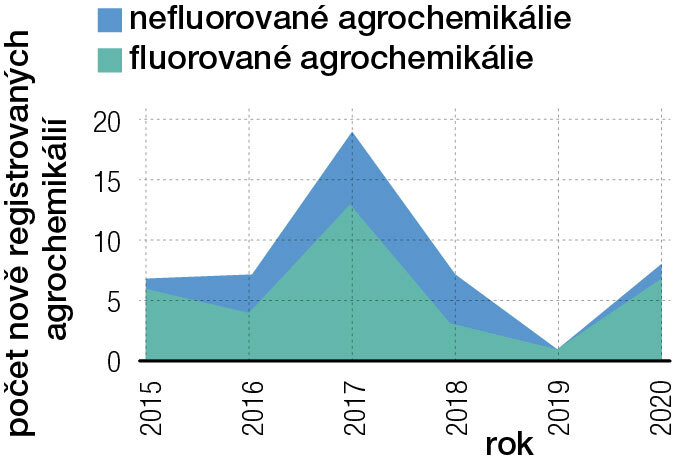
Snahy omezit množství pesticidů a jejich negativních účinků vedou k vývoji nových, efektivnějších agrochemikálií – herbicidů, insekticidů, akaricidů (proti roztočům), fungicidů, nematicidů (proti hlísticím) nebo rodenticidů (proti hlodavcům). Z více než 1200 známých agrochemikálií je 424 (35 %) fluorovaných a jejich podíl rychle roste (obr. 3). Ještě v roce 2003 činil pouze 16 %, mezi agrochemikáliemi registrovanými v uplynulých pěti letech je fluorovaných už 67 %.
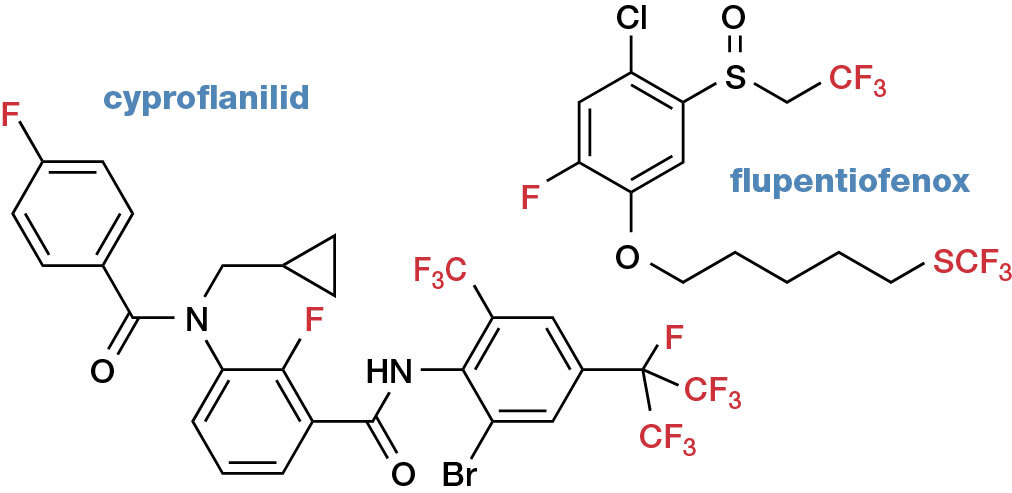
Příklon k neobvykle fluorovaným strukturám a kombinaci více fluorovaných skupin v molekule je u nově registrovaných agrochemikálií ještě výraznější, než je tomu u nově registrovaných léčiv (příklady na obr. 4).
Teflon a další polymery
Vazba uhlík–fluor je poměrně pevná a v molekule fluormetanu je její disociační energie 481 kJ/mol (pro srovnání: disociační energie vazby C–H v metanu je 439 kJ/mol; různé zdroje ale uvádějí mírně odlišné údaje). S rostoucím počtem C–F vazeb v molekule pevnost těchto vazeb roste a v molekule tetrafluormetanu je již 544 kJ/mol. Přesto mohou být vazby uhlík–fluor poměrně labilní, neboť atom fluoru vzhledem k vysoké elektronegativitě silně acidifikuje případnou vazbu CH na sousedním atomu uhlíku a seskupení H–C–C–F v bazickém prostředí tak poměrně snadno eliminuje molekulu fluorovodíku za vzniku dvojné vazby C=C. Absence takových vazeb C–H v perfluorovaných sloučeninách proto vede k látkám s extrémně vysokou stabilitou, čehož si makromolekulární chemikové záhy všimli.
Nejstabilnějším známým polymerem je polytetrafluoreten (PTFE), známý pod chráněným názvem Teflon, obsahující řetězce –CF2– skupin. Je pozoruhodné, že poprvé byl připraven náhodou. Roy J. Plunkett v roce 1938 při studiu přípravy inertní kapaliny CFC 114 (dichlortetrafluoretanu) uložil plynný tetrafluoreten do tlakových nádob. Když je po delší době otevřel, nalezl v nádobách pevnou mazlavou hmotu s unikátními vlastnostmi – polytetrafluoreten.
Chemie perfluorovaných polymerů byla zpočátku považována za příliš nákladnou, ale vývoj atomové bomby za druhé světové války a s tím související materiálové nároky vedly ke komercionalizaci těchto unikátních materiálů. Vedle značné pevnosti vazeb C–F stojí za chemickou stabilitou Teflonu i fakt, že jeho molekula se zvnějšku jeví jako balík nepolarizovatelných nevazebných elektronových párů. To ukazuje elektronová hustota namapovaná na izoelektronický povrch (povrch se stejnou hustotou elektronů) perfluoralkanové molekuly (obr. 5). Za zmínku stojí také její spirálové uspořádání, za které je odpovědné odpuzování elektronových párů atomů fluoru, vzdálených od sebe přes čtyři vazby. Teflon je tak chemicky napadán pouze alkalickými kovy a proti ostatním chemikáliím je prakticky inertní.
Výchozí sloučeninou pro přípravu tetrafluoretenu je chlordifluormetan (HCFC 22), jehož pyrolýzou vzniká difluorkarben, který spontánně polymerizuje na Teflon. Jeho hlavním výrobcem je v současnosti firma Chemours. Ta vznikla v roce 2013 odštěpením výroby speciálních chemikálií z mateřské firmy DuPont, která Teflon vyráběla od roku 1946.
Hlavní nevýhodou Teflonu je jeho vysoká krystalinita, způsobená pravidelným uspořádáním difluormetylenových jednotek. To má za následek vysokou teplotu tání (327 °C), přičemž již při 400 °C začíná poměrně intenzivní termální rozklad na toxické plynné produkty, z nichž nejškodlivějším je perfluor(2-metylpropen) (oktafluorisobutylen, OFIBO), způsobující edém plic. Proto je zpracování surového polymerního materiálu poměrně složitý problém a většinou se využívá slinování. Doporučené rozmezí teplot používání Teflonu je –200 až 260 °C.
Pokrok v polymerizačních technikách umožnil firmě DuPont uvést v roce 1960 na trh kopolymer tetrafluoretenu s hexafluorpropenem pod názvem Teflon FEP (obr. 6). Jeho výhodou je nižší teplota tání, nevýhodou mírně vyšší lámavost a nižší tepelná odolnost, která limituje horní teplotu jeho doporučeného používání na 204 °C.
Ještě lepší vlastnosti pro zpracování má Teflon PFA (obr. 6), který jako komonomer k tetrafluoretenu využívá perfluor(etenylpropyléter).1) Jeho významně nižší teplota tání a chemická odolnost prakticky identická s Teflonem umožňuje zpracování lisováním, nevýhodou je významně vyšší cena. Z pohledu struktury je pozoruhodné, že zatímco atom kyslíku má v běžném éterovém seskupení elektrondonorní charakter, zvyšuje polaritu a snižuje chemickou stabilitu, atom kyslíku obklopený perfluoralkylovými skupinami zcela ztrácí tyto vlastnosti a chová se jako flexibilní analog difluormetylenové skupiny. Tento polymer zavedla firma DuPont v roce 1972.
Dalším vysoce zajímavým perfluorovaným polymerem je Teflon AF (obr. 6), obsahující fluorovaný komonomer s dioxolanovými skupinami. Je mírně rozpustný v perfluorovaných rozpouštědlech, a umožňuje proto vytváření tenkých filmů. Jeho druhým významným kladem je průhlednost, takže se využívá pro výrobu chemických aparatur odolných proti vysoce korozivním kapalinám, jako je fluorovodíková kyselina. Podobně průhledné fluorované polymery vyrábějí i jiné firmy, např. Solvay Solexis (Hyflon AD) nebo Asahi Glass (Cytop).
Převážná většina perfluorovaných polymerů není pružná. Výjimkou je Kalrez, kopolymer tetrafluoretenu a perfluor(etenylmetyléteru). Zastoupení perfluoréterového monomeru je v něm řádově vyšší než u předchozích polymerů obsahujících perfluorpolyéterové řetězce (až 40 % proti 0,1–5 %). Pružnosti je dosaženo speciálním síťováním, které je utajeným know-how firmy Chemours. Ta dodává pouze hotové výrobky z Kalrezu, a nikoli surový materiál před síťováním.
Posledními z kategorie zajímavých perfluorovaných polymerů jsou látky nesoucí funkční skupinu, např. sulfonátovou nebo karboxylátovou. První z těchto polymerů vyvinula firma DuPont v šedesátých letech minulého století a komercionalizovala ho původně jako velmi kyselý ionex (měnič iontů) pod názvem Nafion (obr. 6). Japonské firmy, zejména Asahi Glass, rozpoznaly jeho potenciál a využily ho jako klíčovou složku iontoměničových membrán pro nejnáročnější průmyslové aplikace.
Asi nejvýznamnější je role těchto membrán při náhradě původní neekologické rtuťové elektrolýzy chloridu sodného na hydroxid sodný a chlor. Původní nafionové membrány měly výbornou vodivost, ale špatnou iontovou selektivitu, což se významně vylepšilo použitím vrstvených membrán obsahujících střídavě perfluoralkansulfonátové a perfluoralkanoátové skupiny. Tyto membrány, pracující často po několik let při 100 °C v kontaktu s 40% hydroxidem sodným, představují dnes jedny z nejvíce fascinujících materiálů s nenahraditelnou rolí pro životní prostředí. Jejich různé varianty navíc nacházejí stále více aplikací jako součást palivových článků nebo senzorů, jako velmi silně kyselé heterogenní katalyzátory organických reakcí atd.
Vedle perfluorovaných polymerů jsou často využívány i částečně fluorované polymery, které sice nemají tak vysokou chemickou a termální odolnost, ale jsou výrazně levnější a lépe se zpracovávají. Typickými představiteli jsou kopolymer etenu a tetrafluoretenu (ETFE) nebo terpolymer Viton, který je nejběžnějším fluorovaným elastomerem (pružným polymerem).
Inertní kapaliny a mazadla
Při vzájemném pohybu dvou povrchů dochází k tření, vedoucímu ke vzniku tepla, ztrátě pohybové energie a opotřebení obou povrchů. Běžné tuky a oleje, používané jako levná mazadla, nemají často dostatečnou účinnost, dochází k oxidativnímu rozkladu a při vyšších teplotách se mohou vznítit. Vysoké nároky chemicky a tepelně nejnáročnějších aplikací, typických např. pro letecký průmysl, splňují nejlépe oleje a vosky na bázi perfluorovaných polyéterů.
Jak již bylo zmíněno u perfluorovaných polymerů, atomy kyslíku obklopené perfluorovanými skupinami zcela ztrácejí typické vlastnosti éterových atomů kyslíku a chovají se jako flexibilní analogy difluormetylenových skupin. Středněmolekulární a vysokomolekulární sloučeniny obsahující dostatečný počet takových kyslíkových spojek pak mají strukturu olejů nebo vosků a zároveň chemickou odolnost analogickou k Teflonu.
Firma DuPont tak v roce 1965 vyrobila perfluorovaná mazadla na bázi oligomerizace hexafluorpropenu a následné fluorace koncových funkčních skupin pro vesmírný program Apollo a poté je komercionalizovala i pro další extrémní aplikace pod názvem Krytox (obr. 7). Firma Solvay je následníkem firmy Montecatini Edison, která v analogii k oxidaci hexafluorpropenu, vyvinuté firmou DuPont, studovala oxidaci tetrafluoretenu. Vzniklý tetrafluoretylenoxid je však nestálý a dochází k jeho částečné fragmentaci a oligomerizaci. Následnou fluorací koncových skupin byly získány perfluorované vosky a oleje, komercionalizované firmou Solvay jako Fomblin. Třetím hlavním výrobcem vysokovroucích perfluorpolyéterových materiálů je firma Daikin Chemicals, která využívá oligomerizace tetrafluoroxetanu a následné fluorace vzniklého polyfluorpolyéteru na inertní kapalinu Demnum (obr. 7).
Vedle vysokovroucích perfluorovaných sloučenin průmysl potřebuje i stabilní a nehořlavé nízkovroucí plynné a kapalné látky s potenciálním využitím v chladicích zařízeních a klimatizacích, jako hnací média ve sprejích, jako součást čisticích prostředků a v dalších analogických aplikacích. V roce 1930 firma DuPont uvedla pod názvem Freony na trh perhalogenované nízké alkany obsahující atomy chloru a fluoru a dnes označované jako CFC (z angl. chlorofluorocarbons). Ty měly ideální vlastnosti, ale ukázalo se, že poškozují ozonovou vrstvu (viz níže), a proto byly jejich prodej a využití pro tyto účely Montrealským protokolem v roce 1987 zakázány (Vesmír 99, 418, 2020/7).
Jako náhrada byly dočasně povoleny jejich částečně hydrogenované analogy (HCFC) a posléze je nahradily hydrofluoruhlovodíky, z nichž asi nejvýznamnějším je asymetrický tetrafluoretan (HFC 134). Hydrofluoruhlovodíky ale mají vysoký skleníkový efekt, a proto jsou v duchu Kjótského protokolu omezovány. To vedlo k zavedení nefluorovaných hnacích plynů (např. butanu), které jsou v domácím používání mnohem nebezpečnější. V současné době však nastupují nové typy polyfluorovaných sloučenin jako bezpečnější náhrady fluoralkanů. Mezi ně patří např. částečně fluorované étery, reprezentované skupinou látek Novec (inertní kapaliny), částečně fluorované alkeny, např. tetrafluorpropen (pro použití v klimatizacích) a perfluorované ketony (jako vysoce účinná hasiva nahrazující bromfluoralkany).
Ekologické aspekty
Přes mnoho pozitivních dopadů fluorové chemie na životní prostředí, jako je třeba náhrada toxické rtuti při elektrolýze chloridu sodného, jsou fluorované sloučeniny častým terčem zájmu ekologických organizací, a to někdy více, někdy méně oprávněně. Rizika lze rozdělit do pěti hlavních kategorií.
O dvou z nich už byla řeč. Riziko poškozování ozonové vrstvy bylo odstraněno zákazem chlorfluoruhlovodíků (CFC), polyfluoralkany (HFC) se silným skleníkovým efektem jsou postupně omezovány. Třetím významným rizikem je používání perfluoralkansulfonových a perfluoralkanových kyselin, obsahujících sedm až devět atomů uhlíku. Typickými představiteli jsou perfluoroktansulfonová kyselina (PFOS), dříve značně používaná jako změkčovadlo s výbornými vlastnostmi, a perfluoroktanová kyselina (PFOA), používaná např. v některých výrobách Teflonu. Obě představují nejnebezpečnější variantu fluorovaných látek škodlivých zdraví, protože mají tendenci ukládat se v játrech obratlovců (zejména ryb) a nejsou dosud známé žádné fungující mechanismy jejich přirozeného mikrobiálního rozkladu (viz s. 376). PFOS se tak přestal používat již před mnoha lety a zákaz PFOA platí (s některými výjimkami) od roku 2020.
Čtvrtým rizikem, které se v současné době teprve postupně odhaluje, je využívání produktů obsahujících fragmenty s analogickými dlouhými polyfluorovanými řetězci. Příkladem jsou hydrofobní a oleofobní materiály jako Gore-Tex, obsahující polymery s dlouhými polyfluoralkoholovými jednotkami. Jejich degradace a mikrobiální oxidace vedou opět k dlouhým perfluoralkanovým kyselinám s nevyhnutelnými ekologickými důsledky. Omezení výroby a používání takových materiálů lze očekávat v nejbližší době.
Jako náhrada dlouhých perfluoralkylových řetězců se rozvíjí využití analogických perfluorpolyéterových sloučenin, např. kyseliny na bázi dimeru hexafluorpropylenoxidu místo PFOA při výrobě Teflonu. Toxicita i absence mikrobiálních degradačních mechanismů je však pro řetězce analogické délky prakticky identická a v dohledné době lze očekávat zákaz používání i těchto látek. Analogické sloučeniny s kratšími fluorovanými řetězci jsou naproti tomu mnohem méně toxické a na jejich využití jako potenciálních náhrad sloučenin s dlouhými řetězci se intenzivně pracuje. Stejně intenzivně se pracuje i na analýze jejich dopadu na životní prostředí, takže i jejich budoucnost je nejistá.
Posledním diskutovaným rizikem je role anorganických fluoridů, často spojená s kritikou fluoridace vody a používání zubních past s obsahem fluoridů. Ale fluoróza jako nemoc poškozující zuby a kosti a případně i nervovou soustavu, způsobená vysokými koncentracemi fluoridů, je omezena na silně zasažené průmyslové oblasti zemí s nízkou úrovní ochrany životního prostředí, jako je Čína nebo Indie. Na druhou stranu přestože používání zubních past s obsahem fluoru nepředstavuje zdravotní riziko (s výjimkou dětské populace), přirozená koncentrace fluoridů v životním prostředí v České republice je dostačující a používání zubních past s obsahem fluoridů není nutné.
Co dokáže příroda?
Fluor je třináctým nejčastějším prvkem v zemské kůře, a je tedy nejzastoupenějším halogenem. Přesto známe jen asi dvacet přírodních organických sloučenin obsahujících fluor. Koncentrace tohoto prvku v moři nebo povrchových vodách je totiž velmi nízká kvůli malé rozpustnosti fluorovaných anorganických sloučenin. Dalším důvodem omezené biosyntézy organofluorových sloučenin je obtížná oxidovatelnost fluoridového iontu.
V polovině minulého století vzbudila odbornou pozornost četná úmrtí telat a dalších hospodářských zvířat v Austrálii a některých zemích jižní Afriky a Jižní Ameriky. J. S. C. Marais v roce 1944 jako první identifikoval tato úmrtí v jižní Africe jako důsledek intoxikace fluoroctovou kyselinou, kterou izoloval z keře Dichapetalum cymosum (známého z afrikánštiny také pod názvem gifblaar čili jedovatý list, obr. 8).
Fluoroctová kyselina byla poté identifikována jako toxin v mnoha dalších rostlinách, např. v australské akácii Acacia georginae nebo v četných druzích bobovitých rostlin rodů Gastrolobium a Oxylobium. Je pozoruhodné, že mechanismus vzniku fluoroctové kyseliny v těchto rostlinách nebyl dosud přesně identifikován. Není ani zcela zřejmé, zda je fluoroctová kyselina syntetizována přímo těmito rostlinami, nebo mikroorganismy v nich obsaženými.
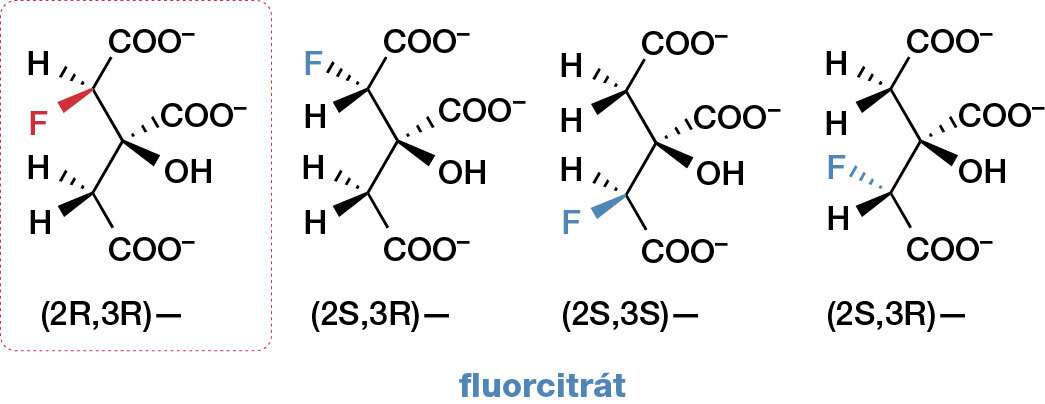
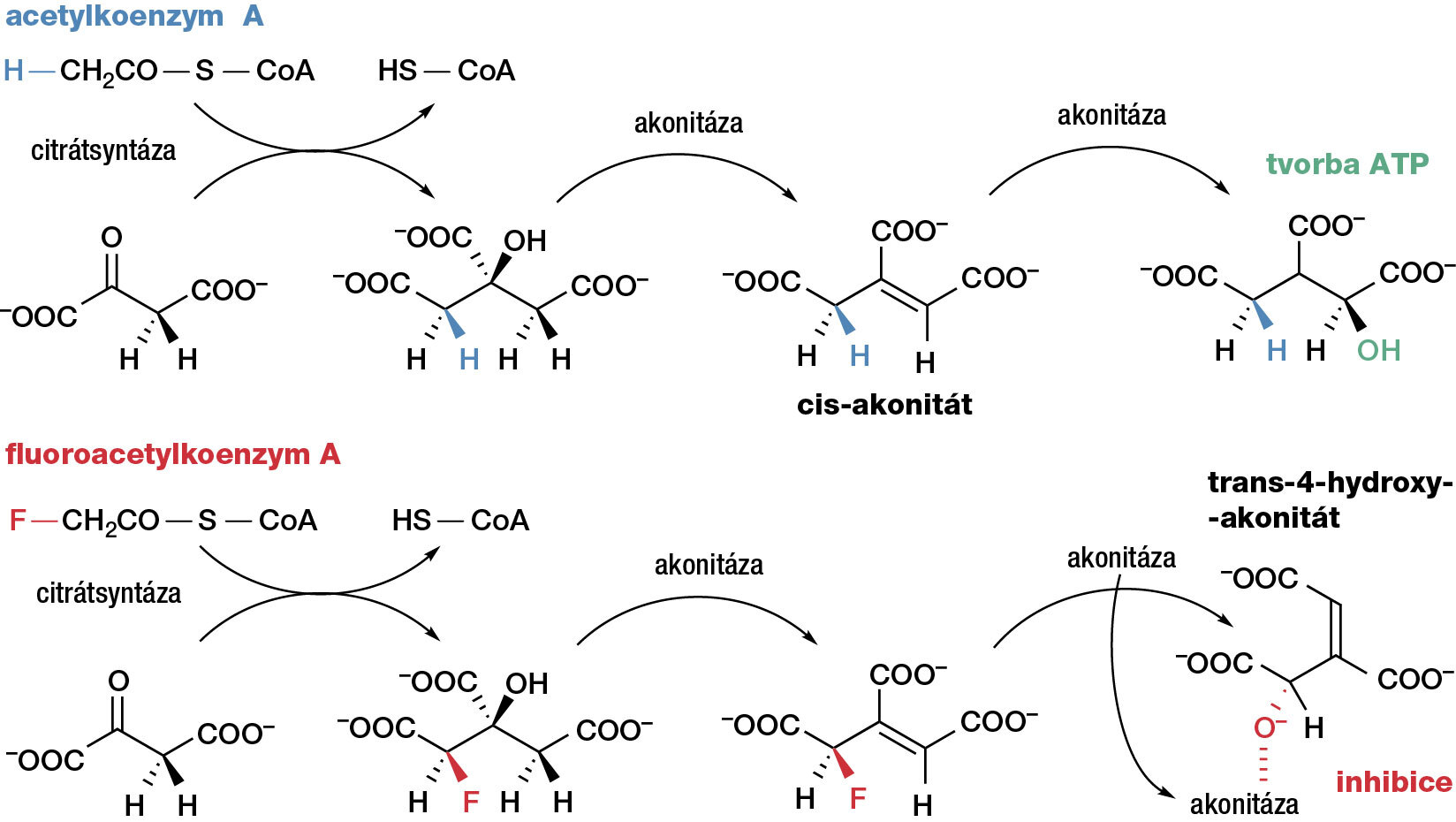
Příčinu toxicity fluoroctové kyseliny poprvé odhalil již v roce 1949 C. Martius a záhy poté ji potvrdil R. A. Peters. Je jí „sebevražedná“ syntéza toxického fluorcitrátu (soli kyseliny fluorcitronové) z kyseliny fluoroctové. Citrát je jedním z klíčových intermediátů Krebsova (citrátového) cyklu, který sérií dekarboxylací a oxidací získává energii pro syntézu adenosintrifosfátu (ATP), jednoho z hlavních chemických zdrojů energie živých organismů. Kyselina fluorcitronová má čtyři možné stereoizomery a pouze jeden z nich aktivně blokuje citrátový cyklus nevratnou reakcí s enzymem akonitázou (obr. 9).
Toxický izomer fluorcitronové kyseliny vzniká reakcí fluoracetylovaného koenzymu A s oxalacetátem (2-oxobutandioátem). Po jeho reakci s enzymem akonitázou dochází k hydrolýze atomu fluoru a následné dehydrataci na trans-4-hydroxyakonitát, který se nevratně váže k enzymu, a blokuje tak jeho uvolnění do dalšího cyklu (obr. 10). Toxicita fluoroctové kyseliny se dramaticky liší pro různé organismy. Zatímco primáti a lidé jsou proti fluoroctové kyselině poměrně odolní se smrtelnou dávkou dosahující v průměru 5 mg/kg hmotnosti, pro králíky je smrtelná dávka desetkrát nižší. Zdaleka nejcitlivější jsou psi, pro něž je smrtelná dávka již 0,05 mg/kg, tj. stokrát méně než pro člověka. Jejich specificky citlivou oblastí je centrální nervový systém.
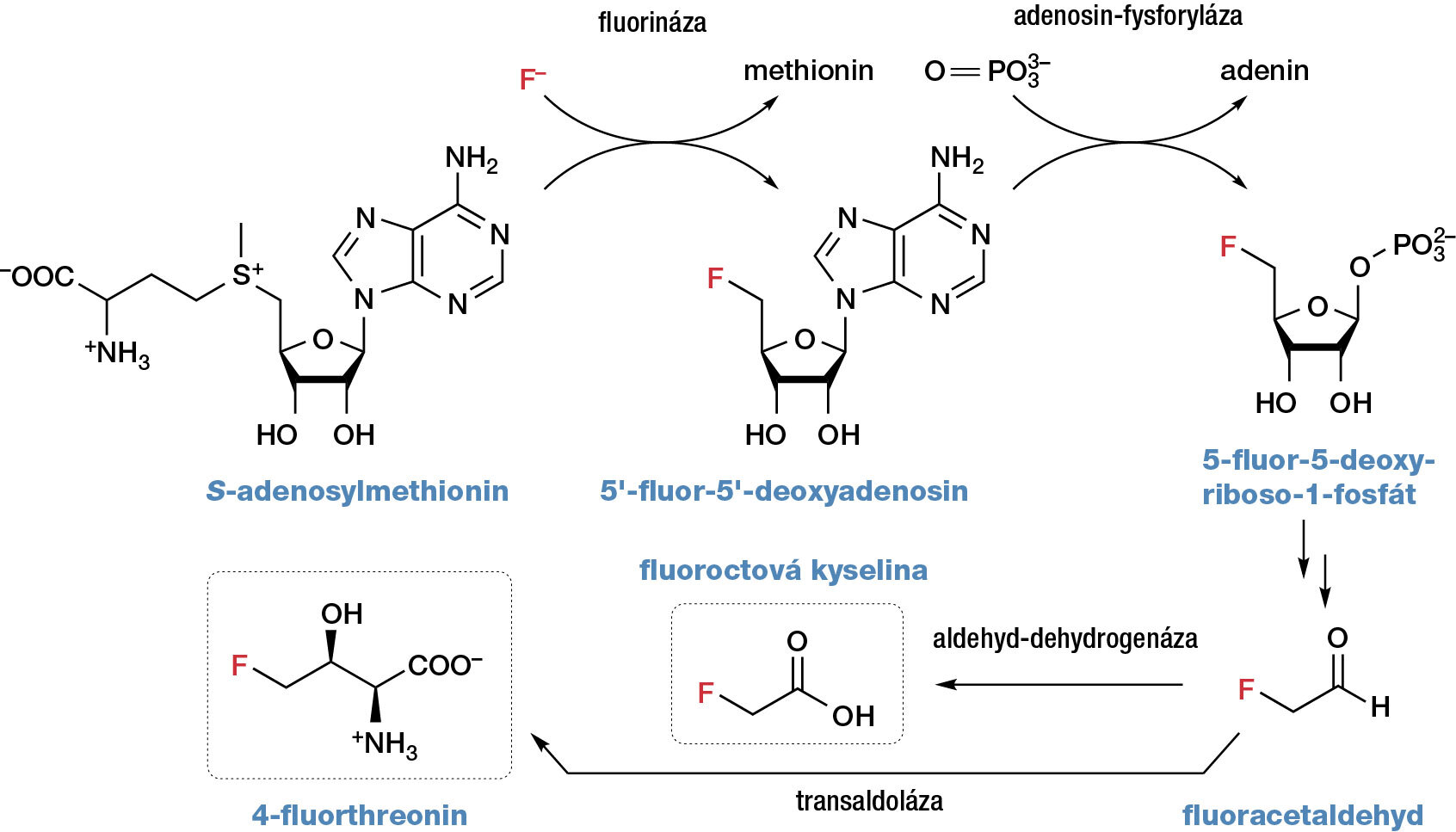
První krok k pochopení mechanismu biosyntézy fluorovaných sloučenin učinil Minoru Sanada v roce 1986, když studoval složení fermentačních produktů aktinobakterie Streptomyces cattleya, používané jinak pro biosyntézu antibiotika thienamycinu, v přítomnosti zdroje fluoridových iontů. Podařilo se mu izolovat dvě fluorované sloučeniny, fluorthreonin a fluoroctovou kyselinu. Klíčovou roli zde však sehráli David O’Hagan a jeho spolupracovníci, kterým se v roce 2002 podařilo identifikovat klíčový enzym fluorinázu v proteinovém extraktu ze S. cattleya, popsat mechanismus jeho účinku a nakonec ho vykrystalizovat v čistém stavu. Aktivní enzym má hexamerní strukturu.
Výchozím substrátem pro biosyntézu fluorovaných sloučenin je S-adenosylmethionin, který je v přítomnosti zdroje fluoridových iontů působením fluorinázy převeden na 5'-fluor-5'-deoxyadenosin, jehož dalšími biotransformacemi vzniká nejprve fluoracetaldehyd a z něj buď fluoroctová kyselina, nebo 4-fluorthreonin (obr. 11).
V roce 2016 čínští autoři v mořské bakterii Streptomyces xinghaiensis charakterizovali další enzym umožňující biosyntézu fluorovaných sloučenin. V roce 2019 zkoumal David O’Hagan s kolegy způsob, jakým půdní bakterie Streptomyces calvus produkuje unikátní fluorované antibiotikum nukleocidin. V genomu této bakterie nenašli gen odpovídající fluorináze a pro biosyntézu nukleocidinu navrhli alternativní cestu. Ačkoli byl identifikován genový klastr vedoucí k jeho syntéze, příslušný enzym nebyl dosud izolován.
V současné době probíhá intenzivní výzkum směrovaný na praktické využití biosyntézy fluorovaných sloučenin. Klíčovým aspektem tohoto výzkumu bylo využití genového inženýrství pro inkorporaci genu fluorinázy do genomu běžné bakterie Escherichia coli a následné využití této bakterie pro syntézu 5'–fluor-5'-deoxyadenosinu in vivo. S prudkým nástupem biologického inženýrství lze v brzké době očekávat nejen dramatický pokrok v biosyntéze přírodních fluorovaných látek, ale také nalezení mikroorganismů a enzymatických systémů schopných degradace škodlivých polyfluorovaných látek v životním prostředí.
Literatura
Inoue M. et al.: Contribution of Organofluorine Compounds to Pharmaceuticals. ACS Omega 5, 10633–10640, 2020, DOI: 10.1021/acsomega.0c00830.
Ogawa Y. et al.: Current Contributions of Organofluorine Compounds to the Agrochemical Industry. iScience23, 101467, 2020, DOI: 10.1016/j.isci.2020.101467.
Okazoe T.: Overview on the history of organofluorine chemistry from the viewpoint of material industry. Proc. Jpn. Acad., Ser. B 85, 276–289, 2009, DOI: 10.2183/pjab.85.276.
Walker M. C., Chang M. C. Y.: Natural and engineered biosynthesis of fluorinated natural products. Chem. Soc. Rev. 43, 6527–6536, 2020. DOI: 10.1039/c4cs00027g.
Poznámky
1) Jsou dostupné i varianty obsahující perfluormetoxyskupinu nebo perfluoretoxyskupinu.
Ke stažení
 článek ve formátu pdf [610,02 kB]
článek ve formátu pdf [610,02 kB]