Lithium, dar Země modernímu člověku
Nepozorovaně jsme přijali za své lehké notebooky, tenké mobilní telefony, drobnou elektroniku. Přestala nás udivovat možnost opakovaně nabíjet a vybíjet baterii a snadnou dostupnost energie uložené v této „konzervě“ pokládáme za samozřejmost. Lithium proniklo do slovníku široké veřejnosti.
Ačkoliv se lithium v přírodě vyskytuje v řadě chemicky značně odlišných minerálů, pouze malá hrstka z nich patří mezi ekonomicky využitelné, a tedy těžitelné.
Největším potenciálním zdrojem lithia byly doposud pegmatity. Za jejich nejkvalitnější ložisko na světě se považuje Greenbushes v jihozápadní Austrálii, kde se ve formě spodumenu (LiAlSi2O6) nacházejí zásoby v úhrnu 118 milionů tun rudy s obsahem 1,4–2,1 % Li.
Procesy spojené se získáním lithia z relativně chudé suroviny jsou energeticky velmi náročné (těžba, drcení velkého množství horniny) vzhledem k manipulaci s extrémně alkalickými či kyselými chemikáliemi a vzhledem k vzniku značného množství obtížně recyklovatelných odpadních solí.
Dalším významným zdrojem pro těžbu jsou solanky, což jsou podzemní vody s vysokým obsahem rozpuštěných látek. Koncentrace lithia v nich dosahují obvykle jednotek mg/l. Těžba solanky spočívá ve vyčerpání podzemní vody do povrchových nádrží a v jejím samovolném odpařování za vzniku solí. Tato technologie nepotřebuje žádné pomocné chemikálie a má menší energetické náklady, než jsou nutné pro izolaci lithia z křemičitanových hornin. Využívá se v aridních oblastech (obr. 1) a v tzv. lithiovém trojúhelníku, který zahrnuje území náležející Chile, Argentině a Bolívii. Odpařením získaná sůl obsahuje obvykle 1–2 % lithia, bývá prosta těžkých kovů a může se odesílat přímo výrobcům čistého uhličitanu lithného. V Evropě zvažuje možnost získání lithia ze solanky Německo, kde se rozpracovává technologie izolace uhličitanu lithného z hydrotermálních pramenů v oblasti tektonického zlomu horního Rýna.
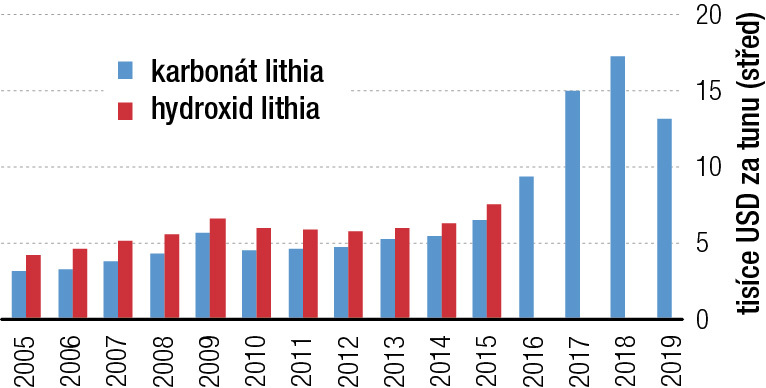
Mezi největšími producenty lithia na světě figurují Austrálie, Chile, Argentina, Čína a Zimbabwe. První čtyři jmenované země v roce 2018 vyprodukovaly dohromady 97 % světové produkce. Během let 2014–2018 se světová produkce ztrojnásobila, což způsobilo výrazný pokles cen lithia na světových trzích (rámeček). V Evropě je největším ložiskem lithia Jadar v Srbsku, poblíž města Loznica. Bylo objeveno v roce 2004 a podle odhadů obsahuje 125 milionů tun lithia ve formě borosilikátu sodno-lithného (nově popsaný minerál jadarit); hmotnostní procento lithia v surovině je 1,2–1,8 %, což je přibližně pětinásobek jeho obsahu v rudách na Cínovci.
Finanční atraktivita tohoto prvku jako komodity samozřejmě vyvolala i zájem o jeho tuzemská ložiska, z nichž nejvýznamnějším je nepochybně Cínovec v Krušných horách, menší význam má Krásno u Horního Slavkova. Některé krušnohorské žuly obsahují 0,05–0,1 % Li, přičemž nositelem lithia je zde slída zvaná cinvaldit (zinnwaldit, obr. 3), která byla podle typické specie z této lokality popsána a pojmenována již v roce 1845.
Ložisko Cínovec řadí geologové ke greisenům, což jsou horniny složené zejména z křemene a slíd, ovlivněné hydrotermálním působením horkých roztoků bohatých např. fluorem a lithiem. Z Cínovce jsou hlášeny zásoby zhruba ve výši 149 500 tun lithia při průměrné koncentraci lithia 0,22 %. Ve srovnání s argentinskými zásobami, stanovenými na 17 000 000 tun, nejde o závratné množství. Nicméně významné výhody představuje pro hlubinné dolování snadná dopravní dostupnost lokality, blízkost zpracovatelských kapacit, možnost rozvoje výrobních zařízení až po finální výrobek (lithiový akumulátor) a také zdroje vysoce kvalifikovaných odborníků i laciné kvalifikované pracovní síly.
„„…lithium je pro konstrukci baterií zcela unikátní materiál, kombinující všemožné výhodné vlastnosti.“
Ekonomickou atraktivitu těžby lithia na Cínovci podtrhuje možnost bezprostředního využití cinvalditu z deponie, který byl při historické těžbě cínových rud jako nezajímavý odpad ukládán na výsypkách. Někdejší odpad, dnešní cenná surovina, je díky tomu ihned k dispozici, bez nutnosti nákladných otvírkových prací dolu, nákladné těžby hornickým způsobem, a navíc v drcené či rozemleté formě. Zároveň by přepracování odpadů deponie napomohlo řešit starou ekologickou zátěž v krajině. Ekonomické bilanci přepracování odpadů deponie i uvažovaného hlubinného dolování přispívá rovněž přítomnost cínu, wolframu a rubidia v surovině (hornicko-geologickou problematiku těžby lithiových surovin v Čechách viz Vesmír 88, 400, 2009/6).
Sloučeniny lithia v novější době
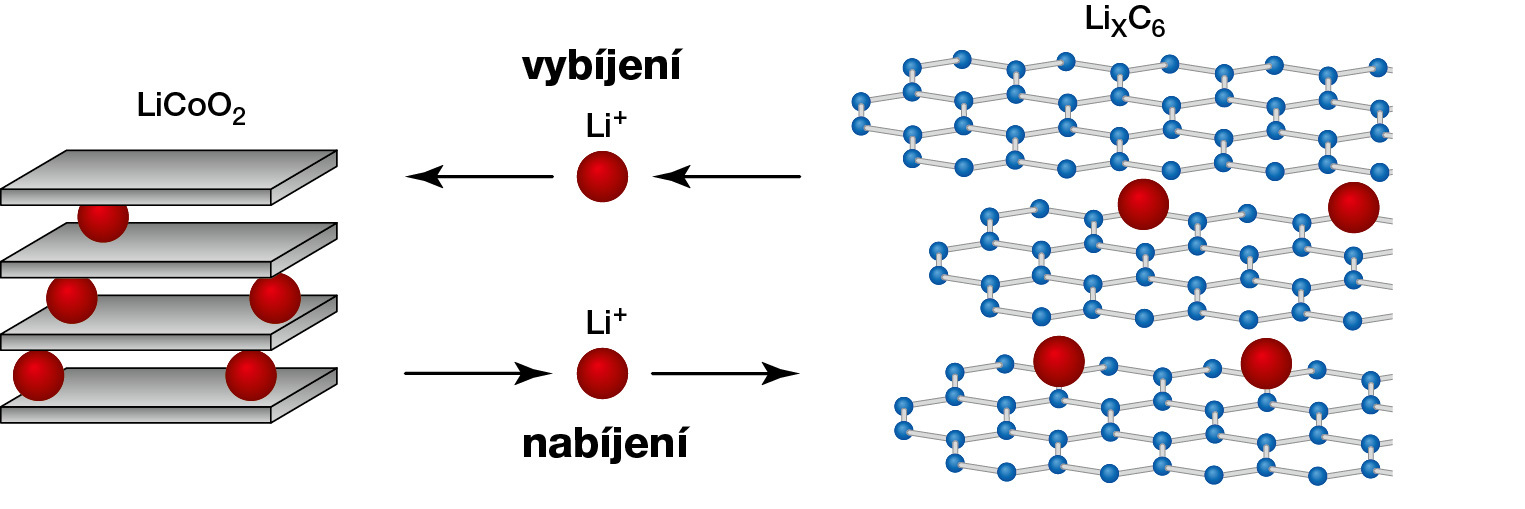
Zvláštní třídou anorganických látek obsahujících lithium (kromě látek vycházejících z hydridu lithného, LiH), která byla prostudována teprve v nedávné minulosti, jsou tzv. interkalační sloučeniny lithia. Typickým zástupcem je interkalát LiXC6, vznikající účinkem par či taveniny lithia na grafit, redukcí grafitu impregnovaného lithnou solí či dalšími technikami. V této látce jsou atomy lithia vloženy (interkalovány) mezi vrstvami grafitu (obr. 8 vpravo). Koeficient x vystupující ve vzorci je obecně neceločíselný, běžně nabývá hodnot mezi 0 a 1 a vyjadřuje fakt, že složení látky kolísá podle způsobu přípravy. K interkalačním sloučeninám lithia můžeme zařadit i čistě anorganické látky LiCoO2, LiMnO2, LiFePO4, v nichž je lithný iont vmezeřen do prostorového skeletu vytvořeného z atomů Co a O, resp. Mn a O.
Lithiové baterie
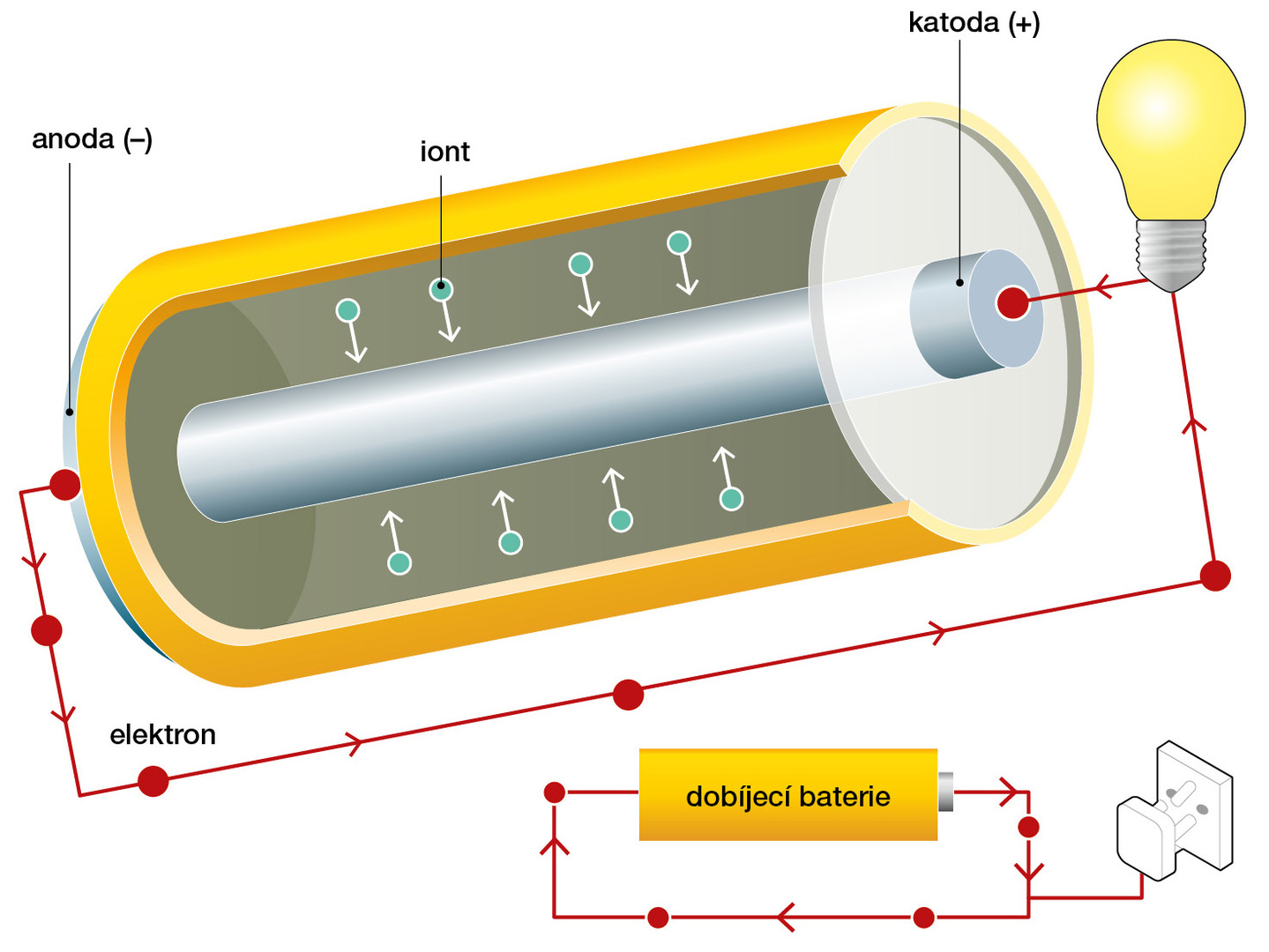
Zcela mimořádná role připadla lithiu a jeho sloučeninám při konstrukci baterií a akumulátorů. Použití lithia v bateriích je výhodné z důvodu velmi nízké molární hmotnosti (6,9 g/mol), přiměřené reaktivity a malé hustoty tohoto prvku. V nových typech článků je významný i malý atomový a iontový poloměr lithia.
Díky nízké molární hmotnosti a současně nízké hustotě dokáže lithium dodat ze všech známých kovů nejvyšší počet elektronů na jednotku hmotnosti. Pokud by v bateriích měl vystupovat na místě lithia jakýkoli jiný kov, nutně by při zachování kapacity rostla také jejich hmotnost. Pro srovnání, lithiová baterie je zhruba šestkrát lehčí než olověná o stejné kapacitě (to znamená, že má šestkrát vyšší hustotu energie).
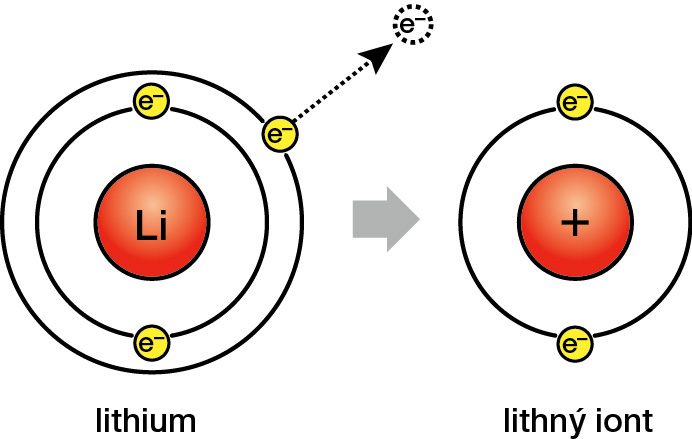
Ve skupině alkalických kovů se lithium vyznačuje nejnižší reaktivitou. Třebaže při kontaktu s vodou či vzdušnou vlhkostí pomalu vyvíjí vodík a může i vzplanout, samovolně se zapaluje jen výjimečně. Tím se velmi odlišuje od sodíku a draslíku, které se samovolně vzněcují zřetelně častěji, anebo od rubidia či cesia, které jsou na vzduchu vysloveně samozápalné.
Pokud se při konstrukci článku využijí interkalační sloučeniny, uplatňují se technologické výhody malého iontového poloměru lithných iontů. Díky tomu jsou lithné ionty velmi pohyblivé, mohou rychle vstupovat mezi vrstvy grafitu či do struktur oxidických elektrod a rychle jimi putovat. Takový článek lze potom rychle nabíjet, přičemž rychlost nabíjení není limitována časem nutným pro vstup nabitého iontu do elektrody. Uživatelský význam této schopnosti ocení každý vlastník mobilního telefonu. Struktury elektrod přijímají malé částice bez vzniku vážnějších pnutí, což je mimo jiné významné pro dlouhodobou životnost baterie. Z uvedeného plyne, že lithium je pro konstrukci baterií unikátní materiál, kombinující všemožné výhodné vlastnosti.
V praxi se dnes užívají jak primární lithiové články (lithiové baterie na jedno použití, které nelze znovu nabíjet, i malé knoflíkové baterie pro různá drobná užití), tak i sekundární články (nabíjecí lithiové akumulátory např. v mobilních telefonech).
Primární lithiové články
Primární lithiový článek může být například konstruován s kovovým lithiem jako zdrojem elektronů, které se vnějším elektrickým vedením přenášejí na elektrodu nasycenou chloridem thionylu SOCl2, jenž elektrony zachycuje.
Reakce probíhající při vybíjení článku jsou následující:
Li → Li+ + e– anoda článku,
2 SOCl2 + 4 e– → 4 Cl– + SO2 + S katoda článku,
2 SO2 + 2 e– → S2O42– aniont dithioničitanový.
Celkový proces při vybíjení baterie:
10 Li + 4 SOCl2 → Li2S2O4 + 8 LiCl + 2 S,
lithium + thionylchlorid → dithioničitan lithný + chlorid lithný + síra (uvedeno jako sumární rovnice procesů v článku).
Článek musí být dobře uzavřen proti vlivu vody a atmosféry, neboť kovové lithium ve směsi s thionylchloridem reaguje se stopami vlhkosti bouřlivě, prakticky explozivně.
Lithiovou baterii založenou na uvedených procesech poprvé sestavil A. Heller v roce 1973. Nikdy však výrazněji nepronikla mezi širokou veřejnost, byla určena pro použití ve vojenských aplikacích a aplikacích pro extrémní podmínky, např. v severských prostředích, neboť je spolehlivá i zhruba při –50 °C.
Sekundární články
Konstrukce sekundárních článků (akumulátorů) založených na použití lithia ukazuje veliký lidský důvtip. Umožňují doslova skladovat energii, v případě potřeby ji využít a po vyčerpání zásobu energie obnovit. Navíc se celý proces může mnohokrát opakovat. Důraz se klade na bezpečné použití článku.
Běžný typ lithiových sekundárních článků využívá interkalát LiXC6 místo kovového lithia jako zdroje elektronů a interkalát LiCoO2 jako příjemce elektronů. Prostor mezi elektrodami je vyplněn organickým rozpouštědlem s rozpuštěnou lithnou solí (například dimetylkarbonátem s chloridem lithným), který zajišťuje vodivé prostředí v článku. Uvedený typ se označuje jako lithium- iontový akumulátor. Interkalát LiXC6 nereaguje s organickým rozpouštědlem, v článku se nevyvíjí vodík (ani žádný jiný plyn). Nehrozí proto nebezpečí exploze při nabíjení ani vybíjení (srovnejte s nabíjením olověné baterie pro automobil, při němž se vyvíjí vodík), článek je chemicky stabilní.
Reakce probíhající při vybíjení článku jsou následující:
LiXC6 → x Li+ + 6 C (grafit) + x e– anoda článku.
Z interkalátu lithia v grafitu vystupují do vnějšího elektrického obvodu elektrony. Vzniklé lithné ionty vystupují do organického rozpouštědla v baterii a pronikají jím ke katodě článku:
LiCoIIIO2 + Li+ + e– → Li2CoIIO2 katoda článku.
Na katodu článku se z vnějšího elektrického obvodu přivádějí elektrony. Ty redukují kobalt, jenž vytváří skelet interkalační sloučeniny, z oxidačního stavu III na oxidační stav II. Lithné ionty transportované organickým rozpouštědlem vstupují do interkalátu a kompenzují náboj skeletu.
Celková reakce při vybíjení článku:
LiXC6 + LiCoO2 → 6 C (grafit) + Li1+XCoO2.
Nabíjení článku probíhá podle přesně obrácených rovnic. Tyto chemické procesy běžně využívá každý vlastník mobilního telefonu, digitálního fotoaparátu nebo notebooku. Vize, že by drobná elektronika mohla být vybavena historickým typem článku, je nevábná. Jen si představme neustálé vyměňování vyčerpaných primárních článků [např. suchého článku Zn/MnO2 (Leclanche)], vzpírání mobilního telefonu nebo transport notebooku vybaveného důkladnou olověnou baterií s odpovídající hmotností.
Rozmach ve využívání lithium-iontových akumulátorů od počátku 21. století a nástup elektromobility vedou k rostoucí poptávce po lithiu, kterou se v současnosti daří dobře uspokojit. Větší starostí než lithium je však dosud nezbytnou složkou prakticky použitelného materiálu pro konstrukci katody. Na výrobu běžného akumulátoru pro elektromobil je zapotřebí přibližně 10 kg lithia a 6 kg kobaltu; nejde tedy o zanedbatelné množství. Ani v nejnovějších typech oxidických katod (např. o složení LiMnXNiYCoZO2, x + y + z = 1) se přes úsilí výzkumníků nedokážeme zcela vyhnout použití tohoto nedostatkového materiálu. Podobně jako v případě lithia zaznamenala cena kobaltu jako komodity v minulých třech letech extrémní nárůst (rámeček), který byl sice korigován, nicméně nedostatek kobaltu představuje pro rozvoj lithiových akumulátorů v současnosti daleko větší omezení nežli přístup k lithiu.
Úloha lithia v současném světě
Lithium a jeho sloučeniny jsou v dnešní době technologicky mimořádně důležité. Jejich spotřeba rychle roste, stejně jako přibývají nově připravené sloučeniny lithia či dosud netušené aplikační možnosti těch stávajících. V celé šíři všemožných použití jsou nyní prakticky nenahraditelné. Význam lithiových akumulátorů pro uložení energie bude nepochybně vzrůstat s orientací energetiky na obnovitelné zdroje (solární články, větrné elektrárny) a elektromobilitu. Můžeme proto tvrdit, že tyto látky jsou pro lidstvo skutečným darem Země.
Ke stažení
 článek ve formátu pdf [1,19 MB]
článek ve formátu pdf [1,19 MB]