Dva obory, které posouvají medicínu nejrychleji kupředu
Současnou medicínu posouvají nejrychleji dopředu genomika a informatika, nebo dokonce spojení obojího. Genomika je rovněž nauka o informacích – věda zabývající se informacemi, které používá živá hmota. Snad není pochyb o samovolném vzniku živé hmoty na bázi změn probíhajících v hmotě neživé. Zřejmě první proces, který umožnil další rozvoj, byl vznik molekul schopných nést informace a přenášet je z generace na generaci. Kam dospěla v péči o zdraví molekulární diagnostika obohacená postupy z informatiky?
Od hrachu k molekulární genetice
V druhé polovině 19. století pomohla matematika Gregoru Johannu Mendelovi odhalit základní pravidla, podle nichž se genetické informace předávají. Ve 20. století stále více badatelů získávalo poznatky o chemickém základu těchto informací v podobě nukleových kyselin a tato poznání umožnila rozkvět genetiky, jehož jsme dnes svědky. Přidržíme se vymezení lidského genomu v oboru genomika, v matematice pak přístupů výpočetních technik, které používá bioinformatika.
Genom a gen
Genetické informace v lidských buňkách jsou ve své většině přítomny v jejich jádře a v mnoha kopiích v mitochondriích nalézaných v cytoplazmě. Jaderný i mitochondriální genom existují v podobě molekul DNA (deoxyribonukleové kyseliny). Nejdříve se podařilo odhadnout a posléze i přibližně stanovit počet genů, které lidské buňky obsahují. Wikipedie definuje gen jako základní jednotku dědičnosti, jako úsek DNA kódující specifickou bílkovinu. Je to sekvence nukleotidů v DNA, která kóduje syntézu informační RNA, podle níž se následně syntetizuje bílkovina. Těchto „proteinotvorných“ genů je v lidském jaderném genomu asi 19–20 tisíc a zabírají jen jeho nepatrnou část, méně než 2 %. Z ostatních transkribovaných oblastí vzniká mnoho molekul různě velké RNA s převážně regulačními funkcemi. Lidský genom však vedle svých funkčně aktivních částí obsahuje i takové, jejichž význam tkví spíše v mechanických vlastnostech, a další, jež představují jakési zbytky kdysi funkčních genů anebo sekvencí cizího původu, kterých se genom nedokázal zbavit.
Pokusů o definici genu je mnoho a neustále se zdokonalují, i my se můžeme o jednu pokusit: Je to základní informační jednotka zajišťující existenci živé hmoty.
Gen a fenotyp
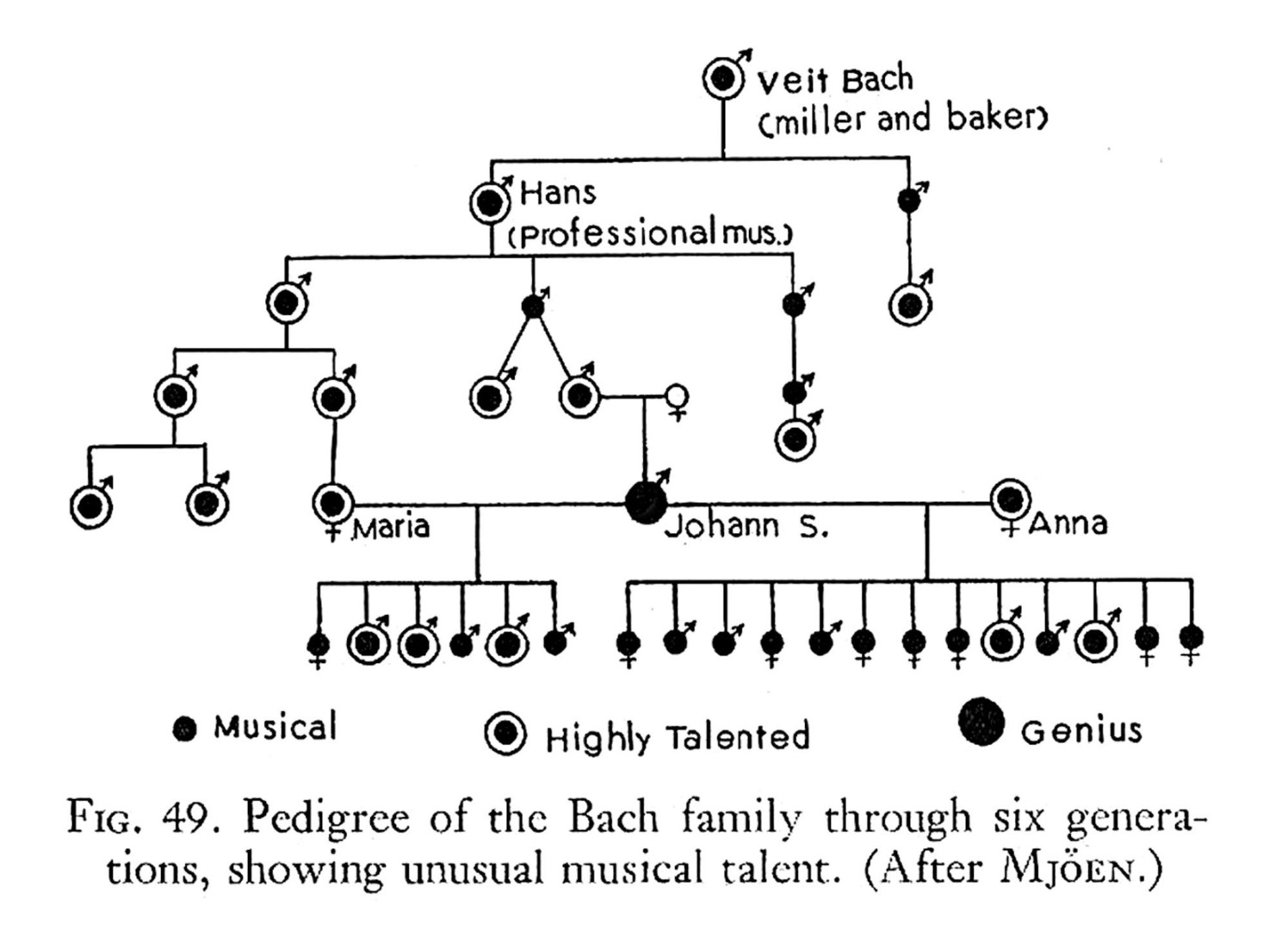
Vnímání dědičnosti lidských vlastností (fenotypu) se uplatnilo již dávno předtím, než se ustavil pojem genu. Často se týkalo určitých vlastností nebo schopností, které by pro svou složitost byly obtížně analyzovatelné i dnes. Vyskytovaly se i v několika za sebou jdoucích generacích. Příkladem může být rodokmen rodiny Bachů, z nichž nejznámější je nesporně Johann Sebastian, člen čtvrté generace hudebníků, a nejméně další dvě generace jeho potomků (obr. 1). U tohoto muzikálního nadání docházelo nepochybně k interakci mezi genomem a prostředím, v tomto případě muzikantským.
Mnohem nápadnější byly stavy s lépe definovatelnou jednoduchou monogenní dědičností. Obvykle se nevyskytovaly často, a pokud jde o choroby, medicína je řadí mezi vzácné (rare diseases). Způsob dědičnosti – obvykle mendelovského typu – ukázal, že většinou byly jejich příčinou změny jednoho genu. Pokud se změny týkaly více genů, byla a dosud je situace složitější. Příkladem může být hluchota: neslyšícím rodičům se může narodit slyšící dítě (každý z rodičů by byl homozygotem pro recesivní formu jiného genu a jejich slyšící dítě dvojnásobným složeným heterozygotem), avšak i slyšícím rodičům se může narodit neslyšící dítě. Orgán sluchu je složitý, má mnoho součástí a na jeho funkci se podílí mnoho genů.
K zásadnímu pokroku v poznání genu přispěla biochemie svými analýzami, které pak převzala do své diagnostiky medicína. Geny v podobě úseku DNA mohou být různě dlouhé, mohou mít přetržitou strukturu a nacházet se na typických místech v genomu. Stejné geny se mohou u různých osob lišit, což z hlediska formální genetiky znamená, že jde o různé alely. Tyto různé podoby stejného genu mohou svou funkci plnit odlišným způsobem, v různé míře a mohou ji někdy úplně ztratit. Geny obvykle fungují v prostředí dalších genů, a tedy i v rámci vzájemných genových vztahů. Jejich produktům – molekulám RNA, které se však neúčastní tvorby bílkovin – je v poslední době věnována zvláštní pozornost z hlediska možné terapie vzácných genetických onemocnění.1
Vývoj molekulární genetiky a s ní spojenou diagnostiku můžeme historicky rozdělit do tří fází.
Štěpení a hybridizace. Tyto techniky se používaly již od druhé poloviny šedesátých let 20. století, tedy v době, kdy jsme již znali nukleové kyseliny, jejich základní typy a stavbu a dokázali jsme je (především DNA) pomocí bakteriálních enzymů štěpit na kratší úseky. Enzymů bylo k dispozici mnoho typů, které se lišily tím, kde a jak dokázaly molekulu DNA štěpit. Vzniklé štěpy jsme uměli identifikovat podle velikosti (rozdělené elektroforézou v gelovém prostředí) a hybridizací se sondami (např. radioaktivně a později fluorescenčně značenými syntetickými jednořetězcovými oligonukleotidy DNA). Byl-li nalezen vztah k nějaké dědičné vlastnosti nebo poruše, byl tím dán i způsob diagnostiky na úrovni DNA.
Polymerázová řetězová reakce – PCR. Další velice výkonná a úspěšná fáze byla opět založena na bakteriálních enzymech, tentokrát syntetizujících – DNA polymerázách. Princip metody PCR byl objeven na počátku osmdesátých let 20. století. Nejprve jsou dvouřetězcové molekuly DNA rozděleny do jednoduchých řetězců, obvykle zrušením vodíkových vazeb mezi nimi (např. zahřátím). Polymeráza pak podle každého z nich vytvoří ze zásob trifosfátů deoxyribosylovaných dusíkatých bází k němu komplementární nový řetězec. Tím se zdvojnásobí vybrané úseky DNA. Běžná polymeráza je termolabilní a po každé denaturaci teplem ztrácí aktivitu. Tento problém byl vyřešen použitím polymerázy z teplomilné bakterie Thermus aquaticus. Jednotlivé kroky PCR se pak daly mnohokrát za sebou opakovat, a tím získat mnohonásobné množství daného úseku DNA pro další analýzy. Tato technika umožnila vycházet z menšího množství DNA, než se získávalo pouhou izolací z jaderných buněk. Pro praktickou medicínu to znamenalo, že k analýze stačí odebrat méně krve. Donedávna to proto byla PCR, která dominovala diagnostice založené na analýze genomu.
Sekvenace nukleových kyselin. Současná lékařská diagnostika se stále více opírá o stanovení sledu nukleotidů – sekvenaci lidského genomu. Původní projekt sekvenace lidského genomu, ukončený v roce 2003, vycházel ze směsi DNA několika osob, protože tehdy bylo zapotřebí velkého množství výchozího materiálu. Postupně se pak podařilo sekvenovat statisíce individuálních genomů, což jak se dalo tušit, přineslo také mnoho překvapivých nálezů.
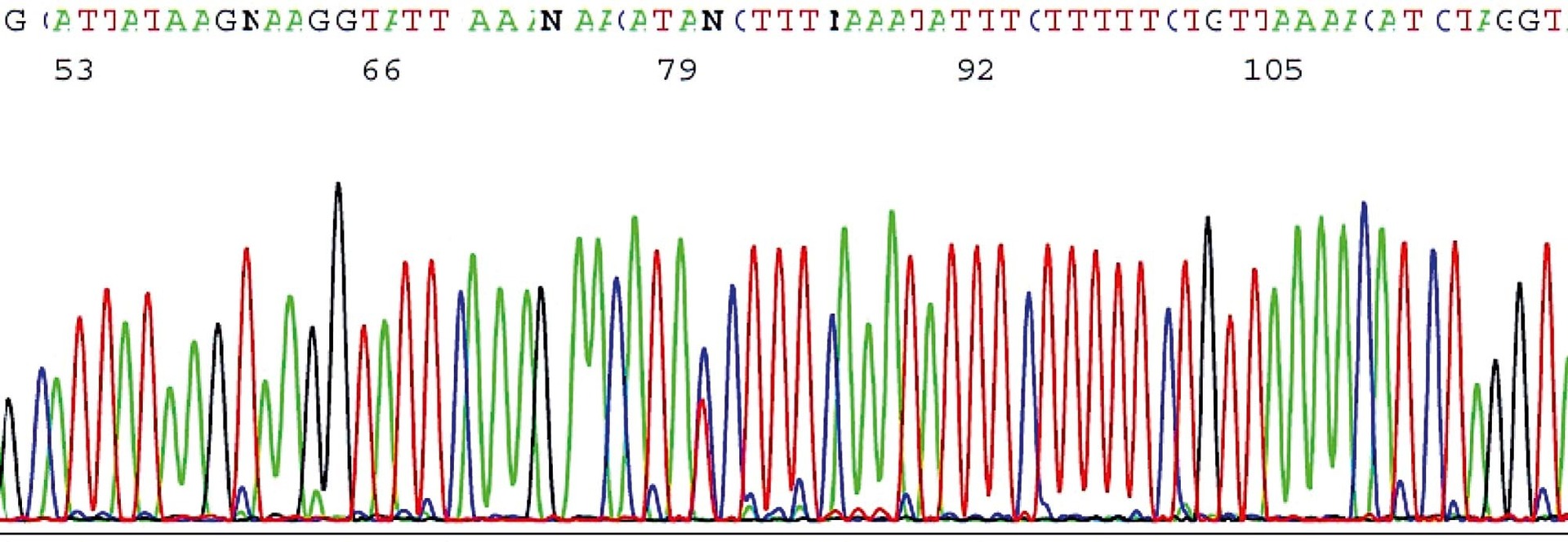
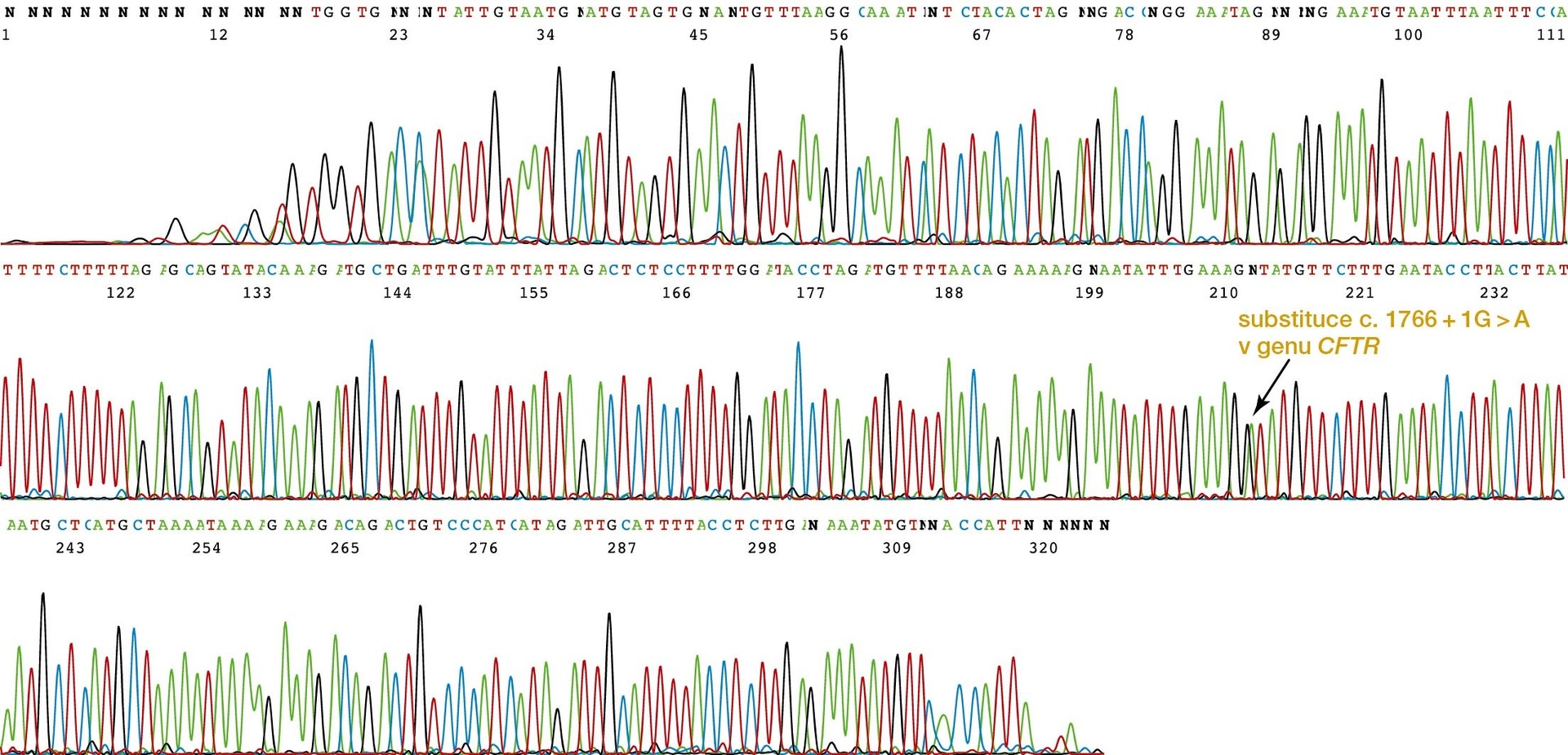
Sekvenační analýza byla původně také založena na gelové elektroforéze. Vzorek byl analyzován ve čtyřech bězích, z nichž každý se týkal jednoho typu nukleotidů, a získané fragmenty se navzájem lišily ve velikosti dané celými čísly v počtu nukleotidů. Toto tzv. Sangerovo sekvenování se v diagnostice stále používá, ale nyní je nahrazováno tzv. sekvenováním nové generace (NGS, nazývané též masivní paralelní sekvenování, MPS). Metoda NGS/MPS umožnila mnohonásobně zvýšit počet vyšetřovaných oblastí DNA a počet současně analyzovaných vzorků. Nyní používané sekvenační techniky jsou mnohem jednodušší a mnohem méně náročné na ruční práci, mohou být automatizované a analýzu výsledků provádí specializovaný software (obr. 2). Dnes si dokonce můžeme vybrat, zda chceme určit sekvenci v určitém úseku nukleové kyseliny, nebo v celém jejím rozsahu či dokonce sekvenci celého genomu. Nedostatkem sekvenace DNA včetně celogenomové (WGS, Whole Genome Sequencing) je to, že nic nevypovídá o aktivitě genů. Kvantitativní pohled na funkci genů přinášejí sekvenace exomová (WES) a transkriptomová, při nichž se dovídáme o všech transkribovaných úsecích genomu.
Sekvenační analýzy provádí řada laboratoří zdravotnických a výzkumných institucí i soukromé společnosti a mohou je využívat i běžní občané. Jednotlivé laboratoře se zaměřují na molekulární genetiku, onkologii, poruchy plodnosti či identifikací osob. Výběr používaných metod je pochopitelně dán cíli, ke kterým jsou používány, např. k potvrzení diagnózy odvozené z vyšetření fenotypu pacienta či k hledání zatím neznámé příčiny nalezené odchylky.
Mutace a rekombinace
Příčinou proměnlivosti genomu jsou jeho nahodilé změny – tzv. mutace. Nejmenší se týkají jednotlivých nukleotidů (ztráty, vložení či záměny), největší pak části genomu, např. změny počtu chromozomů, zmnožení celých chromozomálních sad připadajících na jednu buňku. Některé patogenní změny (dříve nazývané mutace) s generačním přenosem progredují v počtu i účinku (repetitivní sekvence). Nahodilost tkví často v tom, že neznáme jejich příčiny a místo, kde k nim v genomu dojde. Ne všechny se stanou dlouhodobou nebo trvalou součástí genomu. Rozhodují o tom opravné systémy, v optimálním případě je buňkou obnoven původní stav. Podle následků můžeme mutace dělit na škodlivé – patogenní, nebo neškodné – neutrální (benigní), ale neměli bychom opomíjet možnost existence změn, které jsou prospěšné. Nejzávažnější změny mohou postiženou buňku vymanit z citlivosti na regulační pokyny. Náchylností k mutacím trpí různé tkáně různou měrou v závislosti na tom, jak intenzivně probíhá jejich obnova. Mutace téměř nevznikají v tkáních, jejichž buňky se nedělí – neprobíhá v nich syntéza DNA. Dochází k nim také působením vnějších vlivů, např. radioaktivním ozářením. Mohou přibývat také proto, že nejsou dostatečně opravovány (např. v mitochondriích).
Zcela zvláštní kategorií změn jsou rekombinace během zrání gamet u pohlavně se rozmnožujících organismů. Tyto změny dodržují určitá pravidla, jsou svým způsobem plánované, ale i do jisté míry nahodilé. Podstatou rekombinací jsou výměny částí (úseků) mezi párovými chromozomy. Jejich zvláštnost tkví v tom, že se vyměňují poměrně velké celky, kdy k přerušení řetězců dochází v místech tzv. překřížení, která vyplývají z charakteristického uspořádání ve spojení s bílkovinami (histony) uvnitř chromozomů. Neděje se tak s absolutní přesností, takže vyměněné úseky nemusí být vždy stejně velké. Některé geny, které tvoří tzv. vazebnou skupinu, jsou společně vyměňovány častěji než jiné.
Migrace genů
Variabilita genomu je udržována i na úrovni skupin jedinců – genofondu populace – tím, že k rozmnožování dochází i mezi populacemi s nestejnými genofondy. Naopak rozmnožování uvnitř skupin, a zvláště jsou- -li malé, vede k redukci variability se všemi negativními důsledky, které z inbreedingu (vnitřního křížení) vyplývají. Již na samém začátku vzniku Homo sapiens sapiens stálo zřejmě mísení více jedinců.
Není bez zajímavosti, že geny se mohou přenášet nejen mezi genomy v rámci druhu, ale i mezidruhově, pokud mohou existovat mezidruhoví kříženci. Dnešní lidé mají ve svém genomu i části genomu neandertálců. V přírodní říši se geny mohou stěhovat i na velké vzdálenosti. To, že v našich genomech najdeme zbytky genomů virových, je dlouho známo, ale novější výzkumy naznačují, že např. za současné schopnosti našeho zraku, a zraku obratlovců vůbec, může gen, jehož původním nositelem byly zřejmě bakterie.
Prevence
Mnoho chorob má svou příčinu v našem genomu, ale často natolik nenápadně, že to ani nemusíme tušit. Při diagnostických vyšetřeních se provádějí analýzy genomu somatických buněk. Původně je představovaly bílé krvinky získané žilními odběry. Dnes si díky nesmírné citlivosti metod molekulární genetiky vystačíme s buňkami epitelu získanými stěrem z ústní dutiny. Vzhledem k rozvoji prevence a genového inženýrství se v oblasti klinické genetiky otevírají i možnosti v podobě genové terapie. Proto je zájem posunout genomovou diagnostiku do nejranějších stadií života, optimálně do předkoncepčního období, kdy rodiče plánují těhotenství.
Např. ve Velké Británii již přistoupili ke genetickému testování novorozenců,2) byť zatím pouze ve výzkumném projektu.3) Přesun screeningu do nejranějších fází života by umožnil založit každému novorozenci genetický „pas“ – celoživotní zdravotnický dokument EHR (Electronic Health Record). Vzhledem k rozvíjejícím se možnostem genové terapie bude mít z hlediska vývoje jedince diagnostika použitá „co nejdříve“ zásadní význam (k jejímu prvnímu schválenému použití v klinické medicíně došlo v r. 2023 v případě spinální svalové atrofie). Neobyčejnou výhodu má v tomto případě asistovaná reprodukce, která se dostává ještě dál – z vyvíjejících se embryí lze před přenosem do těla matky odebrat několik buněk, vyšetřit je (preimplantačním genetickým testováním, PGT) a pro přenos doporučit pouze „geneticky zdravá“ embrya.
AI pro klinická rozhodování
Firma Roche zařadila do svého portfolia značku Navify. Má podobu algoritmů použitelných ke zpracování vědeckých a klinických údajů a vytváří dostatečně srozumitelné závěry využitelné ve zdravotnictví. Vedoucí skupiny Roche Information M. Hartmann sdělil, že nyní používaná digitální řešení Navify vycházejí z třicetiletých zkušeností s tvorbou programů pro interpretaci laboratorních nálezů, a je tak vytvářen otevřený digitální ekosystém laboratoří, nemocnic a zdravotnických společností, aby se dala rychleji inovovat a zlepšovat zdravotní péče a kliniky získaly v péči o pacienty účinnou podporu. Tento produkt (Navify Mutation Profiler) vychází z analýz sekvenace nové generace (NGS). Firma ujišťuje, že řešení nabízené pod touto hlavičkou se opírá o molekulární nálezy, může dospívat ke klinickým rozhodnutím a vést k optimalizaci léčebných postupů. Podobně se zachovaly i další společnosti: např. Smart4Diagnostics, Imito, Decide Clinical Software, Glytec, Precordior, SteadySense, Deigma, TestCard, Etheclo, Tracie Healthcare Solutions, Binary Tech, Medial EarlySign. Tyto a další systémy (např. VarSome, používaný i v některých našich genetických laboratořích) budou podrobeny rozsáhlému ověřování a kritice kliniků. Stejným směrem se vydala i společnost IBM Watson Health (dnes Merative™) se svými DynaMed® and Micromedex®. Klinici mohou systému poslat své otázky, a záhy dostanou vysvětlující a důvěryhodnou odpověď. K nebývalému rozmachu technologií opírajících se o AI přispívají zvláště iniciativy Bertalana Meskó, zakladatele instituce The Medical Futurist (TMF), která vydává časopis, pořádá on-line kurzy a publikuje e-knížky zaměřené na problematiku digitalizace medicíny. Poslední z nich, která vyšla v srpnu 2023, je právě věnována otázkám uplatnění nové formy tzv. generativní umělé inteligence v medicíně.5)
Preimplantační genetické testování embryí
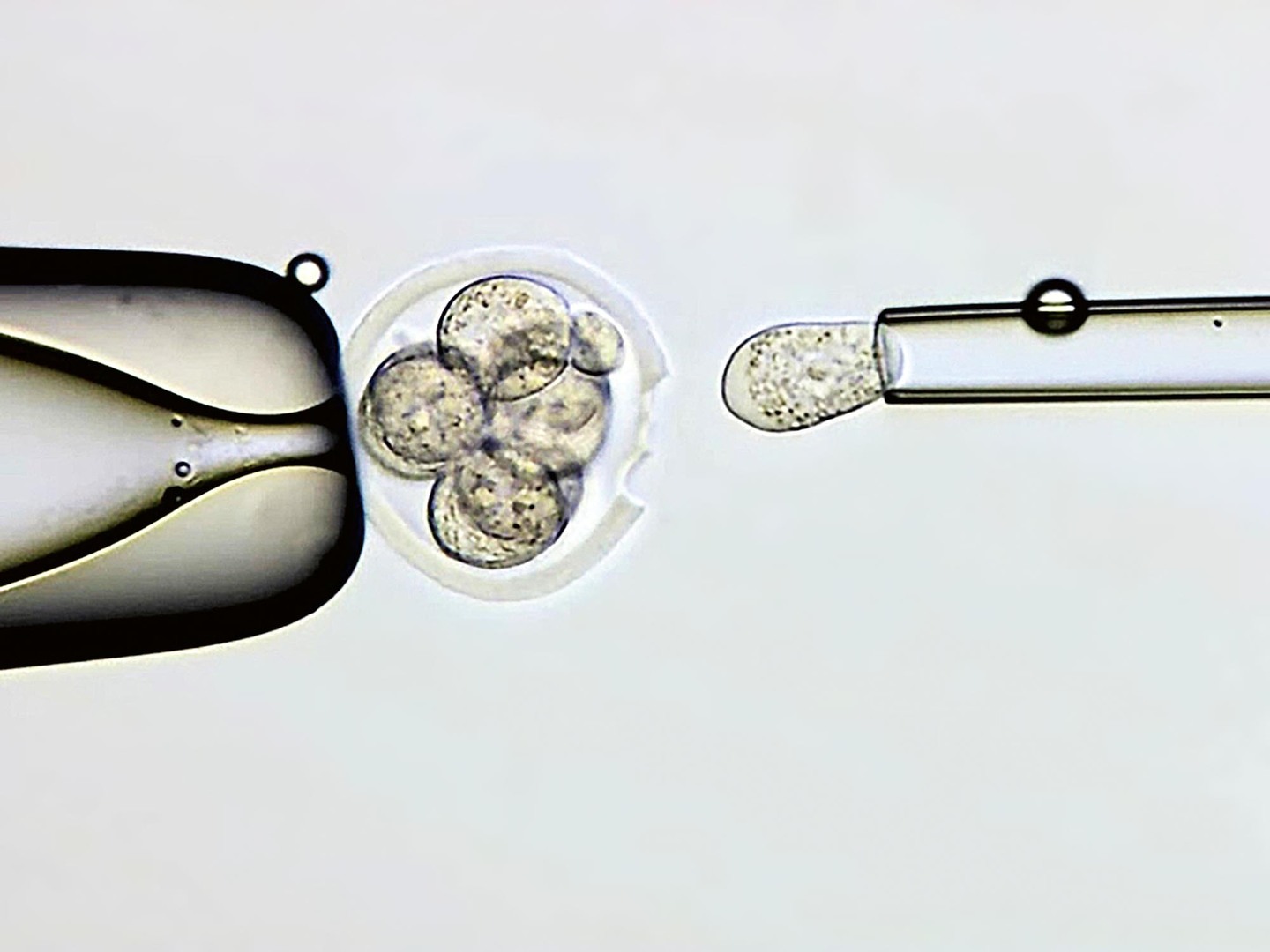
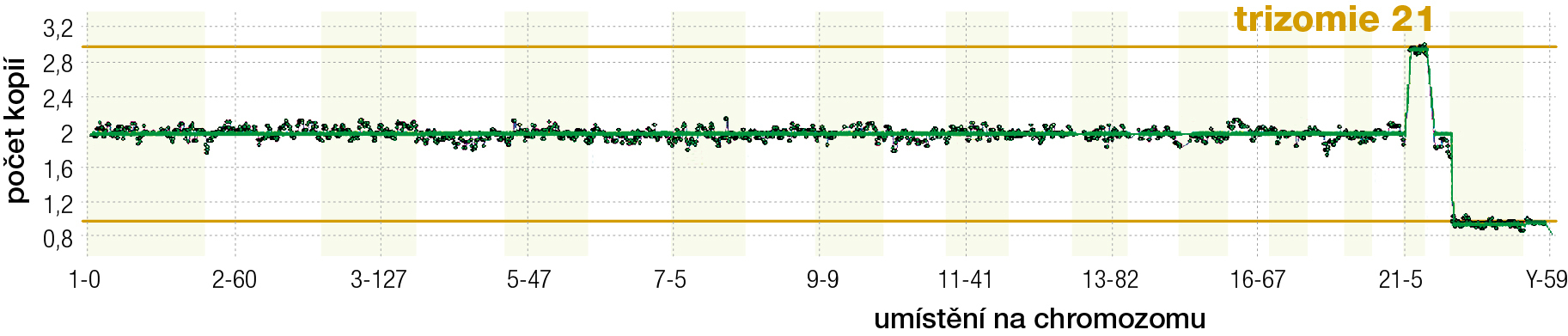
Abnormální počet chromozomů (aneuploidie) v embryích je jednou z hlavních příčin neplodnosti. Plánování rodiny se dnes posouvá do vyššího věku žen a narůstá počet párů, jež mají s otěhotněním problémy a vyhledají pomoc v centrech asistované reprodukce. Se stoupajícím věkem matek se zvyšuje počet abnormalit vajíček, která spolu s nimi „stárnou“, a roste pravděpodobnost chyby při jejich dozrávání. Z aneuploidního vajíčka oplodněného normální spermií vznikne aneuploidní embryo. To bývá významnou příčinou reprodukčních neúspěchů u starších žen. Vyšetřením počtu chromozomů u embryí před jejich přenosem do dělohy se zvyšuje šance na úspěšné otěhotnění, protože se k přenosu vyberou pouze embrya se správným počtem chromozomů. Z vyvíjejících se embryí se mikromanipulací odebere několik buněk, embrya se po odběru zamrazí a odebrané vzorky se vyšetří molekulárněgenetickými metodami (obr. 3). Toto vyšetření se v centrech asistované reprodukce provádí např. u párů s opakovaně neúspěšnými přenosy embrya a s opakovanými potraty, u párů s vyšším věkem ženy a párů s diagnostikovanou přestavbou chromozomů. Vyšetří se chromozomální výbava – karyotyp odebraných buněk (obr. 4). Rovněž se dnes běžně provádí preimplantační testování embryí na choroby způsobené genovými mutacemi. Tyto monogenní choroby se často vyskytují v rodině po několik generací; díky tomu, že se vybere „geneticky zdravé“ embryo, dokážeme rodinnou zátěž přerušit (obr. 5). Významným přínosem této oblasti medicíny je také analogie genové terapie, např. přenos zdravých mitochondrií od dárců tam, kde vlastní mitochondrie neplní svou funkci dostatečně.
Společnost lékařské genetiky a genomiky ČLS JEP si je vědoma důležitosti této oblasti zdravotní péče pro společnost a vytvořila doporučení, jaká pravidla by měly dodržovat a jak mají postupovat instituce, které tyto služby nabízejí. Je samozřejmé, že laboratoře by pro provádění PGT měly být vybaveny příslušnou akreditací.4)
Onkogenetika
Onkogenetika se zajímá především o genotyp nádorových buněk a chce vědět, v čem se liší od zdravých buněk pacienta, aby proti nádorovým buňkám bylo možné cíleně zasáhnout. Proto všechny obory, které bojují s nádory, zařazují do svých diagnostických postupů i analýzy genomu. U některých nádorů je příčina vzniku spojena s hereditární genetickou výbavou nositele, což lze vyjádřit vyšší mírou rizika vzniku nádoru. Je pochopitelně zřetelně vyšší než u osob, které rizikový genotyp ve svém genomu nemají. Znalost genotypu „zdravých“ buněk pacienta a buněk nádorových je i z hlediska léčby zásadní. Klasickým příkladem jsou nádory prsu u žen, kde významné místo zaujímá cílená prevence.
Diagnostický postup obvykle sleduje i aktivitu odpovědných genů a míru dělivé aktivity nádorové tkáně. U pacientů léčených některým z prostředků, které snižují vitalitu nádorových buněk (např. chemoterapií), ale kdy naděje na kompletní eradikaci nemusí být 100%, je snaha odhadnout pravděpodobnost, že nádor po určité době obnoví svou aktivitu – stanovuje se RS (Recurrence Score). To se prokazuje sekvenací vycházející z RNA, tedy WES (Whole Exom Sequencing). Podobně pro obory zaměřené na genotyp vnějšího činitele (příčinu onemocnění, např. virus, bakterii) jsou zdrojem materiálu stěry z povrchu kůže, výtěry tělesných dutin či punktáty tkání.
Mezi příčinami nejen nádorového onemocnění hraje neopomenutelnou, byť různě významnou roli dědičnost, jinými slovy určité vlohy, které není ani dnes lehké jednoznačně vymezit. Pokud hledáme odpovědné geny, je pátrání složitější tam, kde se na určitém znaku podílí více genů, příkladem zde mohou být metabolické procesy. Vymezení podílu genetické složky nebývá snadné, zvláště když odhalení znaku, po němž pátráme, není zcela jednoznačné, jak tomu je např. u duševních poruch. Také propletenec a hierarchie mezigenových vztahů mohou být natolik složité, že není jednoduché je správně seřadit podle významnosti (např. u dlouhověkosti).
Na tvorbě fenotypu mají podíl nejen vlivy způsobující mutace, ale i další faktory, aniž by zasahovaly přímo do sekvence genomu. Funkce genů může být ovlivněna i epigeneticky, např. úpravou struktury dusíkatých bází metylací. Metylace bývá stavem „na delší dobu“, ale buňka má schopnost demetylace a může oba stavy DNA střídat, což se např. děje během zrání gamet a rané embryogeneze.
Vzájemným vztahům mezi různými oblastmi genomu a jejich projekce do fenotypu se věnují asociační studie. Všude tam, kde bylo třeba hledat mezigenové vztahy, nastupovala kombinatorika. Ve svých počátcích používala systém děrných štítků, byla ruční a ve srovnání s dnešními počítači až neuvěřitelně pomalá, ale výsledky přinášela. Výsledkem současného přístupu hledání vztahů uvnitř genomu a mezi genotypem a fenotypem se staly rozsáhlé asociační studie (GWAS – Genome Wide Association Studies). Pochopitelně přinášejí tím více přesnějších výsledků, z čím většího počtu případů vycházejí.6)
Bioinformatika
Uplatnění genomiky v medicíně pokročilo zařazením výpočetních technik mezi základní pracovní prostředky molekulární genetiky. Tyto tendence nejsou nové, a není to tedy jen populační genetika, která se s matematikou již sžila (viz např. rozsáhlé dílo L. L. Cavalli-Sforzy a W. F. Bodmera). Z hlediska populační genetiky je migrace lidí významným faktorem podílejícím se na míře přirozené variability. Migrace provází člověka po celou dobu jeho existence jako druhu, přenáší genomy s jejich mutacemi mezi populacemi a udržuje variabilitu. Medicínu však zajímá nejen variabilita v krevních skupinách, ale rovněž mutace, které samy o sobě vedou k nějakému patogennímu stavu. K hodnocení jejich účinku vznikaly již v osmdesátých letech programy, které nabízely posouzení a intepretaci laboratorních analýz a formulovaly diagnostické závěry či doporučovaly další postup. Na počátku si však nezískávaly dostatečnou důvěru klinických pracovníků (lékaři musí být v zájmu pacientů opatrní). Nicméně vývoj podobných programů se nezastavil a nárůst množství dat i vývoj počítačů vedly k vytváření vhodnějších algoritmů, které již začaly přinášet nezpochybnitelné výsledky, použitelné v lékařské praxi.
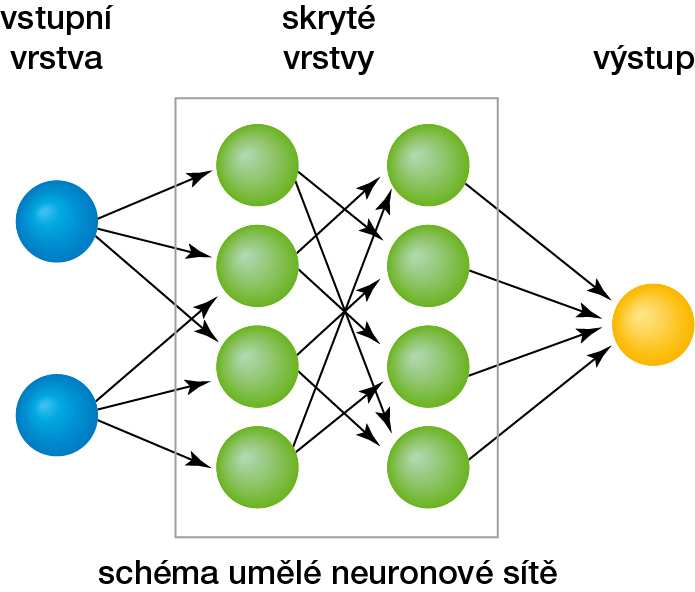
Ne všechny lékařské obory si nové programy hned oblíbily. Jako vhodné se ukázaly např. v onkologii, kde směr vyznávající jedinečnost pacienta a jeho nádorového onemocnění oceňuje možnost dospět rychle a jednoznačně k molekulární identifikaci nádorové tkáně. Dovoluje tak přesně zacílit terapii. Úspěšně si v tomto směru vedli i pracovníci domácí lékařské obce a sestavili diagnostický panel CZECANCA, který se dnes úspěšně používá v řadě českých genetických laboratoří.7) Celosvětově významné firmy vytušily, že v lékařských kruzích bude o tyto programy a jejich zhodnocení zájem, a začaly se věnovat oboru bioinformatiky – umělé inteligenci (AI) s hlubokým učením a konstrukci neuronových sítí,8) mezi nimiž dnes dominují konvoluční neurální sítě (convolutional neural networks; obr. 6).
Nabízenou součástí dnes vyráběných lékařských přístrojů nejsou jen programy pro jejich provoz, ale také ty, které vyhodnocují výsledky z hlediska medicínského významu. K propojení diagnostických „strojů“ s AI došlo zcela logicky a nevyhnutelně, prakticky v celé šíři medicíny, nejen v oblasti genetiky. Vedle již zmíněné onkologie dosáhla AI úspěchů v dalších oborech: v obrazové analýze, v dermatologii, očním lékařství, rentgenologii, elektrokardiografii, echokardiografii ad. Vzhledem k tomu, jak pokračuje rozvoj této vědní oblasti, kdy se objevila nová „forma“ v podobě tzv. generativní umělé inteligence, lze očekávat její přínos v podobě zvýšení preciznosti diagnostických postupů v medicíně. Zabývá se jí e-kniha B. Meska „Generative AI in Healthcare – The ChatGPT Revolution“, která vyšla v srpnu 2023. A není pochyb, že se AI bude významně podílet na rozvoji nových medicínských oborů, např. telemedicíny, od níž očekáváme, že nám celosvětově pomůže vyřešit problém přetížení zdravotnické péče.
Vedle firem zmíněných v rámečku se tvorbě algoritmů pro vyhodnocování nálezů sekvenačních metod věnují speciálně zaměřené instituce, např. eVai z Pavie umožňuje precizní a rychlou diagnózu vzácných chorob.9) U vzácných chorob nemusí být otázka rychlosti prioritní, přínos vstupu bioinformatiky do této problematiky spočívá v bezkonkurečně velkém množství výchozích údajů. Zkušenosti již získávají pracoviště u nás a na Slovensku. Doporučují jistou opatrnost, což nejspíš vyplývá z určité míry nedůvěry, ale připouštějí, že jim v řadě případů tyto expertní počítačové programy se schopností vytvářet interpretační závěry pomohly ke stanovení správné diagnózy. Porovnání výsledků získaných programy na bázi AI ukázalo, že mají ve srovnání s prací člověka příslušné odbornosti o poznání nižší procento chyb.
Počty genových cílů v těchto vyšetřeních neustále stoupají, a byť jsou zatím zaměřeny pouze na monogenní choroby, lze předpokládat, že se postupně rozšíří i na poruchy se složitějším genetickým základem. Zatím však v tomto směru nedospěli genetici – zvláště z etického hlediska – k jednoznačnému názoru. Již však vznikla mezinárodní iniciativa, která se cíleně zabývá „nediagnostikovanými“ chorobami (tedy spíše stavy, které dosud nemají jméno). Umělá inteligence se neprosazuje jen v genetice a v medicíně. Stává se nástrojem, který lze použít k řešení téměř jakýchkoliv otázek spojených s lidskou činností, což ovšem vyvolává obavy z jisté všemocnosti a ukazuje na potřebu stanovení přijatelných pravidel pro její používání.
Poděkování: Autoři by rádi vyjádřili svůj dík všem kolegům, kteří radou či jinak pomohli při tvorbě tohoto textu, zvláště při přípravě ilustrací, jmenovitě panu Tomáši Petrtýlovi.
Poznámky
1) Sun Y.-M., Chen Y.-Q.: Principles and innovative technologies for decrypting noncoding RNAs: from discovery and functional prediction to clinical application. Journal of Hematology & Oncology 2020, 13, 109, DOI: 10.1186/s13045-020-00945-8.
Součástí práce je klasifikace různých typů nekódujících RNA, jejich umístění v buněčném prostoru a funkční začlenění do nejrůznějších procesů. Medicíně to slouží např. pro diagnostiku nádorů.
2) Buxton J.: Whole Genome Sequencing at Birth: Genomic Data, a Resource from Cradle to Grave? BioNews 2022, 1133.
3) Při původním projektu v r. 2011 bylo vyšetřeno sto tisíc osob a našla se u dětí řada nových mutací – nových „velevzácných chorob“.
4) https://slg.cz/doporuceni/prenatalni-diagnostika/prenatalni-vysetreni. V České republice máme progresivní genetickou legislativu v § 28–30 zákona 373/2011 Sb.
5) https://medicalfuturist.com/our-vision.
6) Uffelmann E., Huang Q. Q., Munung N. S. et al.: Genome-wide association studies. Nature Reviews Methods Primers 2021, 1, 59.
7) Aby uvedený panel stále odpovídal nejčerstvějším poznatkům, pečuje o něj konsorcium 11 laboratoří (http://czecanca.cz/konsorcium.html). Poslední verze 1.22 vyšla v únoru 2023. Současně obsahuje 226 genů a je neustále konfrontována se vzorky zdravých dobrovolníků. Dnes jej průmyslově vyrábí i firma Roche.
8) Yu K.-H., Beam A. L., Kohane I. S.: Artificial intelligence in healthcare. Nature Biomedical Engineering 2018, 2, 719–731, DOI: 10.1038/s41551-018-0305-z.
Ostatní použitá literatura je na vyžádání k dispozici u autora.
Ke stažení
 článek ve formátu pdf [1,15 MB]
článek ve formátu pdf [1,15 MB]