Nové souvislosti stárnoucí teorie
Ve výzkumu se občas stává, že různé vědecké skupiny mají na určitou problematiku velice vyhraněný a dobře podložený názor, který je však těžko slučitelný s teoriemi jiných odborníků. Až do raného 20. století se třeba fyzici přeli o to, zda má světlo částicovou, nebo vlnovou povahu. Pravdu měly nakonec obě skupiny a současně žádná z nich, takže z toho všichni zúčastnění vyšli se ctí. A kvantová mechanika, která z této kontroverze vzešla, otevřela éru moderní fyziky.
V současnosti by tuto situaci mohla připomínat otázka příčiny stárnutí. Jsou odborníci, kteří by dali ruku do ohně za to, že problém je v mitochondriích. Jde o drobné struktury uvnitř buněk, které spalují cukry a tuky, a když jsou přetíženy, produkují nebezpečné kyslíkové radikály. Ty pak mohou poškozovat DNA, což má za následek hromadění chyb a pokles výkonnosti. Čím hůře fungují mitochondrie a čím méně jich je, tím je přetížení výraznější a nebezpečnější (Vesmír 90, 144, 2011/3).
Pak je tu ale ještě druhá vlivná skupina, která za vším hledá opotřebované telomery. To jsou konce chromozomů, které se při každém buněčném dělení zkracují. Enzymy, které mají za úkol zdvojovat genetickou informaci, totiž nejsou schopné dojet až do samého konce DNA. Pokud tedy nefunguje nějaký jiný mechanismus, chromozomů od konců ubývá.
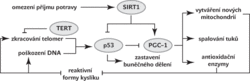 Telomery lze prodloužit činností enzymů ze skupiny telomeráz. Nejdůležitější z nich jsou patrně telomerázové reverzní transkriptázy, které nastavují konečky chromozomů podle RNA předlohy. Každý takový enzym si proto s sebou nosí templátovou RNA. Telomerázy jsou ovšem povětšinou aktivní jen v buňkách, z nichž vznikají spermie a vajíčka.1) V buňkách těla se telomerázové reverzní transkriptázy nevyrábějí, a konce chromozomů se proto zkracují. Když zkrácení překročí určitou mez, aktivuje se protein p53, který pak zablokuje další buněčné dělení.2) Bez dělení (a tedy vzniku nových, čerstvých buněk) orgány postupně stárnou a odumírají.
Telomery lze prodloužit činností enzymů ze skupiny telomeráz. Nejdůležitější z nich jsou patrně telomerázové reverzní transkriptázy, které nastavují konečky chromozomů podle RNA předlohy. Každý takový enzym si proto s sebou nosí templátovou RNA. Telomerázy jsou ovšem povětšinou aktivní jen v buňkách, z nichž vznikají spermie a vajíčka.1) V buňkách těla se telomerázové reverzní transkriptázy nevyrábějí, a konce chromozomů se proto zkracují. Když zkrácení překročí určitou mez, aktivuje se protein p53, který pak zablokuje další buněčné dělení.2) Bez dělení (a tedy vzniku nových, čerstvých buněk) orgány postupně stárnou a odumírají.
Zkracování telomer dobře vysvětluje např. stárnutí kůže, střevní sliznice nebo krvinek čili těch buněk, které se často dělí. Stárnutí je však komplexní proces, který se projevuje i v tkáních, kde k buněčnému dělení dochází jen velice omezeně. Telomerová teorie má tudíž potíže vysvětlit, proč s věkem klesá efektivita mozku, srdečního svalu nebo třeba jater. Proč by těmto buňkám mělo vadit, že jim p53 zablokuje buněčné dělení, když se stejně moc nedělí?
Na tuto otázku by měl odpovědět nedávno zveřejněný výzkum myší s vyřazeným genem pro telomerázovou revezní transkriptázu. Pod článkem je podepsáno třicet autorů z deseti renomovaných pracovišť, povětšinou ve státě Massachusetts. Tito výzkumníci pěstovali myšky bez zmíněné transkriptázy po čtyři generace a sledovali, jak se u nich prohlubují symptomy stárnutí. Jelikož nebyly telomery těchto zvířat protahovány ani ve stadiu pohlavních buněk, jevily se myši z čtvrté generace starší než generace předchozí.
Překvapivě se ukázalo, že jedním z nejvýraznějších projevů zkrácených telomer jsou nefunkční mitochondrie. Obě dominantní teorie stárnutí se tak najednou potkávají. Ukázalo se, že protein p53 má svou roli nejen v buněčném cyklu, ale rovněž snižuje syntézu bílkovin ze skupiny PGC-1. PGC-1 je důležitý transkripční koaktivátor, který spouští expresi řady genů důležitých pro tvorbu nových mitochondrií, spalování mastných kyselin, boj s kyslíkovými radikály i výrobu glukózy (Vesmír 88, 710, 2009/11).
A v tom to celé vězí. Zdá se, že PGC-1 je tím hlavním hráčem při stárnutí nedělících se buněk. Pokud ho máme ve svých buňkách málo, poklesne obsah mitochondrií. Stejné množství živin je spalováno v menším počtu mitochondrií, a častěji proto dochází k chybám, při kterých vznikají kyslíkové radikály. Bez PGC-1 není k dispozici ani dostatek antioxidačních enzymů, které by se s radikály dokázaly vypořádat, a reaktivní formy kyslíku proto napadají a ničí DNA včetně telomer. Zvýšená hladina kyslíkových radikálů by tak podle nové teorie nebyla prvotní příčinou stárnutí, ale jen jedním z příznaků. Možná proto také dosud nebyly odhaleny antioxidační látky, jejichž podávání by u pacientů projevům stárnutí bránilo.
Už dávno je také známo, že PGC-1 je aktivován mimo jiné při jediném skutečně efektivním způsobu, jak si prodloužit život – při omezení množství přijímané potravy (Vesmír 90, 144, 2011/3). Tzv. kalorická restrikce aktivuje molekulu SIRT1, která pak ovlivňuje i činnost p53 a PGC-1.
O příčině stárnutí lidé uvažují již celá desetiletí. Do jisté míry je to už obnošená vesta. Nyní však před námi leží zbrusu nová hypotéza, která spojuje dvě dříve konkurenční teorie. Nefunkční a nepočetné mitochondrie jsou zkrátka důsledkem nízké aktivity PGC‑1. Ten přitom může být blokován činností proteinu p53, který je spouštěn mj. při nadměrném zkrácení telomer. V dělících se buňkách působí p53 zejména skrze blokování buněčného dělení a programovanou buněčnou smrt, v nedělících se buňkách je hlavní cestou právě PGC-1 dráha.
Bylo by asi naivní očekávat, že současný objev odstartuje stejný boom jako svého času nová teorie o povaze světla. Rozhodně se však můžeme v této oblasti nadát ještě mnohých zajímavých zjištění.
Literatura
E. Sahin et al., Nature 470, 359–365, 2011
Ke stažení
 článek ve formátu pdf [229,92 kB]
článek ve formátu pdf [229,92 kB]
O autorovi
Petr Zouhar
















