Jezme méně, žijme déle
| 10. 3. 2011Jednou z odvěkých tužeb člověka, která je poprvé doložena již v eposu o Gilgamešovi, je dosažení nesmrtelnosti nebo alespoň významné prodloužení pozemského života. Generace filozofů a teologů hledající alternativní cíle nenabídly dostatečně přesvědčivé argumenty k tomu, aby se lidstvo od tohoto nesplnitelného přání zcela odvrátilo. Lidé vyzkoušeli ledasco, od zaříkávání až po antioxidanty ze zeleného čaje. Jediný zaručený prostředek k dosažení delšího a zdravějšího života, jenž funguje u širokého spektra organismů od jednobuněčných kvasinek až po laboratorní hlodavce, je ovšem velice jednoduchý: V souladu s lidovým moudrem o jedení do polosyta a pití do polopita se už v roce 1935 ukázalo, že potkani, kterým je omezeno množství přijímané potravy, žijí prokazatelně déle než jejich plně nažraní soukmenovci.[1] Hladem lehce týraná zvířata přitom nejenom umírají později, ale zároveň vykazují lepší zdravotní profil. Méně často se u nich projeví ateroskleróza, diabetes 2. typu a další poruchy sdružované pod označení metabolický syndrom.
Zpomalené stárnutí a hladovění bez hladu
Vysvětlení pozorovaného jevu by se zdálo jednoduché a intuitivní: Přežírání způsobuje zdravotní komplikace, které zvyšují pravděpodobnost předčasného úmrtí a snižují průměrnou délku života u kontrolní skupiny. Takový poznatek by patrně nestál za obšírné rozepisování. Zdůrazněme proto, že u zvířat vystavených kalorické restrikci bylo pozorováno zpomalení nástupu řady efektů, které obecně spojujeme se stárnutím. Nejde tedy o to, že by kontrolní potkani umírali dříve kvůli náhlým zdravotním selháním. Hladem strádající hlodavci (a nejen hlodavci) zkrátka opravdu stárnou pomaleji! A to již není zdaleka tak triviální zjištění.
 Bylo by samozřejmě naivní očekávat, že všichni churaví tlouštíci v tomto okamžiku zpozorní a zamyslí se nad svým životním stylem. Ani vyhlídka na delší spokojené stáří je patrně nepřesvědčí, aby si dlouhodobě odpírali řekněme 30 % své oblíbené potravy. Pro mnohé je otázkou, zda delší život vůbec stojí za takovou oběť. A zde přichází ke slovu moderní věda.
Bylo by samozřejmě naivní očekávat, že všichni churaví tlouštíci v tomto okamžiku zpozorní a zamyslí se nad svým životním stylem. Ani vyhlídka na delší spokojené stáří je patrně nepřesvědčí, aby si dlouhodobě odpírali řekněme 30 % své oblíbené potravy. Pro mnohé je otázkou, zda delší život vůbec stojí za takovou oběť. A zde přichází ke slovu moderní věda.
Kalorická restrikce evidentně výrazně moduluje metabolické procesy probíhající v našich tělech, a tím dokáže zajistit delší, zdravější, a tedy patrně i spokojenější život. Existuje určitá naděje, že pokud detailně porozumíme mechanismu, jakým mírné hladovění toho všeho dosahuje, budeme moci podmínky kalorické restrikce simulovat. Pak by zmínění tlouštíci mohli klidně konzumovat své standardní porce ad libitum, zatímco jejich těla by se přeprogramovala na spořivý mód a zpomalila stárnutí. To není taková utopie, jak by se mohlo zdát. Známe již několik látek, které mohou za určitých okolností působit velice příznivě proti stárnutí i rozvoji metabolických poruch zřejmě právě tak, že ovlivňují signály informující tělo o množství přijímané potravy. O některých z nich se ještě zmíníme.
Úvodní kompendium
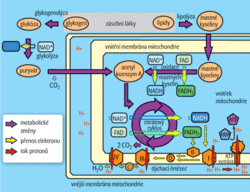
Abychom si mohli ukázat, jak mají tyto léky fungovat a jak podle současných představ ovlivňuje množství přijímané potravy metabolické pochody, musíme si nejprve krátce shrnout, co se děje s živinami po jejich pozření. Jednoduché cukry a tuky jsou vstřebávány ve střevě do krve a pak přes játra přenášeny k cílovým tkáním. Mohou být upotřebeny přímo pro uvolnění energie nebo uskladněny na časy nedostatku v podobě triglyceridů v tukové tkáni (v případě tuků) nebo glykogenu v játrech a svalech (v případě cukrů). Jakým způsobem probíhá vlastní rozklad živin a syntéza ATP v jednotlivých buňkách, ukazuje zjednodušené schéma. Koncové kroky všech těchto drah probíhají v mitochondriích. Vždy jde o postupnou oxidaci, při které jsou z cukru nebo tuku postupně odebírány elektrony za vzniku redukovaných přenašečů NADH a FADH2. Pro nás bude v dalším textu důležité, že při oxidaci tuků (mastných kyselin) je poměr vznikajícího NADH ku FADH2 oproti oxidaci cukrů posunut více ve prospěch FADH2. Redukované elektronové přenašeče pak odevzdávají elektrony komplexům dýchacího řetězce ve vnitřní mitochondriální membráně (NADH předává elektrony komplexu I, FADH2 komplexu II). Elektrony poté putují k dalším komplexům a končí ve vznikající molekule vody. Jejich pohyb dýchacím řetězcem způsobuje čerpání protonů přes membránu. Rozdíl v koncentraci protonů na obou stranách vnitřní mitochondriální membrány je pak zužitkován pro syntézu ATP (univerzálního zdroje energie).
Za vším hledej ROS
Jak ale může popsaný metabolismus souviset se stárnutím organismu? Má se za to, že stárnutí je projevem změn ve struktuře DNA. Mluví se o zkracování telomer (koncových částí chromozomu) při každém dělení, ale ještě důležitější je patrně hromadění různých mutací. Mutace mohou být způsobeny řadou příčin, např. působením různých reaktivních látek. A jednou skupinou takových látek jsou i kyslíkové radikály (ROS – reactive oxygen species), které vznikají, když elektrony uniknou předčasně z dýchacího řetězce a aktivují molekulární kyslík (dochází k tomu nejčastěji na komplexech I a III).
 A jsme u toho! Před několika desetiletími vědci zajásali. Rýsoval se krásný bludný kruh stárnutí: Při rozkladu živin v mitochondriích vzniká trocha kyslíkových radikálů, které poškodí DNA (zejména DNA v mitochondriích). V důsledku toho jsou pak i nově konstruované komplexy dýchacího řetězce méně funkční (syntetizují se podle mutované DNA) a tím více ROS vzniká při jejich činnosti . Tak jsme to přece rozlouskli, mohli si tehdy se zadostiučiněním říct teoretičtí biologové. Z jejich úvah totiž vyplývala i zajímavá představa, že organismus stárne podle toho, jak rychle dýchá (oxiduje živiny v mitochondriích). Každému je vymezeno určité množství potravy, které může za život spořádat. Když to udělá brzy, uvolní se kyslíkové radikály rychleji a stárnutí a smrt se dostaví dříve. Pokud příjem potravy naopak omezí, vydrží při životě déle.[2]
A jsme u toho! Před několika desetiletími vědci zajásali. Rýsoval se krásný bludný kruh stárnutí: Při rozkladu živin v mitochondriích vzniká trocha kyslíkových radikálů, které poškodí DNA (zejména DNA v mitochondriích). V důsledku toho jsou pak i nově konstruované komplexy dýchacího řetězce méně funkční (syntetizují se podle mutované DNA) a tím více ROS vzniká při jejich činnosti . Tak jsme to přece rozlouskli, mohli si tehdy se zadostiučiněním říct teoretičtí biologové. Z jejich úvah totiž vyplývala i zajímavá představa, že organismus stárne podle toho, jak rychle dýchá (oxiduje živiny v mitochondriích). Každému je vymezeno určité množství potravy, které může za život spořádat. Když to udělá brzy, uvolní se kyslíkové radikály rychleji a stárnutí a smrt se dostaví dříve. Pokud příjem potravy naopak omezí, vydrží při životě déle.[2]
Abychom plně docenili roli kyslíkových radikálů pro stárnutí, zmiňme ještě v rychlosti výsledky dalších zajímavých experimentů. Tak např. při srovnávací analýze širokého spektra organismů se ukázalo, že u dlouhověkých druhů bývají v tkáních zvýšené hladiny antioxidantů, tedy látek, které dokáží likvidovat kyslíkové radikály. Byl vytvořen i kmen myší, které ve svých mitochondriích vyráběly katalázu (jeden z antioxidačních enzymů), a tito hlodavci podle předpokladu skutečně žili déle.
Stárnutí lze tedy oddalovat snížením hladiny ROS a je jedno, jestli toho dosáhneme utlumením jejich produkce nebo působením antioxidantů. Zdálo by se, že tím to máme vyřešeno. Jíme méně čili odbouráváme pomaleji živiny a produkujeme méně kyslíkových radikálů. Naše DNA je uchráněna vzniku mutací a my žijeme déle a radostněji.
Když fakta odporují teorii...
Škoda že příroda není tak krásná jako naše teorie, které se ji snaží popsat. Výzkum základních předpokladů, na kterých zmíněná myšlenková konstrukce stojí, odhalil, že takhle to zkrátka nefunguje. Rychlost mitochondriální respirace rozhodně není přímo úměrná množství přijímané potravy. Naopak. U zvířat často pozorujeme, že kalorická restrikce výrazně navýší spotřebu kyslíku nebo alespoň obsahu mitochondrií. Takže rychleji dýchají právě organismy, které nemají nadbytek potravy. Podle klasické teorie by u nich tedy mělo vznikat i více ROS a měly by stárnout rychleji. Čili tudy cesta patrně nevede...
Leda bychom se ještě jednou zamysleli nad mechanismem vzniku kyslíkových radikálů. Výzkumníci zrevidovali své původní představy a navrhli alternativní mechanismus: ROS vznikají tehdy, pokud tok elektronů dýchacím řetězcem z nějakého důvodu vázne. Např. chybí kyslík jako konečný akceptor elektronů. Nebo ATP-syntáza nestíhá vyrovnávat koncentrace protonů na obou stranách membrány, a proto je blokováno další čerpání protonů dýchacím řetězcem. Nebo je zkrátka přítomno tak moc NADH a FADH2, že komplexy dýchacího řetězce prostě nestíhají. Elektrony pak unikají a umožňují vznik nebezpečných volných radikálů. Jak už bylo řečeno, pozorujeme při kalorické restrikci zvýšenou tvorbu mitochondrií. Máme tedy k dispozici větší kapacitu komplexů dýchacího řetězce a tok elektronů je plynulejší. Takže teorie o roli ROS při stárnutí organismu se zdá být zachráněna, ačkoliv se vztahem produkce radikálů a rychlosti respirace je to evidentně přesně obráceně, než jsme původně předpokládali.
Spalování tuku a kyslíkové radikály
Vztah mezi množstvím přijímané potravy a tvorbou ROS silně dráždí fantazii mnoha vědců. Proto máme k dispozici hned několik modelů usilujících o co nejelegantnější popis této závislosti. Jen malá ukázka:
Pokud máme jídla dostatek, zužitkováváme přímo především cukry, zatímco tuky si spíše ukládáme do zásoby. (To vám ostatně z vlastní zkušenosti potvrdí každý požitkář se sedavým zaměstnáním, a těch je mimochodem dostatek i mezi obezitology.) Pokud se ovšem příjem potravy sníží, musí být přímo spalovány i tuky. Při kalorické restrikci pochází tedy zvýšený podíl uvolněné energie ze spalování tuků. A jak už bylo řečeno, oxidací mastných kyselin se vytváří více FADH2 a méně NADH než při oxidaci cukrů. FADH2 pak předává své elektrony na komplex II. Tím je ovšem obcházen komplex I, který je považován za jedno z hlavních míst produkce ROS. Kalorická restrikce tedy podle této představy účinkuje skrze zvýšené spalování tuků, což relativně snižuje průtok elektronů komplexem I dýchacího řetězce, a tím pádem i produkci kyslíkových radikálů.
Pokud se ovšem tok elektronů vyhýbá komplexu I, je přečerpáno přes membránu méně protonů a ATP-syntáza zvládne vytvořit méně ATP. Proto podle některých vědců dochází při spalování tuků k zvýšené tvorbě mitochondrií. Úbytek v produkci ATP je třeba vyrovnat zvýšeným metabolickým obratem.
Trocha zdravé skepse
Pozorný čtenář se v tuto chvíli jistě už nedočkavě chystá vyrazit pro pořádnou dávku antioxidantů. Abychom poněkud zchladili jeho nadšení, prozraďme, že ne všichni vědci jsou myšlence radikálů jako hlavních faktorů stárnutí tak oddáni, jak by se mohlo zdát.
Přes uvedená významná zjištění o hladinách antioxidantů v tkáních různě dlouho žijících organismů se dosud nedaří prokázat, že by příznivé efekty vyvolávaly i antioxidanty podávané v potravě. Optimisté tvrdí, že za to může použití nesprávných antioxidantů. Pak by snad bylo v budoucnosti možné najít vhodnější látky, které by např. dokázaly vzdorovat trávicím šťávám a efektivněji se vstřebávaly. Možné je ale i to, že radikály prostě nejsou tak důležité, jak jsme doufali.
Skeptikům dále nahrávají výsledky studie na myších s upraveným genem pro DNA polymerázu gama.[3] Pozměněný enzym ztratil svou schopnost opravovat mutace v mitochondriální DNA. Podle očekávání začala tato zvířata stárnout dříve, protože se u nich mutace hromadily rychleji. Když však byl zkoumán počet mutací v závislosti na věku, ukázal se pouze lineární nárůst. Pozitivní zpětná vazba se zapojením ROS by přitom spíše působila exponenciální růst počtu mutací. Při následném měření obsahu ROS v tkáňové kultuře nebylo prokázáno žádné zvyšování produkce kyslíkových radikálů v závislosti na stáří buněk.
Působí tedy kyslíkové radikály stárnutí organismu? Na to s naprostou jistotou odpovědět nedokážeme. Řada vědců se však domnívá, že bychom jim ještě měli dát šanci. Nesmíme přece dopustit, aby pár pokusů pohřbilo celou nadějnou teorii.
O jedné zajímavé skupině enzymů
Opusťme teď na chvíli respirační řetězec a věnujme se zdánlivě odlišné problematice. Svou pozornost zaměříme na skupinu proteinů široce zastoupenou u mnoha eukaryotních organismů. Jde o zvláštní deacetylázy poprvé popsané u kvasinek pod názvem sirtuins. To je zkratkové slovo, které má odkazovat na jednu z jejich funkcí – regulaci umlčování genů (Silent Information Regulator Two (Sir2) proteins). Sirtuiny prostě odštěpují acetylové zbytky z různých jiných proteinů. Pokud jsou těmito jinými proteiny histony, na kterých je v jádře navinuta DNA, je výsledkem reakce zhutnění chromatinu, který přestává být přístupný transkripčním enzymům. Geny ležící v takovém místě DNA jsou tím pádem umlčeny.
Sirtuiny mezi deacetylázami vyčnívají díky neobvyklému reakčnímu mechanismu, který při deacetylaci používají. Pro odštěpení acetylu totiž vyžadují přítomnost oxidované formy NAD+. Tato látka je při reakci rozkládána a na jednu z jejích částí se naváže přebytečný acetyl. Při nedostatku NAD+ tedy enzym nemůže pracovat. Sirtuiny nedokáží pracovat ani s redukovanou formou elektronového přenašeče NADH. Proto tato skupina deacetyláz může sloužit jako citlivý senzor energetického stavu v buňce. Pokud je k dispozici dostatek živin a metabolismus pracuje na plné obrátky, vzniká velké množství NADH, které inhibují sirtuiny. Naopak pokud nevzniká dostatečné množství NADH nebo je veškerý NADH rychle převeden na NAD+ díky zvýšené aktivitě dýchacího řetězce, sirtuiny mohou nerušeně pracovat.
Co sirtuiny všechno umějí?
Takže jsme se dostali zpět k mitochondriím a respiračnímu řetězci. Čtenáři však stále dlužíme vysvětlení, proč jsme učinili takovou odbočku. Sirtuiny jsou totiž dalšími nadějnými hráči na poli prodlužování života. Vědci, kteří se zabývají kvasinkami, zjistili, že pokud jejich svěřenci produkují zvýšené množství těchto enzymů, žijí výrazně déle. Naopak pokud bylo kvasinkám v syntéze sirtuinů bráněno, umíraly mladé.1) A teď pozor! Když bylo těmto kvasinkám bez sirtuinů předloženo médium se sníženým obsahem glukózy, na délku jejich života to nemělo žádný vliv.[4] Kalorická restrikce u nich nefungovala. To ukazuje na skutečnost, že minimálně v případě kvasinek jsou sirtuiny naprosto nezbytné pro zprostředkování účinku hladovění na délku života.
Jak to celé může fungovat? U kvasinek byl vytvořen následující jednoduchý model: Omezený příjem potravy vede k poklesu hladiny NADH v buňce. Sirtuiny jsou tím pádem aktivovány a zuřivě deacetylují. Pustí se nejenom do histonů, ale i do celé řady dalších substrátů, které se pak dále podílejí na regulaci délky života.
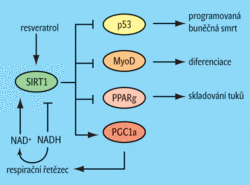
U savců (přesněji u laboratorních myší) je nejprostudovanějším a patrně nejdůležitějším enzymem ze skupiny sirtuinů SIRT1. K jeho substrátům patří takové proteiny jako p53 nebo MyoD, které jsou zapojeny do procesů programované buněčné smrti či diferenciace. Ale jsou tu další cesty, jakými může SIRT1 účinkovat. V bílé tukové tkáni SIRT1 interaguje s důležitým transkripčním faktorem PPAR gama a touto cestou pak brání syntéze proteinů nezbytných pro uskladnění tuků. Výsledek? Tuky jsou místo skladování odbourávány.[5] V tomto procesu může pomoci další významný faktor – transkripční koaktivátor PGC1 alfa.[6] Pokud tato bílkovina ztratí vlivem činnosti SIRT1 své acetylové skupiny, je nasměrována do jádra, kde pak řídí expresi celé řady genů důležitých pro tvorbu nových mitochondrií.
Vlivů je tedy více: SIRT1 brzdí programovanou buněčnou smrt i diferenciaci, mobilizuje zásoby tuků a umožňuje jejich účinnější spalování v nových mitochondriích. A větší počet mitochondrií produkuje méně kyslíkových radikálů. ROS a sirtuiny tedy mohou tvořit dva díly jedné skládačky.
Něco však ještě zbývá dořešit. Musíme rozhodnout, co je slepicí a co vejcem. Větší početmitochondrií rychleji spotřebovává NADH, čímž aktivuje SIRT1. A SIRT1 pak prostřednictvím PGC1 alfa podporuje další tvorbu mitochondrií, což teoreticky vede k další aktivaci SIRT1. A jsme lapeni v kruhu. Co je tedy prvotním hybatelem? SIRT1, nebo dýchací řetězec? Možná máme před sebou pozitivní zpětnou vazbu, která účinek kalorické restrikce umocňuje. A možná jsme se taky příliš upnuli k zavádějícím údajům. Kdo ví...
Alkoholický elixír a výhledy do budoucna
Nyní tedy tušíme, jak by sirtuiny mohly fungovat. Nadějné je však to, jak by se daly využít. Přibližují nás totiž k vysněnému elixíru dlouhověkosti, který by naše těla přesvědčil, že hladovíme, i kdyby to nebyla pravda. Víme, že sirtuiny svou činností mnohým organismům prodlužují život, a jsme přesvědčeni, že jsou aktivovány při hladovění. A také známe látky, které dokáží totéž. Zvýšit aktivitu SIRT1 lze např. podáním určitého množství resveratrolu, přírodní polyfenolické látky vyskytující se mj. v hroznové slupce a jadérkách.[7] Občas se tvrdí, že tato látka částečně vysvětluje i francouzský paradox, tedy skutečnost, že vzhledem k tomu, jak nevhodně se Francouzi stravují, umírají v poměrně vysokém věku. Spekuluje se, že pravidelný doušek vína vyváží lecjaký výživový poklesek.
S tímto tvrzením se ovšem dostáváme na neobyčejně tenký led. Je to samozřejmě spíše vědecký bonmot než ověřená skutečnost. Resveratrol se sice k nabuzení SIRT1 běžně používá i v laboratorních pokusech (a to bez ohledu na to, že vedle SIRT1 ovlivňuje pravděpodobně i řadu dalších enzymů), jeho účinná dávka je však poměrně vysoká. Kdybychom jí chtěli dosáhnout pouze konzumací vína, patrně bychom se dostali do vážných problémů s odbouráváním alkoholu.
Shrňme tedy, co po desetiletích experimentů víme o našem stárnutí. Už letmé přehlédnutí předchozích řádků nasvědčuje tomu, že domněnek, jak to celé funguje, máme dostatek. Prostor jsme dali jen několika z nich. Nesčetně jich bylo experimentálně vyvráceno nebo zásadně upraveno, další čekají na ověření. Z těch současných mohou být správné všechny, nebo taky žádná, protože věda je neuvěřitelně dynamická a na nic se v ní nemůžeme plně spolehnout. Jsou kyslíkové radikály hlavním zlem poškozujícím naši DNA? Stojí za zvýšeným obratem spalování živin SIRT1, nebo je aktivita tohoto enzymu druhotně spíše ovlivňována dýchacím řetězcem? Pomůže nám k dlouhému životu zelený čaj, červené víno, oboje, nebo ani jedno? Na jednoznačné odpovědi budeme ještě muset počkat. Významné je však nepochybně to, že můžeme otázky v této podobě formulovat. Takže srkejme dále své výluhy s antioxidanty či resveratrolové fermentáty, zmenšeme trošku své porce a za šedesát či osmdesát let si na tomto místě povíme, kam jsme se posunuli.
Literatura
[1] McCay C. M., Crowell M. F., Maynard L. A., J. Nutr. 10 (1935)
[2] Harman D., J. Gerontol. 11 (1956)
[3] Trifunovic A. et al., Proc. Natl. Acad. Sci. 102 (2005)
[4] Lin S. J. et al., Nature 418 (2002)
[5] Picard F. et al., Nature 429 (2004)
[6] Rodgers J. T. et al., Nature 434 (2005)
[7] Wood J. G. et al., Nature 430 (2004)
Poznámky
1) Délka života se u jednobuněčných organismů posuzuje většinou obtížně. Pučící kvasinky jsou výjimkou, protože u nich lze od sebe dobře odlišit mateřskou a dceřinou buňku. Délkou života kvasinky tedy rozumíme dobu, po kterou je mateřská buňka stále ještě schopná pučet.
Ke stažení
 článek ve formátu pdf [303,23 kB]
článek ve formátu pdf [303,23 kB]
O autorovi
Petr Zouhar
















