Padesát odstínů malých šedých buněk
| 4. 3. 2024Když se slavný detektiv Hercule Poirot s oblibou chlubil svými „malými šedými buňkami“, měl nutně jen mlhavou představu o tom, jak vlastně fungují. I když toho dnes o našich neuronech víme mnohem, mnohem víc, pořád to nestačí k tomu, abychom trvale a účinně vyléčili velkou část z jejich mnoha onemocnění.
Součástí světové komunity neurovědců, kteří se o to přesto snaží, je osm týmů z Fyziologického ústavu AV ČR a navzdory rozdílům v metodách i konkrétních tématech máme jedno společné: náš obor je stále mladý a praktické výsledky našeho snažení se nezískávají lehko. To hlavní, co neurovědci v uplynulých desetiletích svého výzkumu pochopili, je vlastně to, že lidský mozek je mnohem složitější, než si s pomocí lidského mozku zatím umíme představit.
Komplexnost komplikuje léčbu
Byť produktivita vývoje nových léků (měřeno počtem nově schválených léků v poměru k vynaloženým prostředkům) statisticky dlouhodobě klesá ve všech oblastech medicíny [1], v psychiatrii je riziko neúspěchu obzvláště vysoké, srovnatelné snad jen s náročným odvětvím onkologie. Zatímco však dnes lékaři umějí úspěšně léčit mnohé dříve neřešitelné onkologické případy, v psychiatrii žádný zázračný pokrok nenastal. Důvodů je jistě více, ale jedním z těch nejčastěji zmiňovaných je stále nedostatečná znalost podstaty psychických onemocnění a jejich komplexnost [2, 3]. Většina psychických nemocí, jako je deprese nebo schizofrenie, vzniká jako důsledek kombinace mnoha faktorů. Můžeme však ve světě umělé inteligence a začínajícího osidlování vesmíru ospravedlnit naši neschopnost vyléčit depresi pouze její komplexností? Na první pohled těžko.
Pochopení toho, jak psychická onemocnění vznikají a jak v mozku působí, ve skutečnosti v posledních desetiletích obrovsky pokročilo. V základním neurovědním výzkumu dnes máme k dispozici technologie, které nám u myší a dalších experimentálních zvířat umožňují zapínat a vypínat jednotlivé nervové okruhy podle potřeby. Videa myší, které se po aktivaci příslušných neuronů začnou prát s gumovou rukavicí nebo se krmí „na povel“, obletěla svět již před deseti lety [4, 5]. Avšak kupodivu ani podrobné zmapování nervových okruhů a jejich funkce v experimentální medicíně zatím nepřineslo žádný velký průlom ve farmaceutickém výzkumu. Léky používané v psychiatrii mění v mozku hladiny neurotransmiterů, jako je dopamin, serotonin nebo acetylcholin, nebo se vážou na jejich receptory. Ale zatímco přirozené neurotransmitery a jejich receptory dokážou aktivovat konkrétní nervové okruhy podle potřeby, zvenčí podané léčivo tuto schopnost nemá: bude aktivovat či tlumit všechny receptory svého druhu, bez ohledu na to, na jakém nervovém okruhu či druhu neuronu se nacházejí. Přitom v posledních letech se díky rozvoji technik molekulární biologie stále více potvrzuje, co vědci už dlouho tušili: že naše „malé šedé buňky“ jsou ve skutečnosti velice různobarevné a vůbec není jedno, které z nich aktivujeme nebo tlumíme.
Barevné, nikoli šedé neurony
Už slavný španělský histolog Santiago Ramón y Cajal na počátku 20. století dobře věděl, že neurony v lidském mozku nejsou všechny stejné a že se liší tvarem i způsobem větvení. Další podoby rozmanitosti malých šedých buněk se začaly objevovat spolu s tím, jak se vyvíjely technické možnosti neurovědců: možnost měřit elektrické potenciály v živé tkáni ukázala, že různé neurony mají svůj specifický rytmus, ve kterém vysílají signály. Pak byla objevena biochemická identita neuronů, které se liší nejen neurotransmitery, ale i dalšími specifickými molekulami. Neurony se dále rozdělily podle toho, do jakých částí mozku vysílají své výběžky, pomocí kterých komunikují. A nejnověji do klasifikace neuronů zasáhla bioinformatická analýza, která je dokáže rozdělit do skupin na základě podobností a rozdílů v genové expresi.
Tupé nástroje v našem mozku
Pokud tedy uvážíme obrovskou rozmanitost a zároveň složité propojení neuronů v lidském mozku, je vlastně překvapivé, že naše léčba psychických onemocnění dokáže pomoci alespoň někomu. Jak napsal Samuel Barondes, emeritní profesor Kalifornské univerzity v San Francisku a autor populárních knih o biologických základech psychiatrie: „Dokonce i ta nejlepší antidepresiva jsou jenom tupé nástroje. V mozku mají velké množství různých účinků, z nichž pouze některé jsou terapeutické.“ [6]
Většina léků používaných v psychiatrii působí nespecificky na velké množství receptorů a dalších molekul, z nichž mnohé ani neznáme. Výsledný účinek na psychiku je tak dán mnoha různými faktory a je prakticky nemožné ho u konkrétního člověka předvídat.
Musíme se ale smířit s tím, že mozek je příliš komplikovaný, nástroje léčby příliš tupé a účinek léčby do značné míry dílem náhody?
Velký účinek malého receptoru
Zatímco někteří vědci z oboru hovoří o tom, že naše poznání duševních onemocnění je dosud v „zárodečném“ stadiu [2], neustále pokračují snahy detailně popsat i ty nejmenší části lidského mozku, jejich vzájemné vztahy a funkce. Jen vzhledem k pouhému počtu všech částí (90 miliard neuronů různých druhů, 7000 synapsí různých druhů na jediném neuronu a až několik milionů proteinů různých druhů v jediné synapsi) [7, 8] se jedná o nadlidský úkol. Možná že právě to k němu neurovědce tak přitahuje.
V našem týmu ve Fyziologickém ústavu AV ČR nyní studujeme alfa4beta2 nikotinový receptor – jeden konkrétní druh nikotinového receptoru, tedy jednoho z těch, které zprostředkovávají příjemné i nebezpečné účinky nikotinu. Zajímá nás, ve kterých typech neuronů se tento receptor nachází, do jakých svých synapsí ho neurony směrují, jak rychle ho v nich odbourávají a obnovují a především to, jakou má v různých neuronech funkci.
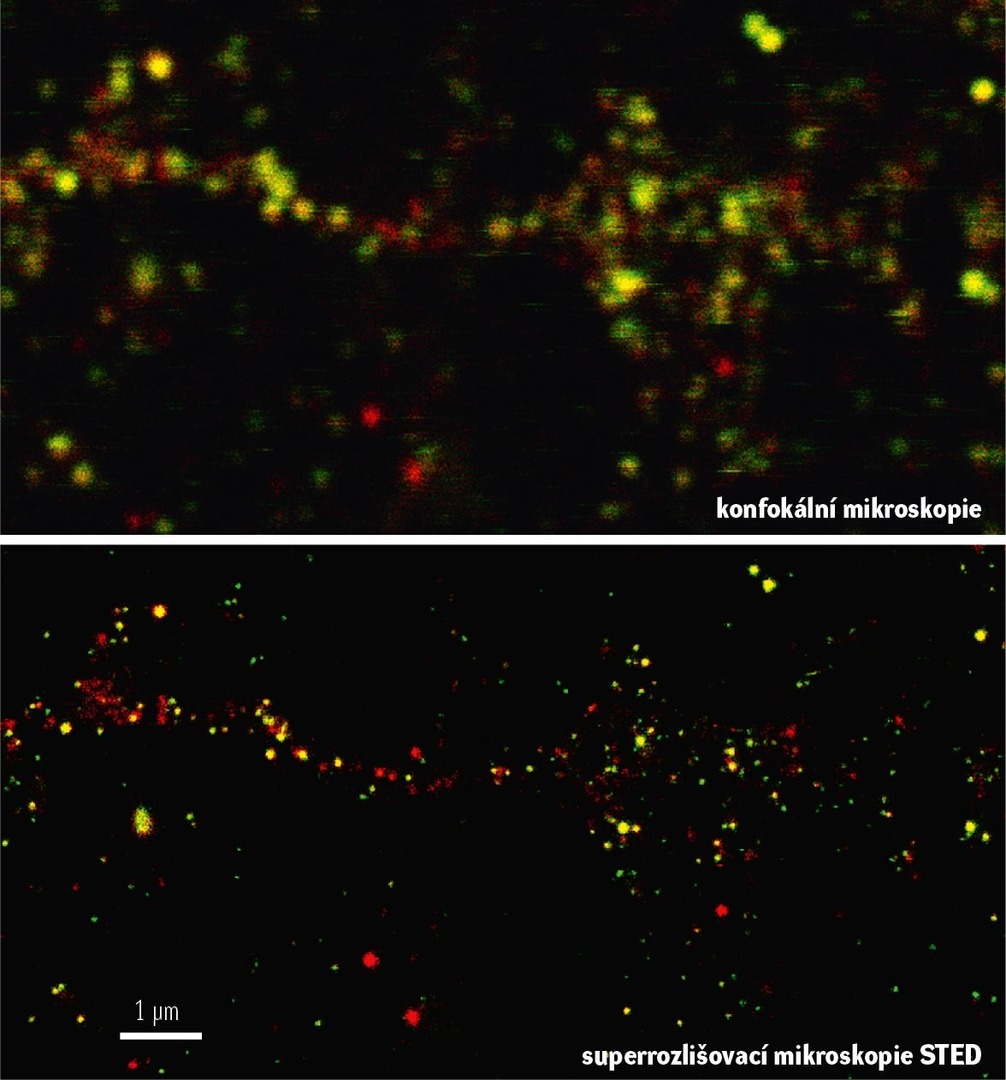
Ve většině oblastí mozku jsou nikotinové receptory velmi běžné. Ovšem v jedné specifické struktuře, tzv. striatu, které řídí naše pohyby a je pod velkým vlivem neurotransmiteru dopaminu, se překvapivě na místních neuronech nikotinové receptory téměř nevyskytují. Jak jsme ukázali v nedávné studii [9], v nejběžnějším typu striatálních neuronů (který tvoří 95 % všech neuronů ve striatu) nikotinové receptory vůbec nejsou a ze vzácnějších typů, které tvoří zbývajících 5 %, je má jenom sem tam některý. Hned na začátku jsme si proto položili otázku: má i takto malá skupina receptorů šanci ovlivnit aktivitu okolních neuronů a vyvolat změny v chování celého organismu? Pod „organismem“ si prosím představte laboratorní myš. Genetické odstranění studovaného nikotinového receptoru z toho malého počtu neuronů, které ho ve striatu původně měly, stačilo k tomu, aby se zvýšila celková aktivita všech okolních neuronů (tedy těch, které samy tento receptor nikdy neměly). Zároveň myšky s příslušnou genetickou úpravou také v průměru změnily svoje chování: oproti kontrolním sourozencům projevovaly větší strach z neznámého prostředí, byly citlivější na stimulační účinky drogy amfetaminu a místo přirozeného zájmu o neznámého myšího soukmenovce se raději zabývaly průzkumem rovněž nového, ale neživého předmětu.
Jestliže i tak málo receptorů v konkrétním typu neuronů může takto významně ovlivnit celý organismus, pak je namístě otázka, zda mají stejné receptory přítomné v různých druzích neuronů stejné nebo různé účinky. Abychom to zjistili, tentokrát jsme geneticky odstranili nikotinový receptor ze dvou různých neuronových populací v prefrontální kůře, části mozku zodpovědné za sociální chování, pozornost a emoce. Jakkoli si na finální odpověď musíme ještě chvíli počkat, už nyní víme, že dobře mířené odstranění nikotinových receptorů v prefrontální kůře udělá s myškami divy: z průměrných myší se mohou stát nebojácní a kamarádští jedinci, kteří se beze strachu vydají do neznámých prostor a ochotně se seznamují s každým novým jedincem svého druhu. Důležité je tu slovo „mohou“. Ne v každé myší skupině je účinek stejný a výsledný efekt závisí zřejmě na dalších proměnných, jejichž vliv teprve začínáme odkrývat.
Pomalé, drahé, vzrušující
V každodenním provozu v laboratoři to člověk nevnímá, ale stačí o výzkumu někomu vyprávět a zdánlivá marnost našeho počínání vypluje na povrch: několik let usilovné práce, abychom částečně rozkryli účinky jednoho podtypu receptoru v několika typech neuronů ve dvou různých mozkových strukturách?
Základní výzkum je skutečně pomalý, drahý a člověku čekajícímu na lék se nutně zdá spíš nevděčný než vzrušující. Ale když uvážíme komplexnost (nejen) lidského mozku a jeho mnoha onemocnění, není se vlastně čemu divit. I v neurovědním výzkumu může do hry vstoupit šťastná náhoda, která nás přivede k účinnému léku třeba proti Alzheimerově chorobě, podobně jako Alexander Fleming díky kontaminaci jedné z bakteriálních ploten objevil penicilin. Abychom význam takové náhody rozpoznali a nový lék nehodili do koše v domnění, že je to bezcenný omyl, je v neurovědách potřeba kombinovat mravenčí práci, nové technologie, sběr a analýzu velkých dat a úsilí lidského mozku, kterému především zvědavost, znalosti a zkušenost umožní rozpoznat skryté zákonitosti v sobě samém.
Literatura
[1] Scannell J. W. et al.: Diagnosing the decline in pharmaceutical R&D efficiency. Nat. Rev. Drug Discov. 11, 191–200, 2012, DOI: 10.1038/nrd3681.
[2] Blackburn T. P.: Depressive disorders: Treatment failures and poor prognosis over the last 50 years. Pharmacol Res Perspect. 7, e00472, 2019, DOI: 10.1002/prp2.472.
[3] Zhu T.: Challenges of Psychiatry Drug Development and the Role of Human Pharmacology Models in Early Development – A Drug Developer‘s Perspective. Front. Psychiatry 11, 562660, 2021, DOI: 10.3389/fpsyt.2020.562660.
[4] Gaidos S.: Aggression Avenue: Tracing how the brain is wired for violence. Science News 187, 6, 2015.
[5] Jennings J. H. et al.: The Inhibitory Circuit Architecture of the Lateral Hypothalamus Orchestrates Feeding. Science 341, 1517–1521, 2013, DOI: 10.1126/science.1241812.
[6] Barondes S.: Better than Prozac, Creating the next Generation of Psychiatric drugs. New York: Oxford University Press, 2003, ISBN 978-0-19-515130-5.
[8] Grant S. G. N., Fransen E.: The Synapse Diversity Dilemma: Molecular Heterogeneity Confounds Studies of Synapse Function. Front. Synaptic Neurosci. 12, 590403, 2020, DOI: 10.3389/fnsyn.2020.590403.
[9] Abbondanza A. et al.: Nicotinic acetylcholine receptors expressed by striatal interneurons inhibit striatal activity and control striatal-dependent behaviors. J. Neurosci. 42, 2786–2803, 2022, DOI: 10.1523/JNEUROSCI.1627-21.2022.
Ke stažení
 článek ve formátu pdf [589,64 kB]
článek ve formátu pdf [589,64 kB]
O autorovi
Helena Janíčková