Epitranskriptom: klíč ke zdravému srdci?
| 4. 3. 2024Kardiovaskulární onemocnění jsou celosvětově nejčastější příčinou úmrtí.1) V Oddělení vývojové kardiologie ve Fyziologickém ústavu AV ČR se dlouhodobě věnujeme studiu srdce a jeho patologií ve snaze přispět ke snížení vysoké morbidity a mortality těchto onemocnění. Zajímá nás role epitranskriptomu (souboru epigenetických modifikací RNA) ve vývoji srdce a rozvoji vrozených srdečních vad, úloha v patogenezi ischemické choroby srdeční, ale také jeho funkce v ochraně srdce.
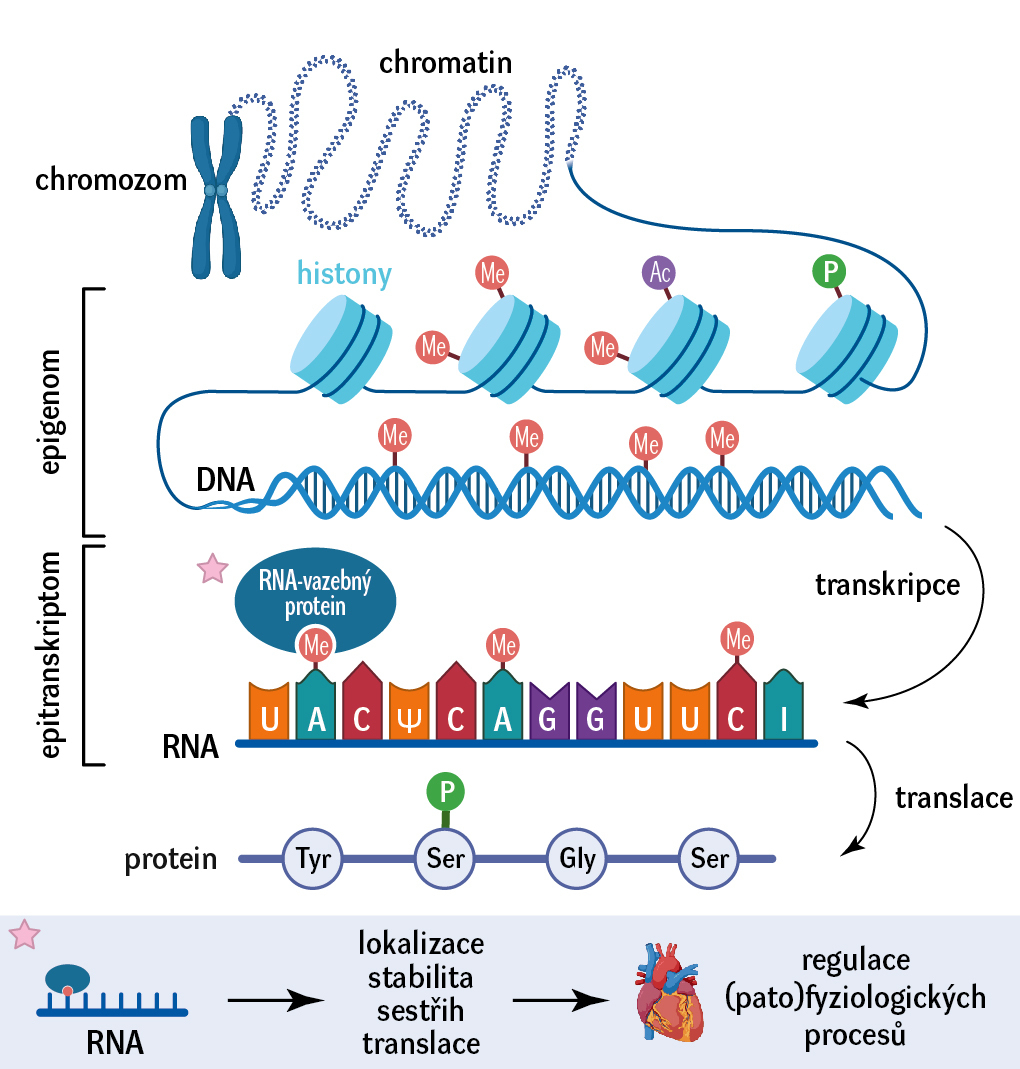
Abychom pochopili, co je to epitranskriptom, musíme si nejprve připomenout, jak v buňce vznikají proteiny. Představme si buněčné jádro jako centrální knihovnu, v níž jsou uloženy návody k tvorbě všech proteinů buňky. Knihám v této knihovně se obecně říká DNA, manuál pro tvorbu konkrétního proteinu se označuje jako gen. Z knihovny však není možné odnášet žádné knihy, a informaci uloženou v genu je tedy potřeba nějak dopravit do cytoplazmy, což je továrna buňky, kde probíhá výroba proteinů. Obsah genu se proto nejprve musí přepsat do molekuly mRNA (messenger RNA), která slouží jako poslíček mezi buněčným jádrem a cytoplazmou. Tento proces se nazývá transkripce (přepis). Podle mRNA pak v cytoplazmě buněční dělníci (ribozomy) skládají protein, což je označováno jako translace (překlad). Souhrnně potom mluvíme o genové expresi. Jedná se o dynamický proces, který je pro fungování buněk zcela klíčový a jehož narušení může mít pro organismus fatální důsledky.
Jedním z mechanismů, jak může být genová exprese regulována, jsou epigenetické modifikace (obr. 1). Jedná se o chemické značky (často jde o metylovou skupinu), které mohou být navázané na DNA, na histony (proteiny, na kterých je DNA v jádře navázaná – v podstatě regály knihovny) nebo právě na mRNA. Soubor všech modifikací DNA a histonů přítomných v buňce se nazývá epigenom, soubor všech modifikací RNA se označuje jako epitranskriptom. Tyto změny mohou být dědičné, významně je však ovlivňují také vnější faktory, jako například prostředí či životní styl.
Epitranskriptomické modifikace
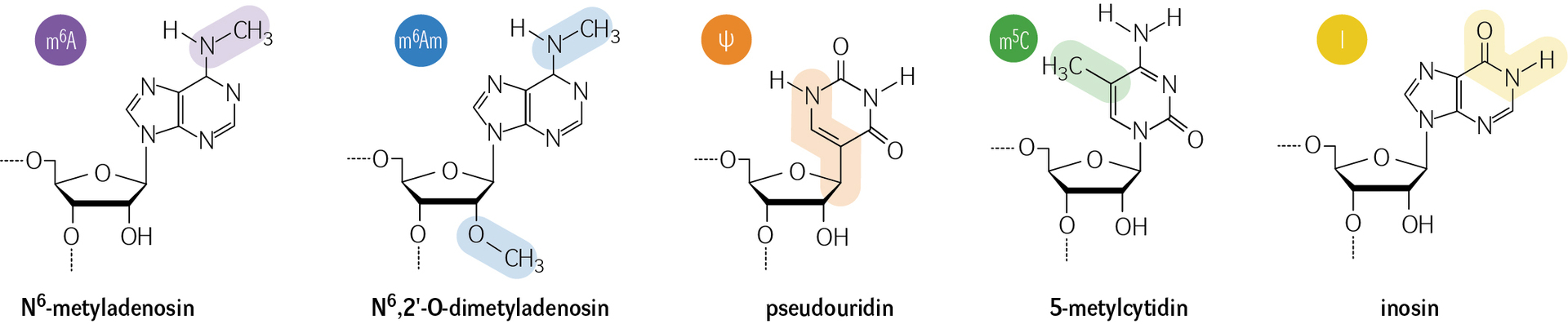
Existuje velké množství epitranskriptomických modifikací (obr. 2), které plní v buňkách různorodé funkce. Tyto úpravy molekul RNA mohou být přirovnány k dopravním značkám lemujícím silnice. Zatímco dopravní značky podávají instrukce řidičům aut, a regulují tak provoz na silnicích, RNA modifikace poskytují specifické signály pro RNA-vazebné proteiny, a ovlivňují tak genovou expresi. Stejně jako dopravní značka „zákaz vjezdu“ může zamezit autům vjet na určitou silnici, konkrétní modifikace RNA může zablokovat interakci RNA s RNA-vazebnými proteiny a zamezit třeba právě tvorbě proteinu.
Enzymy, které jsou zodpovědné za epitranskriptomické regulace, se dělí do tří skupin. Writery RNA modifikují, readery se na modifikovanou RNA vážou, a tak zprostředkovávají její biologické funkce, a erasery modifikaci z RNA odstraňují.
Studium modifikací RNA se datuje do poloviny 20. století, kdy vědci poprvé identifikovali chemické změny v nukleotidech RNA. V osmdesátých a devadesátých letech si začali uvědomovat, že tyto modifikace RNA nejsou náhodné, ale mají specifické funkce. Přelomovým objevem byla v roce 2011 identifikace proteinu FTO (Fat Mass and Obesity-Associated protein). Jednalo se o první popsanou RNA demetylázu schopnou odstranit metylovou skupinu z N6-metyladenosinu (m6A) v RNA. Tím byla odhalena dynamická povaha této dlouho známé všudypřítomné RNA modifikace a naznačena její funkční role v regulaci osudu RNA.
S pokračujícím odhalováním modifikací RNA jsou identifikovány další regulační proteiny, čímž se funkční význam modifikací RNA stává zřejmější. Nyní víme, že epitranskriptomické regulace hrají klíčovou roli v různých molekulárních procesech (včetně sestřihu mRNA, její lokalizace, degradace či translace), a ovlivňují tak fyziologii buňky a její odpověď na stres. Modifikace RNA se vyskytují napříč druhovým spektrem, což naznačuje, že jsou to evolučně konzervované mechanismy řídící genovou expresi v reakci na vnější podněty. Dysregulace epitranskriptomických modifikací je spojena s řadou chorob, včetně kardiovaskulárních onemocnění, rakoviny, neurologických poruch a virových infekcí. Epitranskriptomika je rychle rozvíjejícím se oborem s terapeutickým potenciálem pro léčbu výše zmíněných onemocnění.
Rozvoj vrozených srdečních vad
Epitranskriptomické regulace jsou klíčové pro správný vývoj srdce. Hrají roli v přeměně kmenových buněk v kardiomyocyty (diferenciaci) a následně i v buněčném dělení kardiomyocytů (proliferaci). Není proto překvapivé, že narušení těchto regulací během embryonálního či fetálního vývoje může vést ke vzniku vrozených srdečních vad. Ty patří mezi nejběžnější vývojové vady, které jsou zároveň nejčastější příčinou úmrtí v prenatálním období a v prvním roce života.
U jedné palestinské rodiny byla nedávno objevena mutace v genu FTO, která vedla k nefunkčnosti tohoto enzymu. Děti s touto mutací se rodily s různými srdečními defekty a umíraly během prvních tří let života. Jednou z vrozených srdečních vad způsobených touto mutací byla např. otevřená Botallova dučej (ductus arteriosus patens). Jedná se o cévu, která slouží jako „objížďka plic“ v krevním oběhu plodu (v děloze nejsou plíce potřeba) a která se uzavírá krátce po porodu. Její neuzavření může v závislosti na velikosti zkratu vyústit až v srdeční selhání. Kromě této mutace byly vrozené srdeční vady, včetně otevřené Botallovy dučeje, asociovány i s mutacemi v genu kódujícím protein HNRNPA1, který se na m6A-modifikovanou RNA váže. Mimo m6A byl popsán také vliv dalších modifikací a regulátorů na vrozené srdeční vady, například pseudouridinu (mutace v genu PUS3), 5-metylcytidinu (mutace v genech NSUN2 a NSUN3) nebo inosinu (mutace v genu ADAR1). Jakou přesně mají epitranskriptomické modifikace úlohu ve vzniku těchto vad, ale zatím nevíme.
Ischemická choroba srdeční
Podle WHO je ischemická choroba srdeční, zahrnující infarkt myokardu, celosvětově nejběžnější příčinou úmrtí. Nejnovější studie ukázaly, že v srdeční oblasti, která byla zasažena infarktem, dochází ke snižování hladin demetylázy FTO a s tím souvisejícímu zvýšení hladin m6A. Změny v hladinách této modifikace v srdci přitom přispívají k progresi srdečního selhání ovlivněním translace (buněčné výroby proteinů). Zvýšení exprese FTO potom zmírňuje rozvoj srdečního selhání regulací metabolismu glukózy. Dysregulace epitranskriptomické mašinerie tedy může výrazně ovlivňovat osud srdce. Na základě těchto znalostí mohou být vyvinuty nové terapeutické strategie cílící na klíčové regulátory (např. FTO), které by mohly snížit vysokou morbiditu a mortalitu srdečních onemocnění.
Zvýšení odolnosti srdce
Pozitivní zpráva je, že si svůj epitranskriptom můžeme sami ovlivnit a před nemocemi (nejen) srdce se tak chránit. Ke změnám na epitranskriptomické úrovni totiž v srdci dochází například při adaptaci na chronickou hypoxii (nedostatek kyslíku), krátkodobém hladovění či fyzické aktivitě, které mají ochranné účinky.
Adaptace organismu na hypoxii je jev běžný třeba ve vysokých nadmořských výškách. Kardioprotektivní účinek chronické hypoxie je znám již od padesátých let 20. století. Tehdy byl u skupiny peruánských obyvatel And pozorován nižší výskyt infarktu myokardu než u lidí žijících blíže hladiny moře. Následné experimenty skutečně ukázaly, že po adaptaci na chronickou hypoxii je myokard odolnější ke všem projevům akutního nedostatku kyslíku. Tento jev je typický také pro novorozence, protože plod je de facto rovněž adaptován na hypoxii. Parciální tlak kyslíku v děloze totiž odpovídá pobytu ve výšce přibližně 8 tisíc metrů, jedná se tedy o „Mount Everest in utero“.
V naší laboratoři jsme přišli na to, že adaptace na chronickou hypoxii vede ke změnám hladin epitranskriptomických regulátorů v srdeční tkáni, včetně zmiňované demetylázy FTO, jejíž množství se za těchto podmínek zvyšuje. Množí se přitom důkazy o tom, že právě tento enzym může srdce ochraňovat před poškozením akutním nedostatkem kyslíku (jev běžný při neprokrvení srdce během infarktu). Podobný blahodárný efekt na srdce má kromě chronické hypoxie i krátkodobé hladovění. Tímto tématem se zabývá naše recentní publikace v časopise RNA Biology.2) Hladovění snižuje úroveň metylace RNA v srdci a ovlivňuje i mašinerii epitranskriptomických regulačních proteinů včetně FTO. Podobný účinek má také střídavé hladovění.
Už dlouho je známo, že fyzická aktivita je zdravá pro srdce. Až v poslední době ale začíná vycházet najevo, že i zde mají své slovo epitranskriptomické regulace. Stejně jako u hladovění dochází i při tréninku k změnám hladin metylace RNA v srdci. Epitranskriptomika tedy může být jedním z klíčů ke zdraví našeho srdce.
Ke stažení
 článek ve formátu pdf [625,85 kB]
článek ve formátu pdf [625,85 kB]