Siderofory a mikrobiální patogeny
Bakterie a některé jiné organismy si evolučně vyvinuly mechanismus získávání železa, které je kriticky důležitým prvkem pro jejich růst, ze svého okolí, a to produkcí sideroforů – látek, které železo z okolí „vydolují“. Zároveň jsou siderofory velmi důležité i pro přežití choroboplodných bakterií a hub v lidském organismu, a proto je jejich detekce významná pro posouzení potenciálu patogenity takových mikroorganismů.
Každý živý organismus potřebuje železo, protože ionty tohoto v přírodě široce rozšířeného kovu mají velmi užitečné vlastnosti (koordinační, a hlavně redoxní). Příroda je proto použila v mnoha metaloproteinech nutných k metabolismu. Problémem nebývá, že by železa v prostředí bylo málo, větší potíž představuje jeho malá biologická dostupnost, která je daná především obecně špatnou rozpustností jeho kyslíkatých sloučenin. Proto si řada organismů, především bakterie (ale také některé houby a rostliny), vyvinuly schopnost produkovat a do svého okolí uvolňovat látky, které z okolí „vydolují“ železo v jeho nejběžnější trojmocné formě. Vzniklý železitý komplex je příslušnou bakterií vstřebán, uvnitř její buňky je rozložen a železo je následně použito pro konstrukci metaloproteinů. Těmto produkovaným nízkomolekulárním látkám se říká siderofory (řecky „nosiče železa“) a jejich tvorbu si organismus reguluje podle toho, jaký má aktuálně (ne)dostatek železa. Většina aerobních a fakultativně (příležitostně) anaerobních mikroorganismů syntetizuje alespoň jeden siderofor, protože železo je v přítomnosti kyslíku méně dostupné – rozpustnost železitých sloučenin je oproti železnatým menší.
Zajímavé je, že nejen nedostatek, ale i nadbytek železa může být pro člověka velmi nebezpečný. Takový nadbytek může například vzniknout v důsledku poměrně častého dědičného onemocnění hemochromatózy, kdy organismus kvůli poruše jednoho z regulačních genů ztratí kontrolu nad příjmem železa. Neřízený příjem železa pak vede k postupné intoxikaci, která následně poškodí játra a další orgány. Obvyklým způsobem léčby je flebotomie – „pouštění žilou“ – dnes samozřejmě prováděná na transfuzní stanici. S krevním hemoglobinem odchází z těla i přebytečné železo. V řadě případů je ale nezbytné přistoupit i k farmakologické léčbě pomocí látek schopných železo na sebe pevně navázat (chelátorů železa). Prvním skutečně účinným a dodnes široce užívaným lékem na hemochromatózu je bakteriální siderofor deferoxamin, produkovaný bakterií Streptomyces pilosus, izolovanou původně z hlíny nakopané v Římě. Lidský organismus není (na rozdíl od bakterie) schopný železitý komplex deferoxaminu rozložit a železo z něj zpětně získat, takže je z těla následně vyloučen. Konstanta stability (odolnost vůči rozpadu) železitého komplexu s deferoxaminem je skutečně úctyhodná, více než 1030.
„…klíčovou schopností patogenní bakterie pro přežití v organismu je schopnost ukořistit pro sebe železo i v prostředí, kde je jeho biologická dostupnost malá…“
V lidském organismu je volného železa minimum, je kompletně vázáno na proteiny a i jeho transport krví probíhá ve formě železitého komplexu s proteinem transferinem. Je to proto, že volné ionty železa mohou být toxické tvorbou reaktivních forem kyslíku, které pak poškozují tkáně. Proto je klíčovou schopností patogenní bakterie pro přežití v organismu schopnost ukořistit pro sebe železo i v prostředí, kde je jeho biologická dostupnost malá, a hlavním nástrojem je právě tvorba sideroforů. Produkce bakteriosideroforů je tedy považována za jeden z nejdůležitějších faktorů patogenity, což činí jejich detekci velmi důležitou v diagnostice chorob bakteriálních a houbových infekcí.
Chemická struktura sideroforů se velmi liší, a proto není přímá analytika pro diagnostiku jednoduchá – vyžaduje standardy mnoha různých látek. Systém, který by byl schopen rychle a snadno detekovat produkci látky obecně schopné selektivně pevně vázat (chelatovat) železo, aniž by nutně znal strukturu konkrétního produkovaného sideroforu (obr. 2), by byl pro diagnostiku velmi cenný.
Kyselina fytová (též fytát)1) je v rostlinách hojná, zejména v jejich semenech a zrnech. Asi 60–90 % veškerého organického fosforu v rostlinách je přítomno jako fytin (smíšený vápenato-hořečnatý komplex fytové kyseliny). Fytát se také nachází v krvi, kde hraje důležitou roli při regulaci transportu kyslíku v lidské krvi jako kofaktor hemoglobinu. Bohatá přítomnost fytátu v biologických systémech zaručuje jeho vysokou biokompatibilitu. Lékařské zkušenosti s klinickým používáním nanočástic fytátu vápenatého ve formě značené radionuklidem 99mTc prokazují, že tento materiál není toxický.
Fytát má vysokou kationtovou vazebnou kapacitu díky negativně nabitým fosfátovým skupinám; pevně váže (chelatuje) vícemocné kationty kovů, jako jsou Zn2+, Fe2+, Fe3+, Ca2+, Mg2+, Mn2+ a Cu2+, a brání jejich absorpci v trávicím traktu (právě proto je častým problémem vegetariánů deficit těchto kovů, ačkoliv jinak jich čistě rostlinná strava neobsahuje málo). Nakonec i pro výživovou hodnotu piva je důležitá aktivita fytázy v klíčícím sladu, která mobilizuje tyto mikrobiogenní prvky z fytátových rezervních depozit zrn obilí.
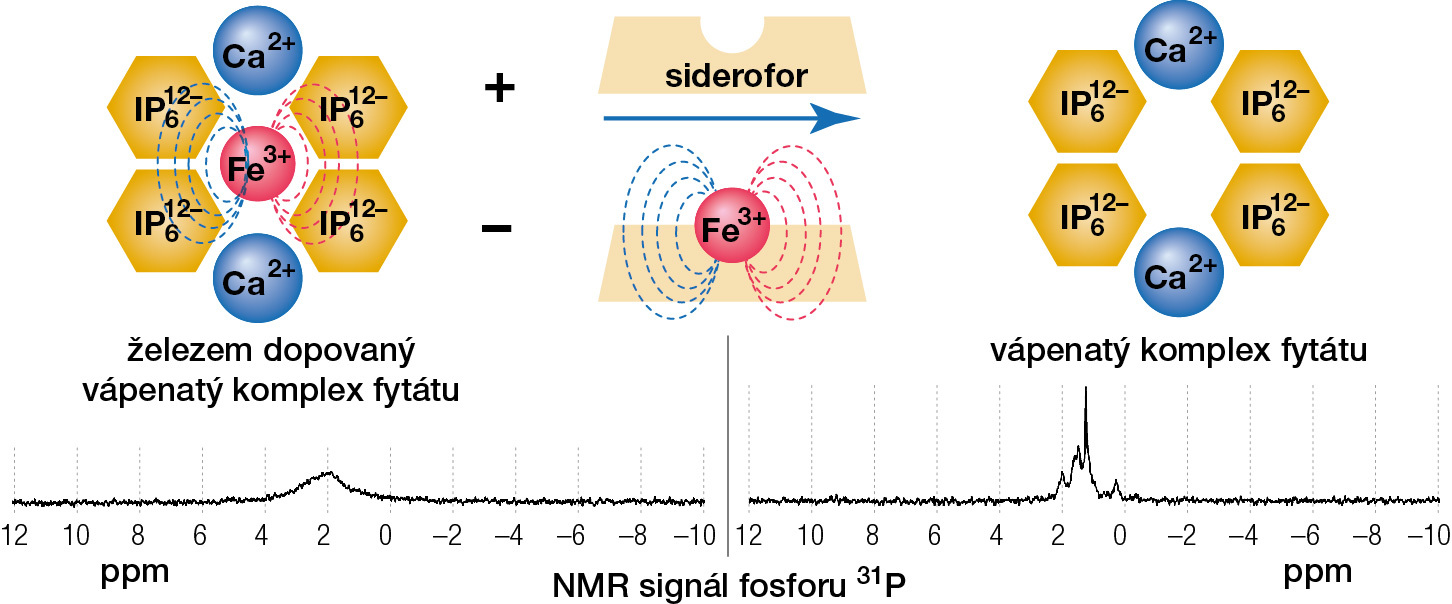
Paramagnetické ionty jako Fe3+ v těsné blízkosti jádra fosforu 31P významně ovlivňují jeho signál v nukleární magnetické rezonanci (NMR) – tyto dva magnety se skrze své magnetické pole dobře „vidí“. Interakce jader fosforu s nepárovými elektrony paramagnetického iontu železa může posunout a rozšířit signál magnetické rezonance 31P do takové míry, že signál může být ztracen v šumu, a to i při vysokém rozlišení a relativně nízké koncentraci paramagnetických iontů.
Právě na základě tohoto efektu jsme vyvinuli koncepčně novou sondu založenou na nanočásticích fytátu vápenatého pro in vitro monitorování přítomnosti sideroforů v prostředí. Vyhodnocení probíhá na NMR spektrometru (příklad takového přístroje je na obr. 1). Když jsou tyto nanočástice dopovány ionty Fe3+, jsou v měřeném prostředí ve „vypnutém“ režimu, jejich „fosforový“ signál v jaderné magnetické rezonanci (NMR) je tak rozšířen, že je téměř neviditelný. Jestliže se však v měřeném prostředí nacházely mikroorganismy produkující siderofory, došlo k selektivnímu vyčerpání iontů železa z těchto nanočástic, což vede k obnově signálu fosforu v NMR (k „zapnutí“ signálu nanočástic). Integrita nanočástic fytátu vápenatého je zachována, a proto obnovený NMR signál fosforu 31P detekuje obecnou přítomnost sideroforu, a tedy přítomnost potenciálně patogenních (siderofor produkujících) bakterií v těsné blízkosti nanočástic, což je důležitá informace. Podstatnou roli zde také hraje velikost částic, čím menší jsou částice, tím mají větší specifický povrch, a tím je každá jejich interakce rychlejší. Princip byl úspěšně demonstrován právě na deferoxaminu.
Autoři děkují za finanční podporu Strategii Akademie věd České republiky AV21 (program RP10-Molekuly a materiály pro život) a Grantové agentuře České republiky (grant č. 19-01438S).
Poznámky
1) Systematické jméno kyseliny fytové (fytátu) je myo-inositol-1,2,3,4,5,6-hexakisfosfát.
Ke stažení
 článek ve formátu pdf [489,42 kB]
článek ve formátu pdf [489,42 kB]
O autorovi
Martin Hrubý