Proč DNA obsahuje právě báze nukleových kyselin?
Díky své schopnosti uchovávat a přenášet genetickou informaci patří deoxyribonukleová kyselina mezi nejvýznamnější biomakromolekuly. R. 1869 ji identifikoval Friedrich Miescher jako molekulu a r. 1944 Oswald T. Avery s kolegy zjistil, že přenáší genetickou informaci. Její strukturu prozkoumali r. 1953 Francis Crick a James Watson, kteří ukázali, že tvoří dvoušroubovici umožňující párování bází. Ti také předpověděli, že jedno vlákno slouží jako předloha, podle níž se během zdvojování syntetizuje druhé vlákno, přičemž se adenin páruje vždy s thyminem a cytosin vždy s guaninem (viz rámeček Deoxyribonukleová kyselina 2 ). Tato hypotéza byla potvrzena r. 1958 objevem DNA-polymerázy, tj. enzymu, který syntetizuje doplňující protějšek. Za svůj objev získali Crick a Watson spolu s Mauricem H. F. Wilkinsem r. 1962 Nobelovu cenu.
Následujících padesát let přineslo mnoho objevů o struktuře a funkci DNA. Zdálo by se, že už nelze objevit nic nového. Když se však zamyslíme hlouběji nad složením a strukturou DNA, překvapivě dojdeme k dvěma otázkám:
Dvě klíčová „proč?“
- Proč si evoluce „vybrala“ právě báze nukleových kyselin? Otevřeme-li kteroukoli učebnici biochemie či molekulární biologie, dočteme se, že DNA obsahuje čtyři báze nukleových kyselin. Nevíme, proč jsou to právě tyto báze a ne jiné molekuly z obrovského souboru systémů, které existovaly v minulosti. Je tím důvodem komplementarita, která je tolik důležitá pro přenos genetické informace? To asi ne, vždyť vzájemně se doplňujících (komplementárních) párů dvou molekul nalezneme nepřeberně. Je tedy příčinou energetická stabilizace párů, 1) která zajišťuje stabilitu dvoušroubovice? Opět to můžeme vyvrátit. Stabilita DNA totiž není dána výlučně existencí vodíkových vazeb v párech, ale také patrovými interakcemi mezi sousedními bázemi na jednom vlákně šroubovice. A srovnatelných nebo silnějších patrových interakcí známe velmi mnoho.
- Proč evoluce „používá“ právě jen Watsonovo a Crickovo uspořádání? V páru adenin-thymin není Watsonovo a Crickovo upořádání energeticky nejstabilnější a existují jiné struktury páru, které jsou energeticky mnohem výhodnější. Ani na tuto otázku nenajdeme v žádné učebnici odpověď.
Teprve nedávno se objevila teorie, podle které je řešení obou problémů možné hledat ve fotochemii bází a párů nukleových kyselin za podmínek, jaké existovaly při vzniku života, tedy v době před dvěma až třemi miliardami let.
Jak tenkrát Země vypadala?
Kyslíková atmosféra už existovala, ale nebyla tak vydatná. Nestačila však ještě vzniknout ozonová vrstva, která filtruje energeticky bohaté ultrafialové sluneční záření. V důsledku toho byly téměř všechny systémy neustále převáděny ze základního energetického stavu do stavu energeticky vzbuzeného (viz rámeček Energetický stav 3 ).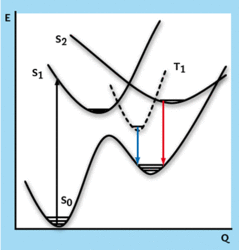 Molekuly se v naprosté většině případů nacházejí v základním energetickém stavu (S0) a doba jejich života je téměř neomezená (obrázek 2). Jsou-li elektronicky vzbuzeny ultrafialovým zářením, přejdou do excitovaných stavů (S1 a S2). Molekula, která se nachází v elektronicky vzbuzeném singletovém stavu, má přebytek energie. Tu může vyzářit fluorescencí a přejít zpět do základního stavu, nebo ji přeměnit na vibrační proces a přejít do stavu energeticky nižšího, včetně základního. Za určitých podmínek může také přejít na tripletový stav (T1). Přechod do základního stavu za vyzáření energie se pak nazývá fosforescence. Nezářivý přechod mezi stavy o stejném spinu je vnitřní konverze a přechod mezi stavy o rozdílném spinu (mezi singletem a tripletem) je mezisystémový přechod. Při zmíněných procesech se molekula chemicky nemění. Kromě toho mohou proběhnout fotochemické procesy, jež molekulu přemění (například se odštěpí proton, vodík nebo funkční skupina). Jedním z faktorů, který rozhoduje o tom, co se s molekulou v excitovaném stavu stane, je časová škála, na níž proces probíhá.
Molekuly se v naprosté většině případů nacházejí v základním energetickém stavu (S0) a doba jejich života je téměř neomezená (obrázek 2). Jsou-li elektronicky vzbuzeny ultrafialovým zářením, přejdou do excitovaných stavů (S1 a S2). Molekula, která se nachází v elektronicky vzbuzeném singletovém stavu, má přebytek energie. Tu může vyzářit fluorescencí a přejít zpět do základního stavu, nebo ji přeměnit na vibrační proces a přejít do stavu energeticky nižšího, včetně základního. Za určitých podmínek může také přejít na tripletový stav (T1). Přechod do základního stavu za vyzáření energie se pak nazývá fosforescence. Nezářivý přechod mezi stavy o stejném spinu je vnitřní konverze a přechod mezi stavy o rozdílném spinu (mezi singletem a tripletem) je mezisystémový přechod. Při zmíněných procesech se molekula chemicky nemění. Kromě toho mohou proběhnout fotochemické procesy, jež molekulu přemění (například se odštěpí proton, vodík nebo funkční skupina). Jedním z faktorů, který rozhoduje o tom, co se s molekulou v excitovaném stavu stane, je časová škála, na níž proces probíhá.
Kdyby u bází nukleových kyselin po elektronické excitaci proběhly fotochemické procesy, porušil by se genetický kód. Nic takového se ale během existence života na Zemi nestalo. To znamená, že se báze nukleových kyselin v excitovaném stavu chovají jinak. Musí existovat jiný mechanizmus, který je ve velmi krátké době (během pikosekund nebo ještě rychleji) 2) vrací do základního stavu beze změny.
Báze nukleových kyselin v excitovaném stavu
Cenné objevy zprostředkoval rozvoj femtosekundové 3) laserové spektroskopie. Všechny báze nukleových kyselin mají v excitovaném stavu velmi krátkou dobu života a do základního stavu se vracejí během pikosekund nebo ještě rychleji (zatímco některé systémy mohou v excitovaných singletových stavech setrvávat až tisíckrát déle). 4) Navíc mají báze nukleových kyselin velmi malý fluorescenční kvantový výtěžek, což znamená, že se do základního stavu vracejí nezářivým přechodem. Jako příklad uveďme adenin (6-aminopurin) a 2-aminopurin, jejichž molekuly se liší jen pozicí aminoskupiny na šestičlenném kruhu purinové báze, jeden ji má v pozici 6, druhý v pozici 2. Dramaticky se ale liší jejich doba života v excitovaném stavu – u adeninu je to jedna pikosekunda, u 2-aminopurinu několik desítek nanosekund.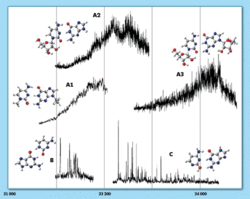 Znamená to tedy, že u bází nukleových kyselin existuje mechanizmus, který ve velmi krátké době umožní přechod do základního stavu. Výsledkem je stejná molekula jako před excitací. Nabízí se vysvětlení, že evoluce vybrala báze nukleových kyselin pro jejich velmi krátkou dobu života v excitovaném stavu. Kdyby byly vybrány jiné systémy, mohl by být porušen genetický kód. Nelze vyloučit, že k takovým dějům došlo, byly však během genetického vývoje zlikvidovány. K vysvětlení mechanizmů, které zajišťují fotostabilitu genetického kódu, přispěla kvantová a výpočetní chemie.
Znamená to tedy, že u bází nukleových kyselin existuje mechanizmus, který ve velmi krátké době umožní přechod do základního stavu. Výsledkem je stejná molekula jako před excitací. Nabízí se vysvětlení, že evoluce vybrala báze nukleových kyselin pro jejich velmi krátkou dobu života v excitovaném stavu. Kdyby byly vybrány jiné systémy, mohl by být porušen genetický kód. Nelze vyloučit, že k takovým dějům došlo, byly však během genetického vývoje zlikvidovány. K vysvětlení mechanizmů, které zajišťují fotostabilitu genetického kódu, přispěla kvantová a výpočetní chemie.
Excitace komplementárních párů bází nukleových kyselin
Všimněme si ještě výlučného uspořádání komplementárních párů v DNA (viz obrázek 1 v rámečku Deoxyribonukleová kyselina 2 ). Jak si ho máme vysvětlit? Odpověď jsme hledali spolu s týmem M. de Vriese z Kalifornské univerzity v Santa Barbaře. Studovali jsme strukturu a energetiku 27 různých uspořádání páru guaninu a cytosinu v základním a elektronicky excitovaném stavu. Spektra párů v excitovaném stavu byla dvojího typu (viz obrázek 4): jednak ostrá čárová spektra, jednak spektra se širokými pásy. Zjistili jsme, že spektra se širokými pásy náleží výlučně uspořádání podle Watsona a Cricka (obrázek 5). Charakter spekter vypovídá o době života excitovaného stavu. Široké pásy dokládají dobu života desetkrát až stokrát kratší než doba života párů vykazujících ostré čárové spektrum. Rozdíl je tak velký, že nemůže jít o náhodu.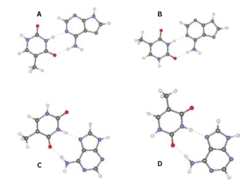 Nabízí se vysvětlení: Aby si evoluce v době vzniku života (kdy Země byla vystavena intenzivnímu ultrafialovému záření) zajistila větší přesnost přenosu genetického kódu, zvolila kromě bází nukleových kyselin další pojistku – strukturní uspořádání bází, jejichž doby života v excitovaných stavech jsou mimořádně krátké.
Nabízí se vysvětlení: Aby si evoluce v době vzniku života (kdy Země byla vystavena intenzivnímu ultrafialovému záření) zajistila větší přesnost přenosu genetického kódu, zvolila kromě bází nukleových kyselin další pojistku – strukturní uspořádání bází, jejichž doby života v excitovaných stavech jsou mimořádně krátké.
K faktům je třeba přistupovat kriticky
Naše hypotéza 5) byla krátce po uveřejnění podpořena výpočty, které vysvětlují rozdílné doby života excitovaných stavů různých uspořádání páru guaninu a cytosinu. Samozřejmě však jsou nezbytné další důkazy.Je třeba klást otázky, které se na první pohled zdají být triviální. K faktům – i k těm učebnicovým – je třeba přistupovat kriticky, jen tak lze dospět k objevům, které se jednou dostanou do učebnic.
Literatura
Václav Pačes: Jak začíná zdvojení dědičné informace, Vesmír 73, 389, 1994/7František Koukolík: Věda hledá duši. Nad knihou Francise Cricka, Vesmír 75, 163, 1996/3
James D. Watson: Tajemství DNA, Vesmír 75, 169, 1996/3
Emil Paleček: Renaturizace a hybridizace DNA, Vesmír 75, 509, 1996/9
Sidney Brenner: Nanebevstoupení Francise Cricka, Vesmír 77, 405, 1998/7
Michal J. Štorek: Výzkum DNA: musíme přidat!, Vesmír 81, 667, 2002/12
Poznámky
SLOVNÍČEK
báze – heterocyklická sloučenina (purin nebo pyrimidin), která je základem nukleotidů, a tedy nukleových kyselinmolekulový orbital – kombinace atomových orbitalů, atomový orbital udává oblast nejpravděpodobnějšího výskytu elektronu
singletový stav molekuly – kvantový stav, v němž je součet spinových kvantových čísel elektronů v molekule (S) roven nule
tripletový stav molekuly – vznikne, když molekula přejde do excitovaného stavu se dvěma nepárovými elektrony, které mají paralelní spiny
DEOXYRIBONUKLEOVÁ KYSELINA
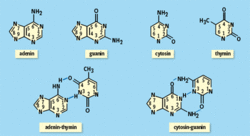 DNA je složena ze dvou šroubovic, každá je tvořena z nukleotidů. Podle typu báze rozeznáváme v DNA čtyři nukleotidy – purinové (adenin a guanin) a pyrimidinové (thymin a cytosin), viz obrázek 1. V molekule DNA se párují vždy adenin (A) s thyminem (T) dvěma vodíkovými vazbami a cytosin (C) s guaninem (G) třemi vodíkovými vazbami. Toto uspořádání se nazývá Watsonovo a Crickovo. Jiné uspořádání párů se v DNA nenachází. Toto vzájemné doplňování bází (komplementarita) je spolu s dvoušroubovicovou strukturou DNA základem přenosu genetické informace. Vlákna jsou složitým pochodem rozplétána a k uvolněným vláknům jsou prostřednictvím enzymů dosyntetizovány komplementární protějšky. Tak z jedné dvouvláknové molekuly DNA vznikají dvě identické dvouvláknové molekuly a při dělení buňky každá z nich přechází do jedné dceřiné buňky.
DNA je složena ze dvou šroubovic, každá je tvořena z nukleotidů. Podle typu báze rozeznáváme v DNA čtyři nukleotidy – purinové (adenin a guanin) a pyrimidinové (thymin a cytosin), viz obrázek 1. V molekule DNA se párují vždy adenin (A) s thyminem (T) dvěma vodíkovými vazbami a cytosin (C) s guaninem (G) třemi vodíkovými vazbami. Toto uspořádání se nazývá Watsonovo a Crickovo. Jiné uspořádání párů se v DNA nenachází. Toto vzájemné doplňování bází (komplementarita) je spolu s dvoušroubovicovou strukturou DNA základem přenosu genetické informace. Vlákna jsou složitým pochodem rozplétána a k uvolněným vláknům jsou prostřednictvím enzymů dosyntetizovány komplementární protějšky. Tak z jedné dvouvláknové molekuly DNA vznikají dvě identické dvouvláknové molekuly a při dělení buňky každá z nich přechází do jedné dceřiné buňky.ENERGETICKÝ STAV
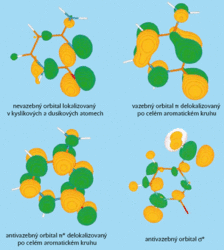 Elektrony v molekule obsazují molekulové orbitaly, které jsou tvořeny kombinací atomových orbitalů. Rozeznáváme molekulové orbitaly vazebné, nevazebné a antivazebné, které jsou charakterizovány rozdílnou orbitální energií (viz obrázek 3). Energie valenčních vazebných a nevazebných orbitalů je nižší než energie valenšních orbitalů antivazebných. V molekulách bází nukleových kyselin v základním elektronickém stavu elektrony obsazují vazebné a nevazebné orbitaly. Pokud molekula absorbuje ultrafialové záření o vhodné energii, přejde elektron z vazebného nebo nevazebného molekulového orbitalu do antivazebného, a tím se molekula dostane do elektronicky vzbuzeného stavu. U bází nukleových kyselin jsou nejnižší elektronicky vzbuzené stavy charakterizovány přechodem elektronů z vazebných a nevazebných orbitalů do antivazebných. Navíc rozlišujeme stavy singletový a tripletový. Přímý přechod do tripletového stavu je za normálních podmínek „zakázaný“, takže po excitaci přechází systém většinou do singletového excitovaného stavu. Každý stav lze popsat vzhledem k strukturním parametrům (vazebným vzdálenostem a úhlům) hyperplochou potenciální energie.
Elektrony v molekule obsazují molekulové orbitaly, které jsou tvořeny kombinací atomových orbitalů. Rozeznáváme molekulové orbitaly vazebné, nevazebné a antivazebné, které jsou charakterizovány rozdílnou orbitální energií (viz obrázek 3). Energie valenčních vazebných a nevazebných orbitalů je nižší než energie valenšních orbitalů antivazebných. V molekulách bází nukleových kyselin v základním elektronickém stavu elektrony obsazují vazebné a nevazebné orbitaly. Pokud molekula absorbuje ultrafialové záření o vhodné energii, přejde elektron z vazebného nebo nevazebného molekulového orbitalu do antivazebného, a tím se molekula dostane do elektronicky vzbuzeného stavu. U bází nukleových kyselin jsou nejnižší elektronicky vzbuzené stavy charakterizovány přechodem elektronů z vazebných a nevazebných orbitalů do antivazebných. Navíc rozlišujeme stavy singletový a tripletový. Přímý přechod do tripletového stavu je za normálních podmínek „zakázaný“, takže po excitaci přechází systém většinou do singletového excitovaného stavu. Každý stav lze popsat vzhledem k strukturním parametrům (vazebným vzdálenostem a úhlům) hyperplochou potenciální energie.Ke stažení
 článek ve formátu pdf [627,27 kB]
článek ve formátu pdf [627,27 kB]

























