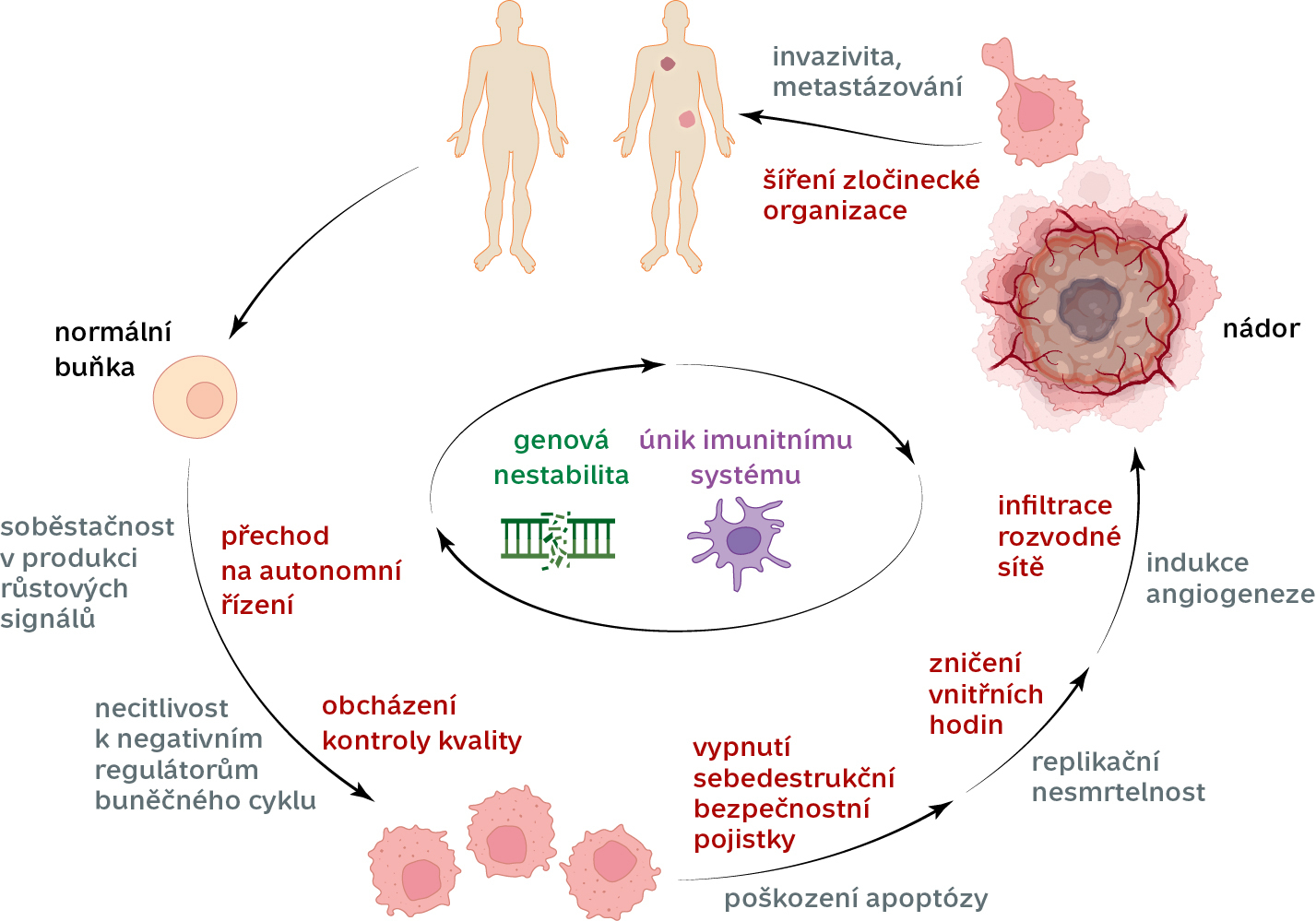
Zrození superpadoucha
Komiksovým příměrem si lze proces vzniku nádoru představit jako zrození superpadoucha. Obyčejný člověk žije svůj všední život a plní svou společenskou roli. Pak však dojde k incidentu (např. vystavení radiaci), který způsobí, že tento člověk získá nadpřirozené schopnosti. Rozhodne se je zneužít k dosažení osobních cílů, stává se z něj superpadouch. Podobně se normální buňka pod vlivem mutací, epigenetických změn a dalších vnějších faktorů transformuje na buňku nádorovou, která jedná na úkor organismu.
Pojďme si maligní transformaci a vznik nádoru zkusit popsat blíže na úrovni buněčné a molekulární. Východiskem pro náš příběh je biologické pojetí nádoru podle Douglase Hanahana a Roberta Weinberga.
Přechod na autonomní režim
Jedním z nejpřísněji regulovaných procesů u mnohobuněčných organismů včetně člověka je proces buněčného dělení. Nekontrolované dělení totiž může významně ohrozit tkáňovou homeostázu (rovnováhu) a mít kritické dopady na celý organismus. Až na naprosté výjimky proto nejsou naše tkáňové buňky schopny produkovat samy pro sebe (autokrinně) růstové faktory, a iniciovat tak dělení sebe samých. Tato přísná regulace je první z překážek, které musí buňka v rámci maligní transformace překonat. Musí se stát soběstačnou v produkci růstových signálů.
Docílit toho může mnoha způsoby, například mutací receptoru pro růstový faktor, která umožní jeho trvalou aktivaci bez nutnosti navázání růstového faktoru. Typickým příkladem je aktivační mutace receptoru pro epidermální růstový faktor (EGFR), která se vyskytuje přibližně u 15 % nemalobuněčných karcinomů plic. Buňka je díky mutačně aktivovanému receptoru schopna sama sebe trvale stimulovat k buněčnému dělení a přechodu z fáze G1 do fáze S buněčného cyklu. Přechází tedy z kontrolovaného režimu na autonomní mód.
Obcházení kontroly kvality
Může takovou autonomní buňku něco zastavit? Na řadu přicházejí negativní regulátory buněčného cyklu. Pokud bychom přirovnali buněčný cyklus k výrobnímu procesu v továrně, tak ve fázi G1 se připravujeme na výrobu, ve fázi S vyrábíme, ve fázi G2 provádíme výstupní kontrolu a ve fázi M distribuujeme produkty do dvou dceřiných buněk. Všech těchto kroků se účastní negativní regulátory, fungující jako kontroloři kvality, kteří mohou cyklus v jakémkoliv okamžiku zastavit. Například z důvodu poškození DNA nebo obecně porušení buněčné či tkáňové integrity.
Typickými příklady těchto regulátorů jsou protein Rb, který kontroluje přechod z fáze G1 do S buněčného cyklu, nebo protein p53, známý jako „strážce genomu“. Pokud je buněčná DNA poškozena, p53 zastaví buněčný cyklus a spouští opravu DNA. Tito kontroloři představují pro budoucí nádorovou buňku velký problém. I když je trvale stimulována k buněčnému dělení, mohou její dělení účinně blokovat. Buňka se tedy musí stát necitlivou k negativním regulátorům buněčného cyklu, musí obcházet kontrolory kvality.
Toho může opět docílit řadou různých mechanismů. Například inaktivací nebo ztrátou proteinu Rb, k čemuž dochází přibližně u 30 % všech lidských nádorů. Podobně je tomu v případě proteinu p53, který je inaktivován u více než 50 % všech typů lidských nádorů, u některých nádorových jednotek dokonce ve více než 80 %.
Vypnutí pojistky
Zbývá ještě sebedestrukční bezpečnostní pojistka v podobě programované buněčné smrti neboli apoptózy (Vesmír 101, 97, 2022/2). Je to klíčový proces, který udržuje homeostázu organismu tím, že eliminuje poškozené, nepotřebné nebo potenciálně nebezpečné buňky. Například již zmíněný „strážce genomu“ p53 spouští apoptózu v případě, že jsou poškození buněčné DNA příliš rozsáhlá a neopravitelná, aby zabránil předání poškozeného genetického materiálu do dceřiných buněk.
Apoptóza je podobně jako buněčný cyklus přísně regulována a podílejí se na ní antiapoptotické geny (např. Bcl-2), jež brání spuštění apoptózy, a geny proapoptotické (např. Bax), které naopak podporují její spuštění. Za normálních okolností jsou tyto geny ve vzájemné rovnováze. V poškozené buňce převáží aktivita proapoptotických genů a apoptóza se spustí.
Náš vznikající padouch se rychle dělí. Přitom vzniká řada poškození na úrovni DNA a současně dochází k narušování tkáňové integrity a homeostázy. Sebedestrukční bezpečnostní pojistka by měla nyní zajistit spuštění apoptózy a premaligní buňky eliminovat. Pro maligní transformaci je proto nezbytné vypnutí této pojistky. Typicky k tomu dochází inaktivací proapoptotických genů a patologickou aktivací antiapoptotických genů. V důsledku této poruchy vznikající nádorová buňka neví, že je neopravitelně poškozená, a zároveň neumí adekvátně reagovat na to, že poškozuje „svůj“ organismus, který jí o tom vysílá signály.
Zničení vnitřních hodin
Existuje ještě poslední mechanismus, který může našeho již téměř superpadoucha zastavit. Je to mechanismus vnitřních hodin, který buňky mají jako další pojistku před jejich potenciálně škodlivým vlivem, když zestárnou a jsou poškozené. Na koncích našich chromozomů jsou repetitivní sekvence (telomery; Vesmír 89, 357, 2010/6), jež mají za úkol tyto konce chránit. Díky molekulární podstatě replikace DNA se však při každém buněčném dělení telomery zkracují. Toto zkracování představuje systém vnitřních hodin, které pro každou buňku definují maximální počet buněčných cyklů, kterými může projít. Tento tzv. Hayflickův limit dosahuje u lidských buněk průměrně hodnoty 50. Po dosažení tohoto limitu již dojde ke kritickému zkrácení telomer a k destabilizaci chromozomů. Následně buňka ztrácí schopnost se dále dělit (buněčná senescence) nebo dochází k indukci apoptózy, nekrózy popřípadě jejich kombinaci.
Náš stále silnější padouch ale tento proces překoná pomocí aktivace telomerázy – enzymu, jenž umí zkracující se konce telomerických repetic opět prodlužovat. Buňka tak zničí svoje vnitřní hodiny a může se dělit neomezeně, je replikačně nesmrtelná. Tuto vlastnost mají za normálních okolností pouze kmenové buňky.
Infiltrace rozvodné sítě
Padouch už zdaleka není jedna nádorová buňka. Transformoval se v malé nádorové ložisko tvořené jeho potomky, kteří podědili a dále zdokonalovali jeho dovednosti. Každá tkáň v našem organismu potřebuje živiny (především kyslík) a potřebuje odvádět odpadní látky, třeba oxid uhličitý. Malému nádorovému ložisku k tomu stačí prostá difuze z a do okolních krevních kapilár. Když však nádor dosáhne určité kritické velikosti (uvádí se více než 1 mm3), prostá difuze již nestačí a v nádorovém ložisku dochází k hypoxii. Ta aktivuje transkripční faktor HIF1a – mohutný transaktivátor, který umožňuje buňkám adaptovat se na hypoxické podmínky. Kromě dopadů na buněčný metabolismus tento faktor aktivuje také vaskulární endotelový růstový faktor (VEGF), který působí na endotelové buňky okolních kapilár a stimuluje je k buněčnému dělení. Ty následně začnou vrůstat do nádorového ložiska. Takto postupně vzniká nádorová cévní síť. Dochází k angiogenezi.
Padouch je nyní načerno napojen na krevní oběh, čerpá z něj živiny a současně do něj vypouští toxické látky. Nejen oxid uhličitý a produkty jeho metabolismu, ale také látky (hormony, cytokiny) zajišťující systémové dopady nádorové choroby, tzv. paraneoplastický syndrom. Jedná se o skupinu příznaků, které jsou spojeny s přítomností nádoru v těle, ale nejsou přímo způsobeny růstem nádoru nebo jeho metastázami. To ale předbíháme. Metastazovat padouch ještě neumí. To je poslední dovednost, kterou musí získat, aby se stal skutečným superpadouchem.
Šíření zločinecké organizace
Padouch začne vytvářet celou zločineckou organizaci, která se rozšiřuje do nových měst. Nejprve infiltruje místní instituce a struktury (invazivita), poté zakládá nové základny v jiných městech (metastazování). Nádorové buňky se šíří podobně, nejprve invazivně pronikají do okolních tkání a poté metastazují do vzdálených částí těla. K tomuto procesu dochází na základě zvyšující se heterogenity nádorových buněk a vzniku subklonů, které selekčním tlakem získávají vlastnosti nezbytné pro realizaci metastatického programu.
Takto vybavené nádorové buňky následně podstupují sekvenci událostí označovanou jako metastatická kaskáda: 1. migrace z primárního nádoru, 2. prostoupení stěny krevní nebo lymfatické cévy (intravazace) a přežití buňky v cirkulaci, dokud nenalezne místo vhodné pro založení sekundárního nádoru (metastázy), 3. vystoupení skrze cévní stěnu (extravazace) a 4. zahájení růstu metastatického ložiska (metastatická kolonizace). Všechna metastatická ložiska jsou svými vlastnostmi odvozena od původního padoucha a pouze se adaptují na specifické podmínky jednotlivých orgánů.
Padouch zbrojí, policie nestíhá
Jak je možné, že normální buňka v tak krátkém čase získá všechny tyto abnormální vlastnosti? A proč není superpadouch v dobře fungujícím organismu včas rozpoznán a eliminován?
Odpovědí na první otázku je genomová nestabilita neboli zvýšená tvorba mutací a snížená schopnost buňky je opravovat kvůli poruchám opravných mechanismů DNA. Buňka, která má nestabilní genom, je plastičtější, rychleji získává nové vlastnosti a rychleji se adaptuje na změny prostředí (bohužel včetně účinku protinádorové léčby). Takto padouch získává postupně všechny svoje schopnosti. A jak je možné, že změněná a poškozená buňka není eliminována imunitním systémem? Protože jednou ze „supervlastností“ nádoru je také schopnost strážcům našeho imunitního systému unikat. Tento únik je zajištěn dvěma základními mechanismy: ztrátou rozpoznávacích antigenních struktur z povrchu nádorových buněk („kamufláží“) a imunosupresí neboli tlumením účinku imunitního systému („sabotáží“).
Rozsah a složitost dovedností, které musí superpadouch během svého vývoje nabýt, je až neuvěřitelný. Využívá je k nekontrolovanému dělení, k parazitickému osídlování a čerpání energetických zdrojů svého hostitele až do jeho úplné destrukce a zániku. Tohoto vnitřního nepřítele si naše tělo vytváří samo, někdy s menší, někdy s větší pomocí vnějšího světa.
Jak by vypadal a jaké vlastnosti by měl mít jeho kladný komiksový protějšek, „Strážce“ nebo „Ochránce“? Naše tělo tohoto superhrdinu vytvořit neumí, dokáže ho vytvořit moderní věda?
Literatura
Hanahan D., Weinberg R. A.: The hallmarks of cancer. Cell 100, 57–70, 2000, DO I: 10.1016/s0092-8674(00)81683-9.
Hanahan D., Weinberg R. A.: Hallmarks of cancer: the next generation. Cell 144, 646–74, 2011, DO I: 10.1016/j.cell.2011.02.013.
Hanahan D.: Hallmarks of Cancer: New Dimensions. Cancer Discovery 12, 1, 31–46, 2022, DO I: 10.1158/2159-8290.CD -21-1059.
Slabý O. (ed.): Molekulární medicína. Galén, Praha 2015, ISBN 978-80-7492-121-6.
Ke stažení
 článek ve formátu pdf [503,12 kB]
článek ve formátu pdf [503,12 kB]
O autorovi
Ondřej Slabý