Co je to precizní onkologie
Pokrok ve výzkumu zhoubných nádorů a vývoj moderních terapií významně posunuly léčebné možnosti, a to dokonce i u malignit, které jsme ještě nedávno považovali za terapeuticky neovlivnitelné. Prognóza onkologických pacientů, včetně těch s metastázami, se proto kontinuálně zlepšuje. Logickým cílem klinického výzkumu je transformace metastatického onemocnění ze smrtelné choroby na chorobu chronickou. Za tímto pokrokem a touto ambicí si lze představit především uplatňování principu tzv. precizní onkologie, zahrnující i precizně indikovanou protinádorovou imunoterapii.
Základním předpokladem vítězství v moderní onkologii je teze Mistra Suna z jeho slavného díla Umění války z 5. století př. n. l.: „Poznej svého nepřítele.“ Teprve poznání nepřítele umožní personalizovat léčbu a docílit těch nejlepších léčebných výsledků.
Personalizace léčby v onkologii nebo v medicíně obecně není žádnou novinkou. Zohlednění parametrů, jako jsou klinický stav pacienta, hmotnost nebo tělesný povrch, je samozřejmou součástí terapeutického plánování již od počátků protinádorové léčby. Co je při charakterizaci nemoci a personalizaci léčby relativně nové, je posun z úrovně klinické a mikroskopické (práce patologů) na úroveň molekulárně-biologickou. Tento vyšší stupeň personalizace léčby nádorových onemocnění, při kterém využíváme technologie z oblasti molekulární biologie a genetiky, označujeme jako precizní onkologii.
Nádory jako sněhové vločky
Každý nádor – i když vyrostl ze stejného typu buněk a ve stejném orgánu, třeba v prsu nebo tlustém střevě, a v mikroskopu patologa vypadá identicky – je biologicky odlišný. Nádory se tak často připodobňují ke sněhovým vločkám. Ty se také zdají všechny stejné, ale při detailnějším pohledu zjistíme, že každá je trochu jiná.
Cílem precizní onkologie je pomocí nejmodernějších technologií detailně popsat biologické vlastnosti a chování nádoru konkrétního pacienta a takto získané informace využít pro nastavení léčby, která mu bude „šitá na míru“. Precizní onkologie je v klinické praxi obvykle implementována cestou mezioborové molekulárně-onkologické indikační komise (někdy také molekulární tumor board, MTB), která vytváří individuální terapeutické plány založené na biologických vlastnostech daného nádoru. Často díky tomu nalezneme léčebné možnosti, na které by při použití standardních postupů nebylo možné přijít.
Cílená léčba karcinomu prsu
Například lék blokující receptor pro epidermální růstový faktor 2 (Her2) použijeme pouze u pacientek s tzv. Her2- -pozitivním karcinomem prsu (15–20 %), u kterých předem potvrdíme amplifikaci (zvýšení počtu kopií) genu pro tento receptor a adekvátní zmnožení tohoto receptoru na úrovni proteinu. V této indikaci je lék také registrován. Jedná se o trastuzumab, monoklonální protilátku blokující receptor Her2.
Hovoříme o cílené léčbě, protože zmnožení receptoru Her2, terapeutického cíle, se vyskytuje pouze u nádorových buněk. Her2 se sice nachází i v některých normálních buňkách, ale v daleko nižších hladinách. Inhibitor je tedy zaměřen na cíl, který se vyskytuje především (ve většině případů ovšem výhradně) u nádorových buněk, čímž se kromě zvýšení účinnosti také snižuje toxicita léčby. Trastuzumab, schválený v roce 1998, byl historicky prvním cíleným lékem v terapii solidních nádorů a znamenal revoluci v dalším vývoji protinádorových léčiv.
Pacient v centru pozornosti
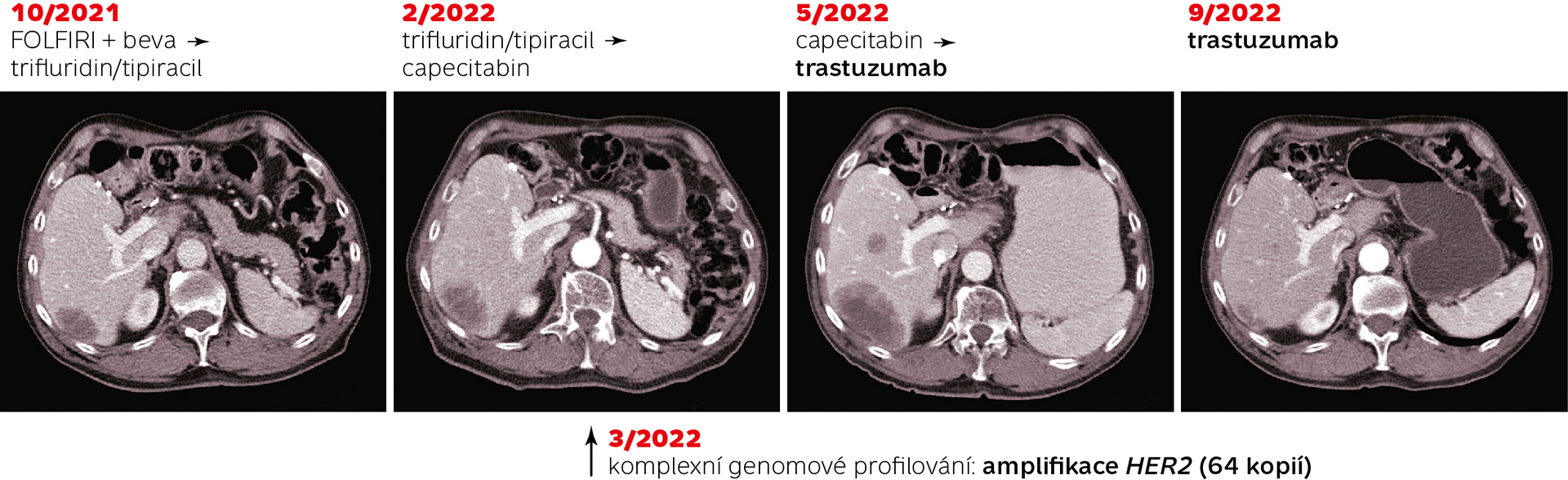
Precizní onkologie ve smyslu individualizovaného podání léčiv na základě cíleného molekulárního testování (například amplifikace genu HER2 u karcinomu prsu) k nalezení vhodného pacienta pro konkrétní lék (například trastuzumab) je součástí rutinní klinické praxe více než dvacet let a je podmínkou indikace a úhrady léčiva. Jedná se ovšem o jakousi nižší formu precizní onkologie. V centru tohoto přístupu je totiž léčivo (drug-centric), pro které hledáme vhodného pacienta. Třeba u pacientky s karcinomem prsu vyšetřujeme cíleně amplifikaci genu HER2. Vyšším stupněm precizní onkologie je přístup, v jehož centru je pacient (patient-centric), pro kterého individualizovaně hledáme nejvhodnější terapeutické možnosti na základě komplexního vyšetření nádorového genomu. Jestliže aplikujeme tento přístup, nabízí se otázka, zda by biologicky dávalo smysl použít trastuzumab také u jiných typů nádorů, pokud v jejich genomu nalezneme amplifikaci genu pro HER2.
Amplifikace genu HER2 se vyskytuje především u karcinomu prsu a žaludku, kde je přítomna přibližně u 20 % případů a její zjišťování a cílení na ni je součástí standardních léčebných protokolů. Vyskytuje se ale také u jiných typů nádorů, pouze s mnohem nižší frekvencí. Májí ji například přibližně 3 % pacientů s karcinomem tlustého střeva, přičemž klinická zkušenost z posledních let ukazuje, že i těmto pacientům může léčba trastuzumabem pomoci. Kvůli nízké četnosti ale nikdy neproběhla klinická studie testující účinnost blokády Her2 u pacientů s karcinomem tlustého střeva. A tuto logiku lze aplikovat na většinu terapeutických cílů.
Pokud je ovšem v centru našeho uvažování pacient, nikoliv lék, a použijeme necílené komplexní genomové profilování, můžeme tuto mutaci nalézt i u pacienta s karcinomem tlustého střeva (viz kazuistiku). Změna je potom kvalitativní, protože pacienti mohou cíleně dostat léčiva, ke kterým by se jinak v rámci standardní péče a testování nemohli dostat. Na tuto změnu jsme bohužel museli čekat mnoho let kvůli nutnosti rozvoje a zvýšení dostupnosti sekvenačních technologií pro profilování nádorových genomů.
Změna paradigmatu: sledujeme mutace
Nyní se dostáváme k principu označovanému jako agnostický přístup k tumoru (angl. tumor-agnostic). Ten zcela zanedbává histologický původ nádoru – tedy z jakých buněk vznikl, jaký je jeho morfologický obraz v mikroskopu – a jediným indikačním kritériem pro použití cílené léčby je přítomnost mutace v genu, pro který máme k dispozici cílené léčivo. Taková léčiva nejsou schválena pro žádný konkrétní typ nádoru, ale od začátku jsou vyvíjena pro všechny nádory, jež nesou příslušnou mutaci. Lékař tak nemusí žádat o speciální schválení úhrady léku, jako je tomu například v případě Her2 a trastuzumabu, pokud je použit u jiné diagnózy než u karcinomu prsu nebo žaludku.
Mezi léčiva agnostická k tumoru patří mimo jiné inhibitory receptoru NTRK nebo imunoterapie na bázi inhibitorů kontrolních bodů imunitní odpovědi (checkpoint inhibitorů). V prvním případě je indikačním kritériem přítomnost aktivační fúze genu NTRK, ve druhém potvrzení mikrosatelitní nestability nádoru, která reflektuje poruchu oprav špatného párování bází, nebo tzv. vysokou mutační nálož.
Hodně mutací – snadnější cíl
Různé typy nádorových onemocnění, ale i nádory v rámci jedné diagnostické jednotky se ve své etiologii (příčinách vzniku) mohou odlišovat různou mírou genomové nestability či intenzitou působení mutagenních kancerogenů. To má za následek různý počet mutací v nádorovém genomu, tzv. nádorovou mutační nálož (tumor mutational load/burden, TMB). Typickým příkladem nádorů s extrémně vysokou TMB jsou nádory s poruchou oprav špatného párování bází a nádory vykazující tzv. mikrosatelitní nestabilitu (MSI) či nádory etiologicky vystavené chronickému působení mutagenu – karcinom plic (expozice cigaretovému kouři) nebo maligní melanom (UV záření). Naopak nejnižší TMB je pozorována především u nádorů dětského věku.
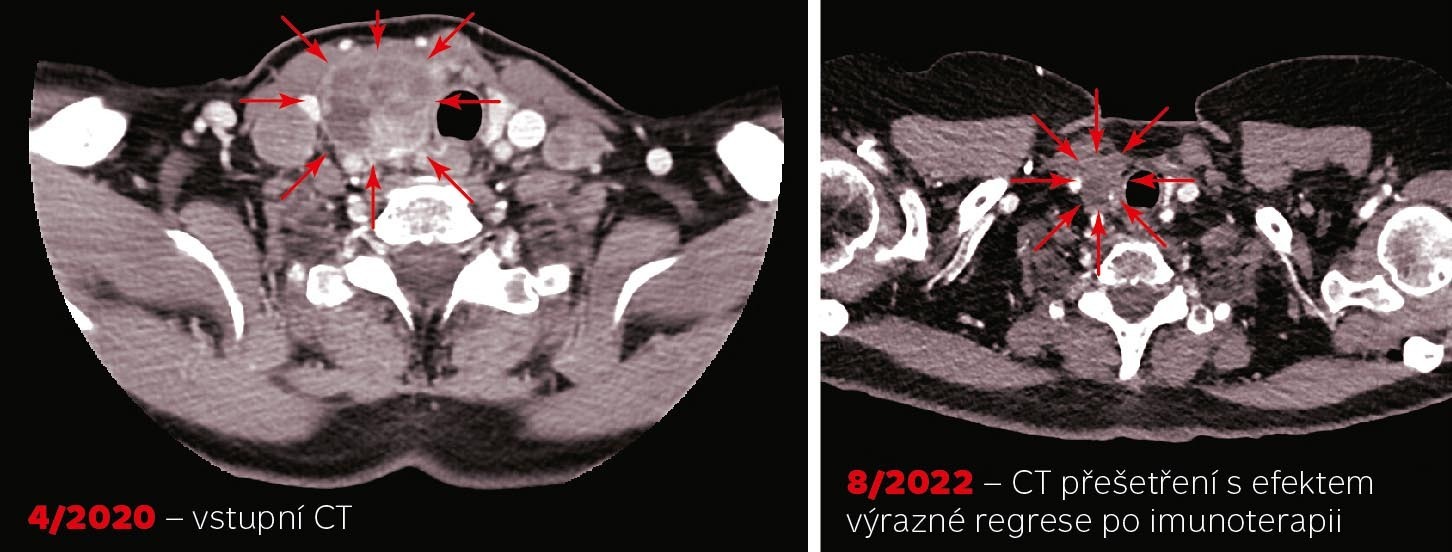
TMB je důležitá především proto, že odráží počet neoantigenů, pozměněných proteinů či peptidů, které se vyskytují na povrchu nádorové buňky a mohou spouštět imunitní odpověď. Množství neoantigenů vymezuje odlišnost nádorové buňky od ostatních buněk organismu, čímž definuje míru její rozpoznatelnosti imunitním systémem. TMB proto souvisí také s odpovědí na protinádorovou imunoterapii. Její účinek je založen především na blokování inhibičního působení nádoru na buňky imunitního systému. Pokud u nádoru, který má vysokou mutační nálož (obvykle vyšší než deset mutací na milion bází), takže je dobře rozpoznáván imunitním systémem, zabráníme inhibici imunitní odpovědi pomocí imunoterapie, pozorujeme dobrou léčebnou odpověď.1) Abychom ovšem indikovali protinádorovou imunoterapii precizně, je opět nezbytné genomové profilování nádoru.
Nádor jako pohyblivý cíl V blízké budoucnosti bude společně s histopatologickou diagnózou patologii automaticky opouštět také molekulární popis nádoru získaný pomocí genomového profilování, včetně doporučení pro individualizovanou léčebnou strategii. V současnosti se z důvodu limitované klinické evidence uplatňuje precizní onkologie až v pozdějších léčebných liniích, na konci terapeutických snah. V budoucnu však bude používána již na jejich počátku a terapeutické strategie budou založeny na precizně formulované kombinaci více cílených léčiv a imunoterapie.
Tento přístup přináší naději, že se metastatickou chorobu podaří posunout z kategorie smrtelných nemocí mezi nemoci chronické, obdobně jako se to podařilo u infekce HIV a AIDS. Genomově nestabilní nádorovou buňku lze v mnohém připodobnit k virové částici. Nádorové buňky i viry jsou vlivem genomové nestability velice plastické a umějí se výborně adaptovat na změnu prostředí (léčbu). Někteří autoři je označují za pohyblivé cíle. Infekci HIV se podařilo transformovat na chronickou chorobu právě zavedením léčebných schémat založených na lékových kombinacích. Povede se nám to také u nádorových onemocnění?
Autor děkuje MUDr. Michalu Eidovi, vedoucímu molekulárního tumor boardu ve Fakultní nemocnici Brno, za poskytnutí klinické a obrazové dokumentace k uvedeným kazuistikám.
Poznámky
1) Viz kazuistiku v online verzi tohoto článku.
Ke stažení
 článek ve formátu pdf [489,84 kB]
článek ve formátu pdf [489,84 kB]
O autorovi
Ondřej Slabý