I rakovinu lze naučit slušnému chování
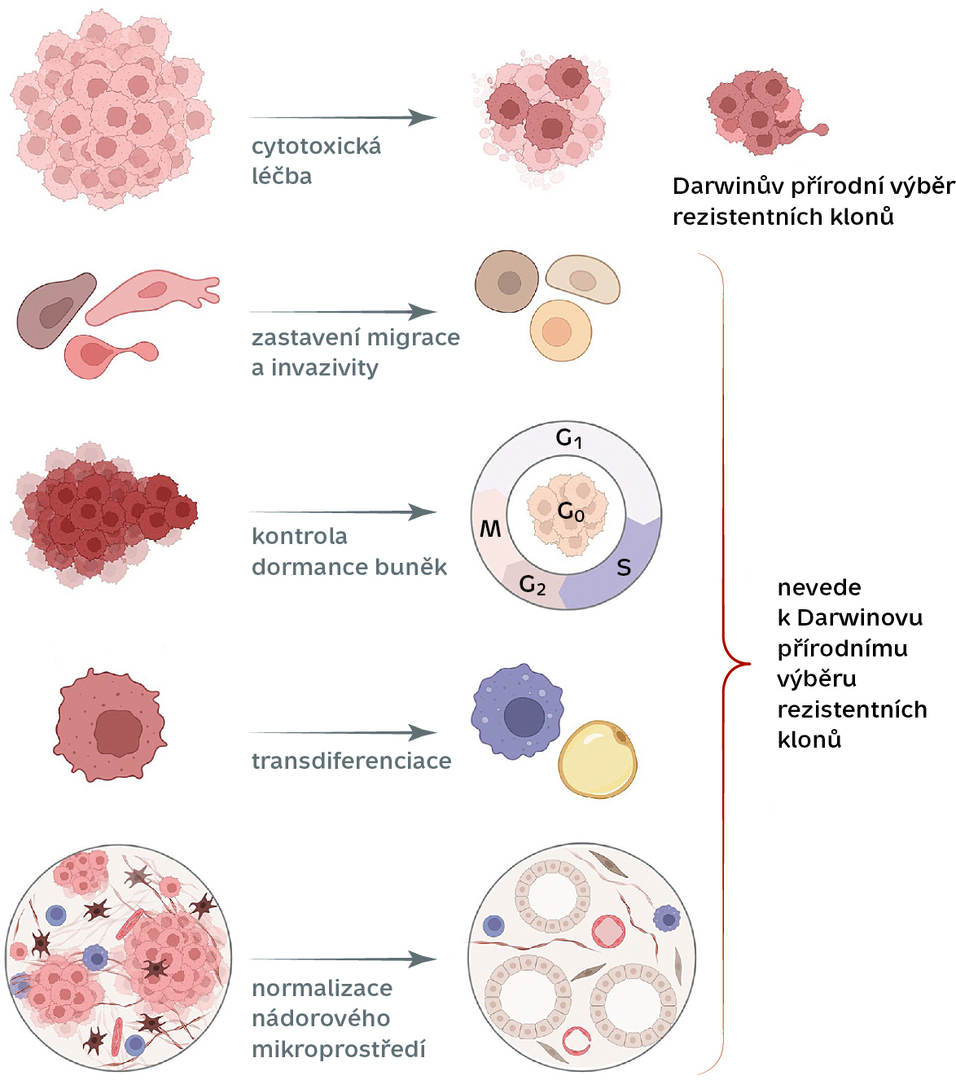
Tradiční protinádorová léčba je cytotoxická – jejím účelem je zabít co nejvíce rakovinných buněk v těle. Navzdory tomu zpravidla nějaká nádorová buňka přežije – buď má štěstí, že je proti léčbě přirozeně odolná, nebo si tuto schopnost vytrénuje poté, co se s léčbou setká a vytvoří si proti ní obranné mechanismy. V každém případě má pak výhodu, kterou popsal již Charles Darwin – podle pravidel přírodního výběru evoluce přeje organismům lépe přizpůsobeným svému prostředí. Tutéž výhodu si s sebou nesou i jejich potomci.
V případě nádorových onemocnění to znamená, že v těle navzdory léčbě dál přežívají buňky, které jsou vůči ní odolné (rezistentní), množí se, a když jejich počet převýší původní populaci, léčba přestane fungovat a rakovina se znovu vrátí – navíc v hůře léčitelné podobě.
Pozornost vědců a vědkyň na celém světě se dnes od prostého zabíjení obrací k možnostem „převýchovy“ nádorových buněk, aby se „polepšily“, ztratily svou agresivitu, nešířily se dále do organismu, popřípadě se přeměnily na nějaký „ukázněnější“ typ buněk.
Nabízejí se hned čtyři slibné strategie, jak toho dosáhnout.
1. Nenechat usnout (nebo naopak neprobouzet)
Tzv. fenomén dormance neboli klidu se vyznačuje dočasným a vratným zastavením růstu. Je to strategie, kterou využívá řada organismů, pokud čelí nepříznivým a náročným podmínkám a chtějí si zajistit přežití. Živočichové tak přečkávají období zimy nebo sucha, semena rostlin čekají s klíčením na vhodné podmínky (Vesmír 98, 362, 2019/6), bakterie mohou přežívat i dlouhé cesty nehostinným kosmickým prostorem, aniž by jim ublížil mráz, radiace nebo vzduchoprázdno.
Každá buňka v lidském organismu od svého vzniku dělením mateřské buňky až do okamžiku, kdy se sama rozdělí na dvě dceřiné buňky, prochází několika na sebe navazujícími procesy, souhrnně nazývanými buněčný cyklus. Podle něj se řídí, kdy bude růst, kdy bude připravovat svou genetickou informaci na dělení a kdy se nakonec skutečně rozdělí. Některé buňky včetně nádorových umějí tento svůj cyklus zastavit v jeho „nulové“, klidové fázi, kdy na sebe zbytečně neupozorňují imunitní systém, takže uniknou z jeho dohledu. Takové buňky jsou pak zásobárnou různých vývojových genetických variant, které se jim hodí při nutnosti překonat nějakou náhlou změnu, například vystavení cytotoxické terapii. Proto je schopnost nádorových buněk zahájit klidový program jedním z klíčových mechanismů vzniku rezistence.
Předmětem výzkumu jsou dva možné léčebné přístupy, jak „spícím“ nádorovým buňkám v těle čelit – jejich trvalé uzamčení (lock-in) ve fázi zástavy buněčného cyklu, nebo naopak jejich odemčení (lock-out).
V prvním případě to znamená zabránit opětovnému probuzení „spících“ buněk, tedy zablokovat signální dráhy, jejichž prostřednictvím se pokyn k probuzení přenáší. Podobný přístup je již v současnosti využíván při léčbě některých nádorů léky blokujícími aktivitu tzv. cyklin-dependentní kinázy CDK4/6, která se na řízení buněčného cyklu podílí. Ale aby byla tato léčba trvale účinná, musela by být pacientovi podávána doživotně, což při množství nežádoucích účinků stávajících léků není dost dobře možné.
Strategie lock-out, tedy odemčení, naopak cílí na dráhy, které umožňují přejít buňce do klidového stavu anebo které ji v tomto stavu udržují. Nádorová buňka, které nebude dovoleno „usnout“ nebo bude ze svého „spánku“ uměle probuzena, by neměla možnost úniku před konvenční protinádorovou terapií a nádorové onemocnění jako celek by přišlo o jednu z možností, jak vůči léčbě získat odolnost.
2. Hacknout buněčný program
Mnohobuněčné organismy se skládají z řady různých typů buněk, plnících odlišné funkce. Přitom všechny se vyvinuly dělením z jediného oplozeného vajíčka, a nesou tedy stejnou genetickou informaci. Jejich odlišné specializace je dosaženo tím, že se z celé této genetické informace v konkrétních buňkách uplatňuje jen její část – jsou „zapnuty“ (aktivovány) jen určité geny. Mluvíme o tzv. transkripčním profilu. Vývoj, kterým z původně „všehoschopné“ (totipotentní) embryonální či kmenové buňky vznikají specializované buňky s odlišnou strukturou i funkcí, se nazývá buněčná diferenciace.
V laboratorních podmínkách se již delší čas uplatňují postupy umožňující s pomocí transkripčních faktorů vyvolat u zdravých buněk nádorové bujení a studovat na nich děje, ke kterým v nádoru dochází, popř. na nich zkoušet možnosti léčby.
Pokud je možno uměle nasměrovat buněčnou diferenciaci až ke vzniku tumoru, mělo by být také možné tento vývoj otočit a přeprogramovat nádorové buňky tak, aby se proměnily v „poslušnější“ typ. Na tom je postavena myšlenka druhé z „převýchovných“ strategií, která se již uplatňuje například v léčbě akutní promyelocytární leukemie. Její příčinou je expanze patologických krvetvorných buněk, jejichž dozrávání se předčasně zastavilo. Léčba, která jim umožní dozrát ve funkční typ bílých krvinek (granulocyty), změnila kdysi vysoce smrtelnou diagnózu v onemocnění, které je u osmi z deseti pacientů velmi dobře léčitelné.
Pokrok byl již zaznamenán i u solidních nádorů a jejich metastáz. Například určité buňky karcinomu prsu lze nasměrovat tak, aby se nakonec vyvinuly v buňky tukové tkáně (adipocyty) s omezenou schopností růstu. Výzkum buněčného přeprogramování pomocí transkripčních faktorů naznačuje velký potenciál také u gliomu, karcinomu prostaty či hepatocelulárního karcinomu.
3. Změnit mikroprostředí nádoru
Možnost reverze nádoru, tedy obrácení jeho vývoje k tkáni s normálními vlastnostmi, je další z hledaných terapeutických možností. Reverze nádoru lze účinně dosáhnout v návaznosti na rekonfiguraci cytoskeletu, což je systém proteinových vláken a dutých mikrotubulů, jejichž hlavní funkcí je transport látek a buněčných komponentů, opora buňky a účast na jejím dělení. Děje se tak působením široké škály molekulárních a biofyzikálních faktorů. Snížení přísunu živin a kyslíku, změna kyselosti prostředí (pH) a ovlivnění produkce různých signálních bílkovin (cytokinů), to vše může ovlivnit nádorové mikroprostředí natolik, že dojde k převýchově nádorových buněk na méně zhoubný fenotyp.
Klíčovou roli ve vývoji nádorů, zejména metastáz, hraje tzv. epiteliálně mezenchymální tranzice (EMT). Jedná se o biologický proces, při kterém buňky epitelu, tedy tkáně, která kryje povrch orgánů nebo vystýlá nějakou tělní dutinu, ztrácejí své charakteristické vlastnosti, zejména pevný tvar a pevné připojení k sousedním buňkám, a mění se na tzv. mezenchymové kmenové buňky, které nemají pevný tvar, odpojí se od okolních buněk, jsou schopny pohybu, a tím i invaze dále do organismu.
K nastartování reverzní změny invazivního migračního fenotypu nádoru je tedy nezbytné dosáhnout opačného procesu – mezenchymálně epiteliálního přechodu (MET), mimo jiné s využitím působení myo-inositolu, stereoizomeru pseudovitaminu B8 inositolu. Ten posiluje spojení mezi buňkami obnovením jejich vazeb a přispívá k normalizaci mikroprostředí nádoru.
Protože procesy EMT/MET jsou normální součástí vývoje organismu ve fázi embrya, pozornost se soustřeďuje i na to, jak dostat nádorové buňky a jejich mikroprostředí pod kontrolu tím, že budou vystaveny působení embryonální tkáně v raných stadiích diferenciace. Například léčba nádorových buněk rybím embryonálním extraktem inhibuje EMT i růst nádoru a zároveň podporuje jeho reverzi tím, že nádorové buňky jsou díky jeho působení nasměrovány vývojově zpět k již zmíněnému „všehoschopnému“ stavu a mohou se začít znovu vyvíjet méně zhoubným směrem.
Úprava složení a struktury nádorového mikroprostředí může být definitivním řešením i u nálezů předrakovinných stadií onemocnění. Například u patologicky změněné sliznice tzv. Barrettova jícnu bylo při jejím potažení hydrogelem složeným z normálních složek mezibuněčné hmoty (extracelulární matrix) dosaženo obnovy normálního stavu epitelu.
Uvedené výzkumy naznačují, že modulací nádorového mikroprostředí lze dosáhnout reverze tumoru, obnovy funkčních vztahů mezi buňkami, a tím je možné včas zasáhnout do progrese rakoviny.
4. Zabránit vycestování
Většina metastazujících nádorů zůstává při současných terapeutických možnostech nevyléčitelná. Šíření metastáz je důsledkem invaze nádorových buněk, která je charakteristickým znakem maligních (zhoubných) buněk, odlišujícím je od buněk benigních (nezhoubných).
Nádorové buňky si osvojily pozoruhodný repertoár způsobů invaze – od kolektivní migrace celých buněčných vláken nebo plátů až po cestování jednotlivých oddělených buněk. Léky zaměřené proti invazi nádorů bez ohledu na její specifický způsob (migrastatika) nemají na rozdíl od cytostatik za cíl nádorové buňky zabíjet, „pouze“ omezují jejich schopnost migrovat do dalších oblastí. Proto i v případě, že se některé nádorové buňky stanou vůči migrastatikům rezistentními, nezískají tím proliferační výhodu a zůstanou v nádorovém mikroprostředí přítomny v omezené míře.
Migrastatika zatím nebyla studována na pacientech, řada sloučenin však již v preklinických studiích prokázala povzbudivé výsledky.
Všechny čtyři „převýchovné“ strategie, které letos podrobně popsal tým výzkumné skupiny Molekulární a buněčné mechanismy invazivity nádorových buněk BIOCEV, PřF UK a NÚDZ,1) mají potenciál zlepšit výsledky léčby rakoviny – zejména pokud se je podaří zkombinovat se standardní cytotoxickou léčbou. Pravděpodobně by mohly zabránit vzniku rezistence nádoru vůči stávajícím terapiím a v ideálním případě přispět k tomu, že se rakovina jednou stane chronickým, léčitelným onemocněním.
Poznámky
1) Škarková A. et al.: Educate, not kill: treating cancer without triggering its defenses. Trends in Molecular Medicine 30, 7, 673–685, 2024, DOI: 10.1016/j.molmed.2024.04.003.
Ke stažení
 článek ve formátu pdf [515,58 kB]
článek ve formátu pdf [515,58 kB]