Strukturní biologie v boji s nádorovým onemocněním
Rakovina prostaty postihuje během života jednoho muže z devíti, a je tak nejčastěji diagnostikovanou rakovinou mužů s více než 100 000 úmrtími celosvětově za rok. Pozitivní zprávou je, že je velmi „líným“ onemocněním – průměrná doba rozvoje agresivních forem nádorů je deset až dvacet let. Na druhé straně jsou metastazované nádory prostaty v současné době velmi obtížně léčitelné, je tedy nezbytné věnovat další úsilí vývoji inovativních strategií detekce, monitorování a léčby tohoto typu rakoviny.
V současnosti prožíváme druhou revoluci v diagnostice rakoviny prostaty. První odstartovala na konci osmdesátých let minulého století, kdy byl zahájen screening na prostatický specifický antigen (PSA). Ten se stal hned po svém zavedení do praxe klíčovým nástrojem včasné detekce a monitorování rakoviny prostaty z krve. Testování asymptomatických jedinců přispělo rozhodující měrou ke snížení úmrtnosti tím, že umožnilo dřívější a potenciálně účinnější léčebné zásahy v časných stadiích tohoto onemocnění. Na druhé straně široké používání screeningu PSA vyvolalo a vyvolává debaty vzhledem k náchylnosti k falešně pozitivním diagnózám a následným zbytečným terapeutickým zásahům.
Katalyzátorem druhé revoluce byl objev mladšího bratra PSA, a to prostatického specifického membránového antigenu (PSMA). PSA je uvolňován buňkami do krevního oběhu a následně diagnostikován ze vzorků krve. PSMA je naproti tomu pevně zakotven v buněčné membráně, a tudíž je vhodný pro cílenou terapii. Ve srovnání se zdravými tkáněmi je množství PSMA výrazně zvýšeno na nádorech prostaty, a zvláště na metastázách agresivních, pokročilých stadií této nemoci.
V posledních dvaceti letech došlo k explozivnímu vývoji malých molekul a makromolekul rozpoznávajících PSMA, které jsou vhodné jak pro detekci, tak pro terapii nádorů prostaty. Vhodně tak doplňují a rozšiřují primární screening cílený na PSA. V klinické praxi zahrnují moderní zobrazovací techniky především pozitronovou emisní tomografii (PET), která využívá malé molekuly rozpoznávající PSMA s navázanými radionuklidy (18F, 68Ga) a vyznačuje se vysokou specificitou a citlivostí (Vesmír 100, 378, 2021/6). V posledních třech letech bylo pro klinické použití schváleno několik takových radiodiagnostik (PYLARIFY, Locametz, POSLUMA) a další jsou v různých fázích klinického testování.
Pro terapii jsou diagnostické radionuklidy nahrazeny radionuklidy terapeutickými, například luteciem 177Lu v přípravku Pluvicto (Vesmír 101, 288, 2022/5). Toto léčivo vykazuje velmi slibné výsledky při léčbě metastatického karcinomu prostaty. V oblasti terapie jsou rovněž testovány přípravky na bázi monoklonálních protilátek, které jsou konjugovány mimo jiné s cytotoxiny. Tento přístup kombinuje specificitu protilátkového cílení s účinností chemoterapie, což zvyšuje efektivitu léčby a omezuje nežádoucí účinky. Zajímavé využití mají také fluorescenčně značené sondy, které jsou při operacích využívány k vymezení hranic mezi zdravou tkání a nádorem s vysokou expresí PSMA. Vývoj (nejen) protinádorových léčiv Vývoj léčiv obecně probíhá v několika navazujících etapách a od identifikace molekulárního cíle až po konečné schválení léčiva obvykle trvá deset až dvacet let. Náklady snadno převyšují miliardu dolarů. Typickým prvním krokem je robotické testování knihoven malých molekul zahrnujících miliony sloučenin, s cílem identifikovat nejlepší kandidáty vhodné pro další optimalizace, tzv. lead compounds. Tento postup byl použit i při identifikaci nadějných molekul specificky interagujících s PSMA. V případě PSMA se rovněž velmi osvědčila souběžně vedená komplementární strategie, kdy byly tyto molekuly „racionálně“ navrženy na základě strukturní podobnosti s fyziologickými substráty tohoto enzymu. Díky bouřlivému rozvoji umělé inteligence se v současné době k identifikaci vhodných sloučenin stále více využívá počítačové modelování a simulace, které celý proces výrazně urychlují a zlevňují.
Ať už je kandidátní molekula identifikována jakýmkoliv způsobem, dalším krokem je několikaletá mravenčí práce medicinálních chemiků, kteří se pokoušejí molekulu upravit a zdokonalit pro další použití (structure-activity relationship optimization; SAR optimalizace). Cílem SAR optimalizace je zlepšení biologické aktivity, farmakokinetických vlastností nebo minimalizace nežádoucích vedlejších účinků a úprava kandidátní molekuly do podoby vhodné pro klinické zkoušky. V praxi tento proces zahrnuje iterativní postupy, kdy jsou jednotlivé části (funkční skupiny) kandidátní molekuly postupně modifikovány anebo nahrazovány, upravuje se jejich stereochemie nebo jsou přidávány či odstraňovány specifické molekulární fragmenty.
Jedním z úskalí SAR optimalizace je fakt, že velmi často neznáme přesné místo a molekulární mechanismus, kde a jak kandidátní molekula interaguje s cílovým proteinem. Medicinální chemici „tápou ve tmě“, jelikož bez znalosti trojrozměrné struktury vazebného místa cílového proteinu je velmi obtížné určit, které části molekuly upravit a jakým způsobem. Celý optimalizační proces je veden metodou pokus-omyl s obrovským množstvím iteračních kroků, často kontraproduktivních.
Jak pomáhá strukturní biologie?
Strukturní biologie hraje zásadní roli při dešifrování biologických procesů. S využitím pokročilých experimentálních technik, jako jsou rentgenová krystalografie, nukleární magnetická rezonance (NMR) nebo kryoelektronová mikroskopie (cryoEM), mohou vědci získat detailní vhled do trojrozměrné struktury biologických makromolekul a pochopit, jak tyto molekuly v těle fungují nebo jakým způsobem mohou být změněny například u nádorových onemocnění.
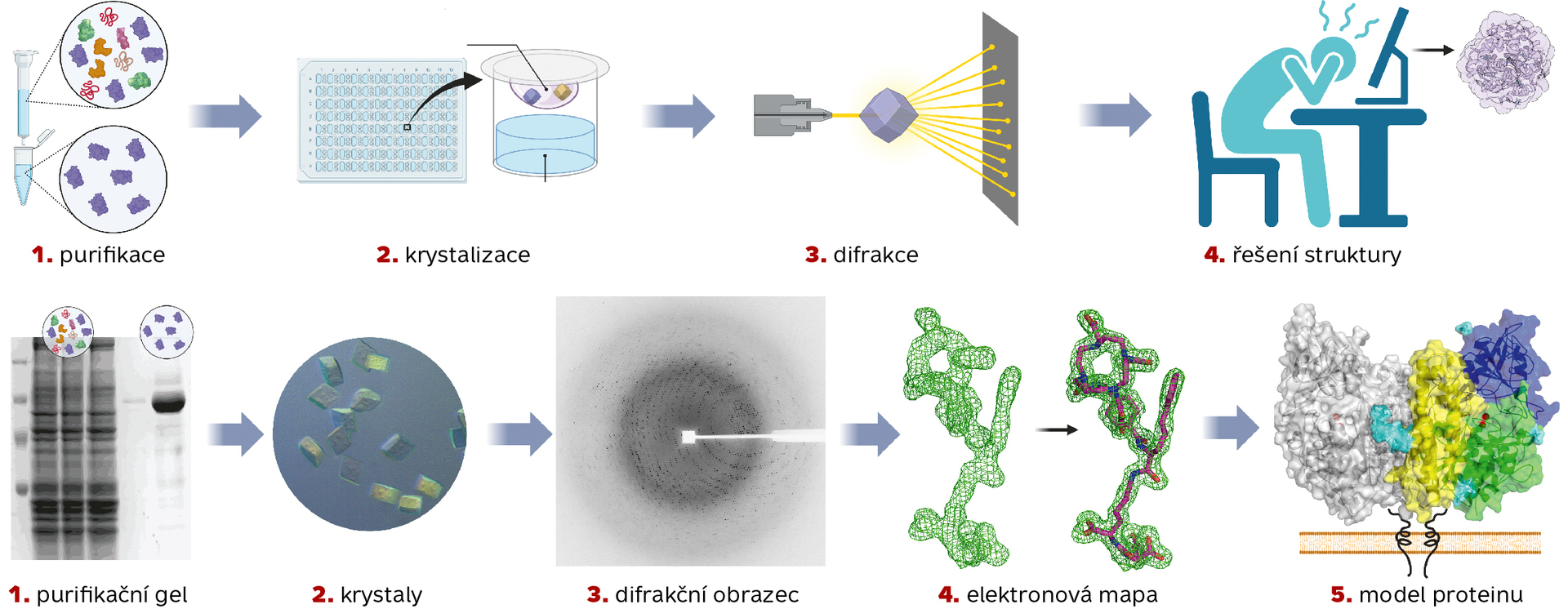
Strukturní biologie, především rentgenová krystalografie, má rovněž zásadní význam ve vývoji nových léků. Jak takový proces vlastně probíhá? S využitím postupů molekulární biologie a proteinového inženýrství je třeba nejprve připravit cílový protein (například PSMA) zbavený všech nečistot a „ve velkém množství“ (což v tomto případě znamená přibližně tisícinu gramu čistého proteinu). Cílový protein se smíchá se studovanou molekulou (léčivem) a v kapičkách o objemu miliontiny litru se krystalografové pokoušejí navodit podmínky, které by vedly k vzniku mikroskopických krystalů (viz obr.).
Krystalizace většinou zahrnuje testování tisíců různých krystalizačních podmínek a jejich následnou optimalizaci. Proces může trvat týdny, měsíce nebo i roky. Jakmile jsou získány kvalitní krystaly, jsou při teplotě –200 °C vloženy do intenzivního svazku rentgenových paprsků. Paprsky se na krystalu rozptýlí a vytvořený difrakční obrazec je zaznamenán na detektoru. Matematickými operacemi pak lze z difrakčních dat vytvořit mapu elektronové hustoty, která odhaluje polohy atomů uvnitř krystalu (obr.).
Posledním krokem je využití této mapy k vytvoření detailního modelu (struktury) komplexu proteinu s ligandem (léčivem). Model umožňuje pochopit, které části proteinu jsou důležité pro vazbu léčiva a jakým způsobem by bylo možné léčivo „racionálně“ optimalizovat. Rentgenová strukturní analýza tedy zásadním způsobem zjednodušuje a zefektivňuje proces SAR optimalizace a rovněž zvyšuje šance na úspěšný vývoj účinných a bezpečných léčiv.
Minulost a budoucnost PSMA
Příběh PSMA se začal psát v roce 1989, kdy byl tento protein rozpoznán jako značka identifikující nádory prostaty. V polovině devadesátých let byly syntetizovány první sloučeniny na bázi močoviny, které jsou základem naprosté většiny léčiv používaných v současnosti a první struktura komplexu PSMA s malou molekulou byla publikována v roce 2005. Dnes je v proteinové strukturní databázi deponováno okolo stovky struktur, které jsou a budou aktivně využívány k návrhu nových generací léčiv specifických pro PSMA.
Vedle vývoje nových generací malých molekul jsou v oblasti terapie nádorů prostaty testovány také jiné moderní přístupy, jako je například buněčná imunoterapie (využití geneticky modifikovaných buněk rozpoznávajících PSMA na povrchu nádorů) nebo kombinované imunoterapie a radioterapie. V oblasti onkologie je rovněž zcela zásadním zjištěním, že PSMA je nadměrně exprimován i na nově vytvořených kapilárách zásobujících pevné nádory jiných typů (nádory prsu, renální karcinom, glioblastomy). Toto zjištění rozšiřuje možnosti využití již existujících diagnostických a terapeutických látek pro další onkologická onemocnění.
Zdá se tedy, že látky cílené na PSMA ještě ani zdaleka nevyčerpaly svůj potenciál. V blízké budoucnosti se pravděpodobně můžeme těšit na nové objevy a inovativní strategie využitelné k léčbě širokého spektra onkologických onemocnění.
Ke stažení
 článek ve formátu pdf [557,17 kB]
článek ve formátu pdf [557,17 kB]
O autorovi
Cyril Bařinka