Alzheimerova nemoc
Může původní vysvětlení značně komplexní „nemoci“ obstát po více než 110 letech uprostřed dravého vývoje vyšetřovacích technik? Je možné, že jasnozřivost Aloise Alzheimera na začátku minulého století definovala novou „nemoc“ způsobem, který je aktuálním vodítkem ještě ve století dalším? Výzkum nás bombarduje takovými poznatky, že původní, poměrně jednoduchý konstrukt již neobstojí.
Denně vychází na světě přes 100 publikací šermujících s pojmem „Alzheimerova choroba“. Obáváme se, že významy různých slov se přenášejí do nepřesně stanovených sémantických kategorií, a pokusíme se nabídnout příklady, kde k sémantické diverzi dochází. Současně ukážeme, že stařecký propad mentální výkonnosti, zhoršení paměti, úsudku i duševní iniciativy je nezbytně důsledkem několika kategorií zákonité mozkové deteriorace, pro niž Alzheimerova histologická pozorování již dávno k vysvětlení nestačí. Koncept uctívající Alzheimerovu nemoc jako nozologickou (chorobnou) jednotku, se tak ukáže jako kontraproduktivní.
Aplikace diagnózy „Alzheimerova nemoc (AN)“ je nadále úspěšná jen proto, že se lehkomyslně používá pro jakýkoli případ progresivní stařecké demence. Výchozí definicí „Alzheimerovy nemoci“ byla trias koexistence demence s jejími dvěma údajnými příčinami: amyloidními plaky a malformovanými neurofilamenty tau proteinu. Tato definice ukládala jako kritérium „definitivní diagnózy AN“, že musí být doložena pitvou s průkazem těchto histologických změn. Autoři však tato kritéria nedodržují a pitevní důkaz ignorují. Heiko Braak, světově uznávaný histologický znalec, autor popisů progrese plaků a neurofibrilárních klubíček v mozkové tkáni, poznamenal, že kdyby autoři článků o AN dodržovali řádnou definici, scvrkla by se jejich literatura pod 1 %.
Rozvoj a zánik duševních schopností v etapách života
Zadání pro lidský život vychází z fáze rozvoje fyzických a duševních schopností, fáze jejich plného využití v dospělosti a z fáze postupného zániku ve stáří. Takto byl život znám po staletí a také chápán většinou filozofů:
- Pythagoras (582–507 př. Kr.): 5 fází života, poslední dvě jsou senium: systém se vrací k imbecilitě první epochy svého dětství.
- Hippokrates (460–377 př. Kr.): Duševní rozpad je nevyhnutelným důsledkem stáří, provázeného rostoucí disproporcí tekutin, způsobující tělo chladným a suchým.
- Aristoteles (384–322 př. Kr.): Stárnutí je neodmyslitelné od klesajícího myšlení… Staří lidé nemají být jmenováni do vlády, neboť jsou otupeni mentální deteriorací a stěží mohou plnit svou funkci.
- Galén (150–200): „Morosis“ typicky vzniká ve vyšším věku… znalost písma a jiných umění se zcela uzavře; vskutku si někteří nevzpomenou ani na své jméno.
Výraz „senilní“, původně užívaný pro pokročilý věk, získal tak u starých Řeků a Římanů význam „dementní“ [1] a pozorování chorobných stavů starých lidí vyústilo i v přesvědčení „Senectus ipsa morbus est“ (Již samo stáří je nemoc). Nezadržitelné opotřebování živé hmoty v průběhu života charakterizoval v 18. století také průkopník fyziologie Claude Bernard: „Život je současně smrtí organické substance, což znamená, že buňka nemůže přežívat jinak než stálým postupem k smrti.“
Tempo a dílčí procesy stařeckého duševního rozpadu srovnal s náborem duševních sil v dětství ve své práci z roku 1999 Barry Reisberg. [2] Ztráty z rozvíjející se demence jsou zde popsány jako zrcadlový obraz rozkvětu v dětství. Maturace behaviorálních dovedností dítěte, měřená testy Functional Assessment Staging a Brief Cognitive Rating Scale odpovídá časovými úseky jejich zániku ve stáří. Například ovládnutí stravy příborem ve stáří recipročně zaniká v průběhu analogických 1,5–3 let. Kvality kognice, kogitace i procedurální paměti zrají v dětství a rozpadají se ve stáří za současných klinických změn v reflexech, v tonických změnách postury a ve změnách rychlosti a kapacity objektivních fyziologických testů. Nejen to; mění se progresivně a posléze regresivně stav myelinizace (obaly nervových vláken) nervových drah, obsah některých sloučenin v mozkové tkáni nebo signály tkáně v magnetické rezonanci a skenech CT.
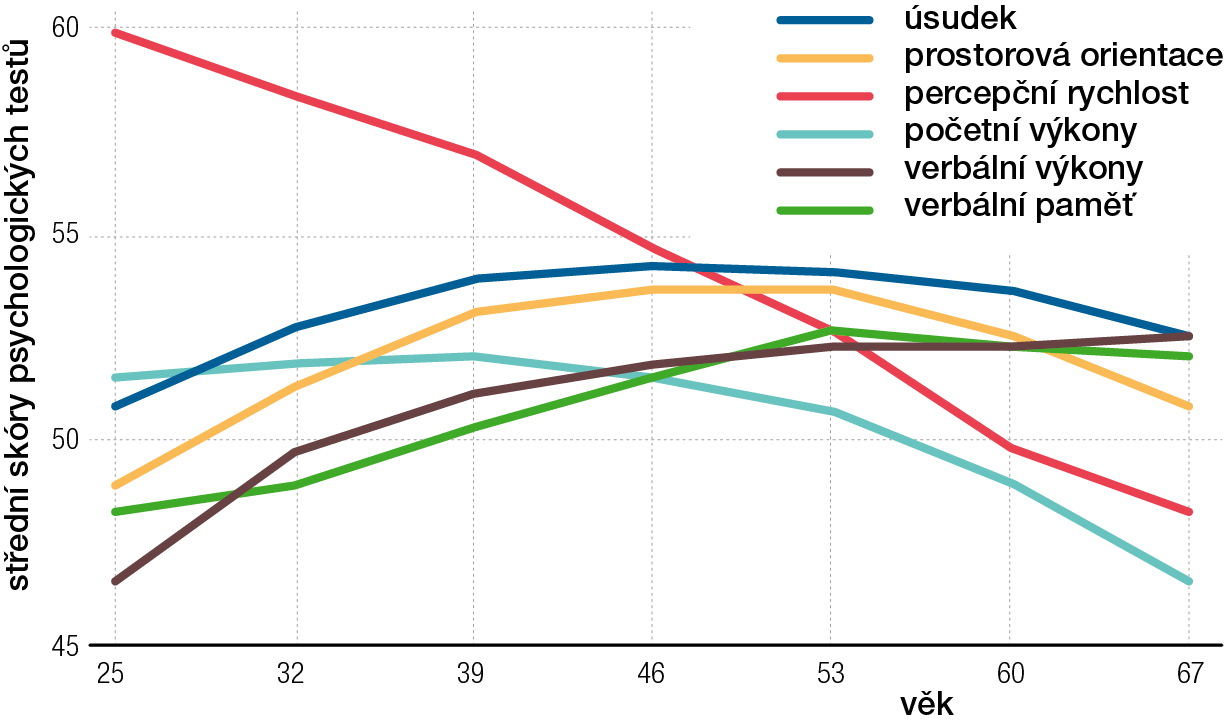
Měření mentální výkonnosti testy paměti, verbální a numerické zdatnosti, úsudku a percepční rychlosti jednoznačně dokládá nábor těchto kvalit do 40 let a jejich snížení po roce 65 ([3], obr. 1). Samozřejmé lidské zkušenosti z těchto etap života se také přizpůsobuje běžně uznávaná psychometrika. Ve snaze přidělit jednotlivci celoživotně platný inteligenční kvocient (IQ) aplikují psychologové na jedince pod 40 let redukci naměřených hodnot (věkový debit) a na jedince po padesátce zvýšení hodnot s narůstajícím věkem (věkový kredit). Tím pomíjejí hodnoty absolutní a relativizují je k věku. V tom je opět obsaženo samozřejmé vnímání životních zákonů. Stářím trpí inteligence tekutá (bohatost a rychlost asociací a transmisí) i inteligence krystalická (bloky paměťových depozit – elementární i komplexní).
Výše uvedený výklad zákonitého zániku je v rozporu s dnešní široce pěstovanou teorií, že většina lidí stárne zdravě, a ti, kteří duševně chátrají, jsou postiženi „nemocí“. Svádí k tomu docela pochopitelně fakt, že stařecká demence nastupuje u každého v jiném věku. Někteří jsou tedy v daném okamžiku postiženi lehce, trpí mírnou kognitivní poruchou (mild cognitive impairment), která může, ale nemusí přejít do plné demence. Těch má být nad 65 let věku mezi zdravou populací 15–20 %. S Alzheimerovou demencí mají žít v USA ve věku 65–74 let 3 % lidí, ve věku 75–84 již 17 % a ve věku nad 85 let 32 % lidí. [4] O tom, u koho mírná kognitivní porucha přejde do demence a u koho ne, rozhoduje většinou termín smrti, která se dostaví ze selhání jiných tělesných systémů či z úrazu.
Zmatky v terminologii
Jedno ze sémantických nedorozumění označuje toto onemocnění za „sporadickou AN“, tedy vzácnou, na rozdíl od „presenilní AN“, založené geneticky. Označení „sporadický“, vzácný, používají mnozí autoři jedním dechem s bombastickými prohlášeními, že nastává světová pandemie a že choroba nastupuje jako „the biggest killer“ současné populace. „Contradictio in adjecto“ není však ojedinělým sémantickým skluzem v naší komunikaci. Většina publikací začíná papouškováním věty, že „Alzheimerova nemoc je postupná ztráta paměti a dalších kognitivních funkcí – to je řeči, exekutivních funkcí a dalších“. Ve skutečnosti paměť nelze řadit mezi kognitivní funkce, protože je jejich podmínkou, nástrojem. Paměť jako unikátní fenomén zadržení povědomí o zážitku, který již neexistuje, kognici umožňuje. Kognice je zásadně jev percepční čili poznávací, jak ze slova vyplývá (scire – věděti, cognoscere – rozpoznávati). Výraz kognitivní se u nás objevil asi před 25 lety jako adjektivum, o 5 let později se pak rozvinul i v substantivum; dosud však nedosáhl slovesa, které se v anglické literatuře již vyskytuje (cognize, cognizing). Exekutivní funkce jsou opakem kognice, protože jsou výstupem z lidské úvahy, která kognici zpracovala kogitací a odpověděla následnou exekucí. Kognice spočívá ve srovnání nového senzorického vjemu (zrakového, sluchového, taktilního, čichového či chuťového) s předchozími depozity paměti. Toto srovnání produkuje zážitek „aha“. Řeč je fenoménem podstatně složitějším, doménou nadřazenou, protože využívá jak kognitivních, tak kogitačních i exekutivních složek ve své fázi chápání řeči (kognice), fázi endofázie (vnitřního přešeptání – součást kogitace) a fázi produkované řeči (exekuce).
Amyloid jako původce nemoci?
K této otázce byli zdrženliví původní svědomití badatelé již před 110 lety. Jak Alois Alzheimer, tak jeho spolupracovník Gaetano Perusini i jejich pražský rival Oskar Fischer se stavěli k patogenezi amyloidu zdrženlivě. Alzheimer zkoumal čtyři pacienty a na jejich demenci byl podstatný presenilní nástup. Proto byl zdrženlivý k používání nálezu amyloidních plaků a neurofibrilárních klubíček jako vysvětlení pro případy demence senilní: „Vzniká proto otázka, zda případy nemoci, které jsem pokládal za pozoruhodné, jsou dostatečně odlišné klinicky nebo histologicky, aby byly rozlišovány od senilní demence, nebo zda mají být započteny do této rubriky.“ [5] Ve stejnou dobu jako Alzheimer publikoval Oskar Fischer v Praze desítky svých pitvaných případů; amyloidní plaky nazýval pro jejich voštinovitý vzhled „drusige Wucherung“ nebo „Sphaerotrichia“. V polemice s Alzheimerem cituje jeho text: „Následuje otázka, zda drúzy, nebo jak je Fischer nazývá Sphaerotrichia, mají být pokládány za příčinu plně specifické, klasifikovatelné a klinicky diagnostikovatelné psychózy. Jsou případy nepochybné dementia senilis, u nichž drúzy nejsou příliš početné… Dále nacházíme v lokalizacích, kde v kortexu žádné drúzy nejsou, rozptýlené známé senilní změny: sklerotické tukově pigmentované znetvořené gangliové buňky, změny v jejich fibrilách… degenerativní změny v cévní stěně, které nemůžeme interpretovat jako způsobené drúzami… Našli jsme změny v bazálních gangliích, mozečku i prodloužené míše vzdor chybějícím drúzám… Tak musíme dojít nakonec k závěru, že drúzy nejsou původcem senilní demence, ale pouze doprovodným jevem senilní involuce centrálního nervového systému.“
Všichni tito badatelé tedy připouštěli, že amyloid může být materiálem provázejícím stárnutí, ale jeho škodlivost pro mozkovou tkáň není potvrzena. Teprve John Hardy popsal v roce 1992 [6] „amyloidovou kaskádu“ a označil tento vývoj za patognomický, čímž rozpoutal široké patologicko-anatomické bádání i experimentální výzkum amyloidu. Jednou z koncovek tohoto výzkumu byly studie na potlačení mozkového amyloidu u lidí vakcinací, které však skončily naprostým neúspěchem. Řada prací v 21. století zpochybňuje na základě sledování mozkového amyloidu pozitronovou tomografií v korelaci s psychologickými testy jejich souvislost. [7, 8, 9]
Histologické změny ve stárnoucím mozku
Správný pohled na stařecký zmar duševních funkcí vyžaduje znalost histologických změn, které pokročilý věk provázejí. Alzheimerovská doktrína říká, že je to ukládání amyloidu do plaků v extracelulárním prostoru a dystrofie neurofibril uvnitř nervových buněk. Dokud byly tyto poznatky závislé výhradně na pitevních nálezech, byly generalizace poměrně obtížné. Od objevu pozitronové emisní tomografie (PET) s možností detekce amyloidu za živa se poznání kvantity jeho depozit dá dobře srovnávat se stavem psychické výkonnosti v testech. Epocha posledních 15 let tak učí tři zásadní poznatky: amyloid se v různé intenzitě hromadí v mozcích všech starších lidí, jeho množství s mírou demence koreluje nesoustavně a jeho lokální intenzita v jednotlivých mozkových lalocích často nesouhlasí s jinými parametry mozkové tkáňové deteriorace (jako jsou atrofie nebo snížení metabolismu). Dosavadní představa o toxicitě amyloidu ztrácí proto na důvěryhodnosti. Za předpokladu toxického vlivu amyloidu by měla intenzita úbytku mozkové hmoty (atrofie) a snížený metabolismus tkáně (snížená konzumpce glukózy v PET) korelovat s nejpostiženějšími zónami. To u mnoha lidí neplatí. [10]
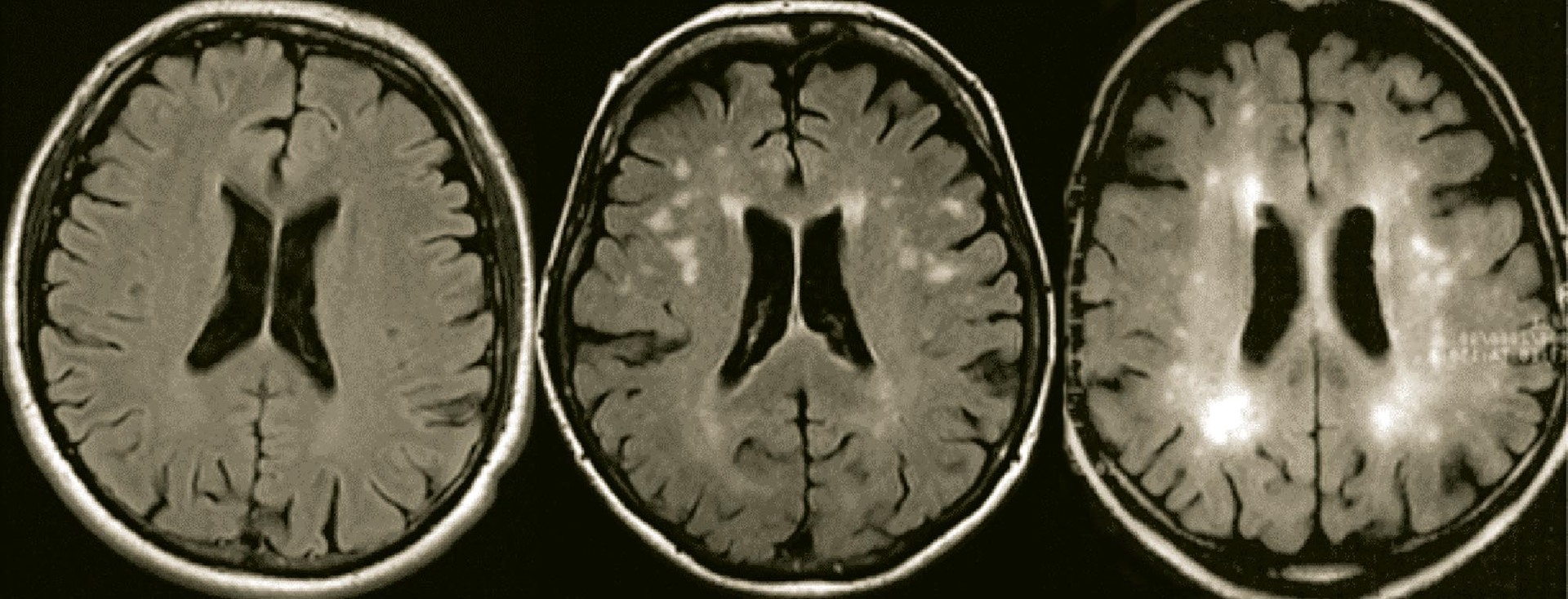
Kromě amyloidu a neurofibrilárních klubíček provází tedy stárnutí mozku také atrofie a snížení metabolismu glukózy. K těmto parametrům, studovaným již přes 40 let, se připojují v našem století nová zjištění. V magnetické rezonanci (obr. 2) je dobře patrná progresivní leukoaraióza neboli řídnutí bílé hmoty mozkové, které je projevem nedostatečného průtoku krevního rigidními stařeckými aterosklerotickými tepnami. Mnozí kategorizují tento projev jako „vaskulární demenci“ – na rozdíl od neurodegenerativní, avšak leukoaraióza se všemi cévními změnami postihuje ve vyšším věku každého.
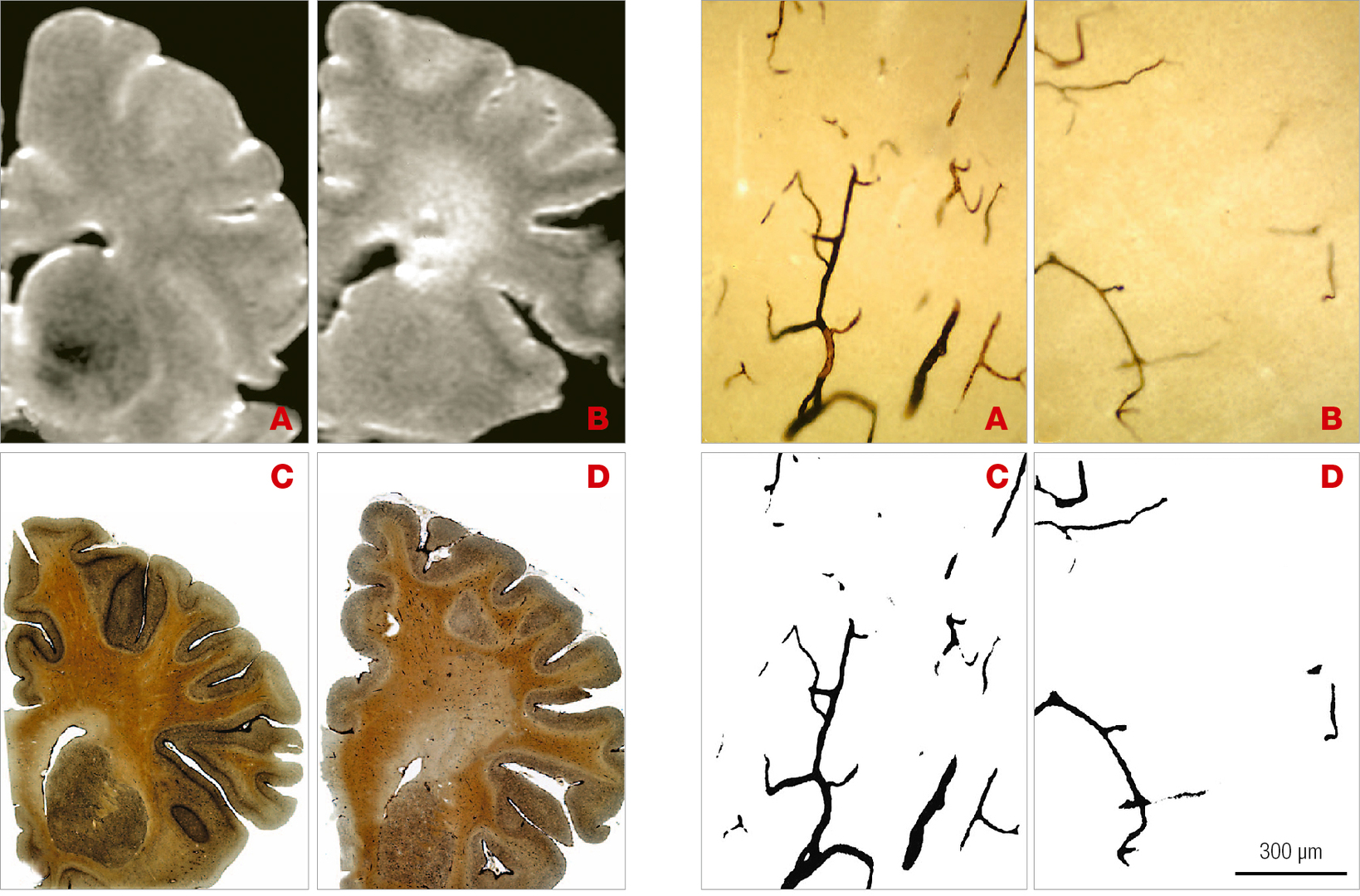
Histologické studie dokumentují, že vysokosignální ložiska leukoaraiózy na magnetické rezonanci vyplývají z částečných přidušení bílé hmoty mozkové při fluktuacích krevního zásobení, pohybujícího se na hraně potřebných hodnot. Kromě omezení toku ve velkých aterosklerotických cévách se na nich podílí také snížení kapilární denzity v mozkové tkáni (obr. 3).
Nemoc, nebo stáří?
Z hlediska sémanticko-filozofického je důležité, a to je též účelem našeho článku, rozlišit nemoc od zákonitých změn, které provázejí náš život nevyhnutelně. Je zde zajisté jedna matoucí okolnost, že totiž lidé prožívají své selhání jednotlivých funkčních systémů, způsobené stárnutím, v různém věku. A to je zdroj nedorozumění, které ve výkladu pojmu „nemoc“ často nastává. Chceme-li strašit lidi, můžeme je nazývat nemocnými; nechceme-li je strašit, lze je řadit mezi účastníky společného stárnutí, které v různé intenzitě postihne každého jako daň za dlouhý a úspěšný život. Označením „morbus Alzheimer“ se může starý člověk cítit nespravedlivě „postižen nemocí“, kterou „dostal“. Některé varovné články tvrdí, že např. v USA „postihne“ Alzheimerova nemoc nového jedince každých 66 sekund. V roce 2050 to prý bude již každých 33 sekund. Mnozí lidé se děsí, že to je horší než mor ve středověku.
Vědci proto naznačují, že je potřeba poznat nemoc v jejích co nejčasnějších stadiích. Pak totiž prý bude naděje, že se léčba nasadí včas a celý problém se odvrátí. Na včasné vědomí o nemoci se orientují mnozí entuziasti, kteří se dostali k informaci, že markery „AN“ se dají rozpoznat ve značném předstihu: snížený amyloid a zvýšené hladiny proteinu tau v mozkomíšním moku nebo zvýšený amyloid v mozkové PET. Dešifrovat budoucí nemocné s AN má tak být možné ve velkém předstihu. Současně se na základě takových zjištění debatují návrhy, zatím relevantní pro výzkum: oficiální doporučení NIH-AA (National Institutes of Health, alzheimerovská asociace) z Bethesdy doporučuje přidělit diagnózu AN na základě markerů i lidem, u nichž žádné stopy demence nejsou ještě patrné. [11, 12]
Vizi o preklinickém odhalování budoucích alzheimerovských případů značně kazí jejím propagátorům článek Heiko Braaka, který propitval 2332 mozků lidí ve věku 0–100 let. Ukázal, že přítomnost amyloidu lze nalézt běžně již ve věku 40 let a první abnormálně fosforylovaný tau protein (neurofibrilární klubíčka) již dokonce v druhé dekádě života. [13] Kritici konceptu AN jako nemoci mohou proto argumentovat, že kandidátem na AN ve stáří je každý člověk. [14] Jakkoli je teorie amyloidové kaskády světovou neurovědní komunitou široce uznávána, postupně ji rozvracejí nové a nové práce, kde intenzita amyloidu a intenzita demence nekorelují. [15, 16] Navíc lze amyloidní depozita nacházet také u lidí s „non-alzheimerovskou“ klasifikací jejich demence. Nacházejí se například u 66 % osob s progresivní supranukleární obrnou (PSP), u 57 % parkinsoniků, u 40 % Huntingtonovy choroby i u nemocných s tzv. frontotemporální demencí. V depozici amyloidu lze tak spatřovat různé formy stárnutí; z nich vyvozované jednotky nemocí se pak jeví jako umělé. [17]
Kardinální otázkou hodnou filozofické pozornosti je tedy dichotomie mezi nemocí a znehodnocením života věkem. Nemoci se dostávají, stáří se trpí či prodělává. Historicky byly nemocí míněny stavy, které určitého jednotlivce postihnou v určitém věku, uprostřed jeho zdravých vrstevníků. Koncept „nemoci“ se začal ujasňovat teprve od 18. století, když příčina patologického stavu mohla být objasněna a délka nemoci a její uzdravování mohly být soustavně registrovány. S poznáním bakteriálních a virových příčin nemoci se dále utvrdil. Koncept nemoci také zohlednil náhlé příčiny úrazové a s poznáním maligních chorob se dále modifikoval. U chorob neurodegenerativních se toto pojetí střetává s opotřebováním životem. Jestliže prevalence „nemoci“ ve věku 85 nebo 90 let dosahuje v populaci 50 %, nesplňuje již tento stav věcí kritéria člověka postiženého v prostředí ostatních individuální mimořádností. [18]
Blumenthal ve své skvělé revue [19] upozorňuje jednak na „procesy“ stárnutí, jednak na „etiologie“ nemocí. Nesnáz jejich diferenciace se potvrzuje i v Ciceronově traktátu Cato Maior de senectute, totiž že stáří je nevyléčitelná nemoc. Pod nemocí si představujeme indispozici, která člověka ve vyrovnaném stavu překvapí jako neočekávané zhoršení zdravotní kondice. V případě dlouhodobého účinku zevních sil (jako jsou infekce a úrazy akutně nebo rizikové faktory – kouření, inhalace toxinů, vibrace apod.) je tato kategorizace snadná. V případě poruchy genetického programu, jako jsou maligní choroby, je kategorizace „nemoci“ obtížnější, ale stále ještě relativně zažitá. V případě poklesu fyziologické výkonnosti ve stáří se však hranice mezi nemocí a stárnutím stírá. Vyzývá k diferenciaci mezi degenerativními změnami normálního stárnutí a „ageing-associated diseases“.
Výstižnými kritérii stárnutí je Strehlerových 5 bodů z roku 1977: univerzalita, progresivita, vnitřní zakotvení (intrinsicality), ireverzibilita a genetické programování. [19, 20] Progresivní deteriorace všech mozkových funkcí je našemu pokročilému věku vlastní (kromě „alzheimerovských“ změn) i v mnoha dalších histologických podobách: rostoucí počet mikroinfarktů a mikrokrvácení, kterých si při jejich milimetrovém rozměru není postižený ani vědom, rostoucí difuzivita tkáně, klesající anizotropie tkáně mozku, atrofie, apoptóza, hypometabolismus, leukoaraióza, změny v biochemických proporcích fosfoetanolaminu, fosfocholinu a dalších, ukazující společně na kombinovaný dopad všech procesů stárnutí.
Podobně jako my i řada autorů dospívá k narůstající pochybnosti o smyslu „Alzheimerovy nemoci“ jako nozologické nálepky na stařeckou demenci. [21-23] Jeví se nám proto praktičtějším studovat jednotlivé složky stařecké degradace mozkových funkcí separátně a nelpět na strašení lidí nadcházející pandemií jakési konvenční nemoci. [24]
Literatura
[1] Berchtold N. C., Cotman C. W.: Evolution in the conceptualization of dementia and Alzheimer’s disease Greco-Roman period to the 1960s. Neurobiology of aging 19, 173–189, 1998/3.
[2] Reisberg B., Franssen E. H., Hasan S. M. et al.: Retrogenesis: clinical, physiologic and pathologic mechanisms in brain aging, Alzheimer’s and other dementing processes. Eur. Arch. Psychiatry Clin. Neurosci. 249, Suppl 3, III/28–III/36, 1999.
[3] Schaie K. W.: The course of adult intellectual development. American Psychologist 49, 304–313, 1994.
[4] Alzheimer’s Association: Alzheimer’s Association report: 2017 Alzheimer’s disease facts and figures. Alzheimer’s Dement 13, 325–373, 2017/4, DOI: 10.1016/j.jalz.2017.02.001.
[5] Garett M. D., Valle R.: A century of confusion in researching Alzheimer’s disease. International J. Healthcare 2, 13–22, 2016/2.
[6] Hardy J. A., Higgins G. A.: Alzheimer’s disease, the amyloid cascade hypothesis. Science 286, 184–185, 1992, DOI: 10.1126/science.1566067.
[7] Frey K. A.: Amyloid imaging in dementia: Contribution or confusion. J. Nucl. Med. 56, 331–332, 2015.
[8] Neuropathology Group of the Medical research Council Cognitive Function and Ageing Study (MRC CFAS). Pathological correlates of late-onset dementia in a multicentre community-based population in England and Wales. Lancet 357, 169–175, 2001.
[9] Kalvach P., Kupka K., Vogner M.: Je amyloid podstatný pro senilní demenci? Česk. Slov. Neurol. N. 81, 164–170, 2018/2.
[10] Knopman D. S., Jack C. R., Wiste H. J. et al.: Brain injury biomarkers are not dependent on β-amyloid in normal elderly. Ann. Neurol. 73, 472–480, 2013/4.
[11] Jack C. R., Benett D. A,. Blenow K., Carrillo M. C., Dunn B., Haeberlain S. B. et al.: NIA-AA Research Framework: Toward a biological definition of Alzheimer’s disease. Alzheimer’s & Dementia 2018, DOI: 10.1016/j.jalz.2018.02.018.
[12] Largent J. A., Karlawish J.: Preclinical Alzheimer Disease and the dawn of the pre-caregiver. JAMA Neurology 76, 631–632, 2019/6.
[13] Braak H., Thai D. R., Ghebremedhin E. at al.: Stages of the pathologic process in Alzheimer’s disease: Age categories from 1 to 100 years. J. Neuropathol. Exp. Neurol. 70, 960–969, 2011/11.
[14] Garett M. D.: A critique of the 2018 National Institute on Aing’s Research Framework: Toward a biological definition of Alzheimer’s disease. Curr. Neurobiol. 9, 49–58, 2018/1.
[15] Rowe C. C., Ellis K. A., Rimajova P. et al.: Amyloid imaging results from the Australian Imaging, Biomarkers and Lifestyle (AIBL) study of aging. Neurobiology of aging 31, 1275–1283, 2010.
[16] Jagust W. J., Landau S. M., Shaw L. M. et al.: Relationships between biomarkers in aging and dementia. Neurology 73, 1193–1199, 2009.
[17] Mann D. M., Jones D.: Deposition of amyloid (A4) protein within the brains of persons with dementing disorders other than Alzheimer’s disease and Down’s syndrome. Neurosci. Lett. 109, 68–75, 1990 /1–2.
[18] Chen M., Fernandez H. L.: Alzheimer movement re-examined 25 years later. Is it a “disease” or a senile condition in medical nature? Frontiers in Bioscience 6, 30–40, 2001.
[19] Blumenthal H. T.: The aging-disease dichotomy: True or false? J. Gerontology: MEDICAL SCIENCES 58A, 138–145, 2003/2.
[20] Thung P. J.: The relation between amyloid and ageing in comparative pathology. Gerontologia 1, 234–254, 1957.
[21] Peng F. C. C.: Does Alzheimer’s disease really exist? Ho-Chi Book Publishing Co, Taipei 2008, 128 pp.
[22] Peng F. C. C.: Alzheimer’s Disease. What is it after all? Ho-Chi Book Publishing Co, Taipei 2012, 94 pp.
[23] Stolze C.: Vergiss Alzheimer. Die Wahrheit über eine Krankheit, die keine ist. Kiepenheuer&Witsch, Köln 2011, 250 pp.
[24] Kalvach P., Vogner M.: Parting with the concept of Alzheimer’s disease in senium. OBM Geriatrics 3, 2019/3, DOI: 10.21926/obm.geriatr.1903060.
Ke stažení
 článek ve formátu pdf [592,02 kB]
článek ve formátu pdf [592,02 kB]