Retrovirus
Retroviry mají špatnou pověst. Může za to především virus lidské imunodeficience HIV-1, který vyvolává syndrom AIDS, popsaný před více než 30 lety. Ale ani ostatní členové rodiny retrovirů nejsou žádná neviňátka. Viry HTLV-1 a HTLV‑2 způsobují endemické leukemie, ptačí leukosové viry ALV-J decimují drůbeží chovy v Číně a jihovýchodní Asii, na postupu je též virus EIAV způsobující chudokrevnost u koní. A již před více než sto lety byly objeveny sarkomové viry kuřat, ke kterým se postupně přiřadily sarkomové a leukemické viry myší, krys, opic, koček a krav. Na několika kapitolách ze současného výzkumu retrovirů v Ústavu molekulární genetiky lze ukázat nejen snahu o potlačení retrovirových infekcí, ale také možnosti, jak retroviry přetvořit v užitečné pomocníky. Ochočení retrovirů není jen plodem lidského ducha, evoluce s retroviry pracuje odedávna.
Současnost antiretrovirové terapie
 Virem HIV-1 se nakazí po celém světě denně asi 7 tisíc lidí. Osudy infikovaných lidí se ale velmi liší podle toho, zda žijí v chudé rozvojové zemi nebo naopak v zemi s fungujícím zdravotnickým systémem a přístupem k moderním antiretrovirovým léčivům. Ti první většinou trpí postupným úpadkem imunitního systému, který nakonec vyústí v celkové selhání imunity a sekundární infekce nejrůznějšími příležitostnými patogeny. Těm druhým lékař co nejdříve po zjištění infekce ordinuje antiretrovirovou léčbu nízkomolekulárními nebo peptidovými látkami, které účinně blokují virové enzymy a zamezují replikaci viru. Při dodržování léčebného režimu je obvyklé, že virus z krevního oběhu vymizí, přesněji řečeno jeho hladina v krvi se sníží pod 50 virových částic na ml, což je mez detekce běžnými metodami. V tomto stavu mohou infikovaní pacienti přežívat mnoho let, aniž by u nich vypuklo onemocnění AIDS, v současnosti máme zkušenost s antiretrovirovou terapií trvající 15 let i více. V rozvinutých zemích se infekce HIV mění v chronickou záležitost a úmrtí na AIDS nejsou běžná. Problém představují i nadále vedlejší účinky antivirové léčby.
Virem HIV-1 se nakazí po celém světě denně asi 7 tisíc lidí. Osudy infikovaných lidí se ale velmi liší podle toho, zda žijí v chudé rozvojové zemi nebo naopak v zemi s fungujícím zdravotnickým systémem a přístupem k moderním antiretrovirovým léčivům. Ti první většinou trpí postupným úpadkem imunitního systému, který nakonec vyústí v celkové selhání imunity a sekundární infekce nejrůznějšími příležitostnými patogeny. Těm druhým lékař co nejdříve po zjištění infekce ordinuje antiretrovirovou léčbu nízkomolekulárními nebo peptidovými látkami, které účinně blokují virové enzymy a zamezují replikaci viru. Při dodržování léčebného režimu je obvyklé, že virus z krevního oběhu vymizí, přesněji řečeno jeho hladina v krvi se sníží pod 50 virových částic na ml, což je mez detekce běžnými metodami. V tomto stavu mohou infikovaní pacienti přežívat mnoho let, aniž by u nich vypuklo onemocnění AIDS, v současnosti máme zkušenost s antiretrovirovou terapií trvající 15 let i více. V rozvinutých zemích se infekce HIV mění v chronickou záležitost a úmrtí na AIDS nejsou běžná. Problém představují i nadále vedlejší účinky antivirové léčby.
 Podmínkou vývoje antiretrovirové terapie bylo poznání životního cyklu retrovirů a pochopení jejich vztahů s hostitelskou buňkou (viz rámeček na protější straně). Zásadní bylo studium retrovirů u slepic a myší v šedesátých letech a lvím podílem tehdy přispěl výzkum prováděný v našem ústavu týmem Jana Svobody. Bylo velikým triumfem vědy, když teoretické poznatky mohly být v osmdesátých letech přímo využity pro objev a charakterizaci viru HIV jako původce AIDS. S vědomím, že HIV je retrovirus, již bylo zhruba jasné, jak s ním bojovat – je možné omezit jeho vstup do buňky přes specifické povrchové receptory, reverzní transkripci, integraci do DNA v buněčném jádře, zpracování virových bílkovin a sestavování virových částic. Jako první cíle byly vybrány virové enzymy reverzní transkriptáza a proteáza a příprava specifických inhibitorů již byla úkolem pro organickou syntézu. U nás je všeobecně znám fenomenální úspěch virostatik z laboratoře Antonína Holého Ústavu organické chemie a biochemie. Zejména tenofovir, inhibitor reverzní transkriptázy, je klinicky využíván od r. 2001 a v kombinaci s novějšími látkami představuje podstatnou část celosvětového trhu s virostatiky.
Podmínkou vývoje antiretrovirové terapie bylo poznání životního cyklu retrovirů a pochopení jejich vztahů s hostitelskou buňkou (viz rámeček na protější straně). Zásadní bylo studium retrovirů u slepic a myší v šedesátých letech a lvím podílem tehdy přispěl výzkum prováděný v našem ústavu týmem Jana Svobody. Bylo velikým triumfem vědy, když teoretické poznatky mohly být v osmdesátých letech přímo využity pro objev a charakterizaci viru HIV jako původce AIDS. S vědomím, že HIV je retrovirus, již bylo zhruba jasné, jak s ním bojovat – je možné omezit jeho vstup do buňky přes specifické povrchové receptory, reverzní transkripci, integraci do DNA v buněčném jádře, zpracování virových bílkovin a sestavování virových částic. Jako první cíle byly vybrány virové enzymy reverzní transkriptáza a proteáza a příprava specifických inhibitorů již byla úkolem pro organickou syntézu. U nás je všeobecně znám fenomenální úspěch virostatik z laboratoře Antonína Holého Ústavu organické chemie a biochemie. Zejména tenofovir, inhibitor reverzní transkriptázy, je klinicky využíván od r. 2001 a v kombinaci s novějšími látkami představuje podstatnou část celosvětového trhu s virostatiky.
Vítězství nad virem HIV ale není zdaleka úplné. Ba naopak. U léčených pacientů sice není možno prokázat virus v krvi, je ale přítomen ve formě integrovaných provirů ve specializované populaci buněk, v tzv. paměťových buňkách, které v imunitním systému uchovávají informaci o patogenech, se kterými se organismus v průběhu života setkal. Tyto buňky žijí velmi dlouho a podmiňují např. celoživotní imunitu po očkování nebo prodělání dětských nemocí, jako jsou spalničky, příušnice nebo zarděnky. V paměťových buňkách je HIV přítomen v latentním stavu, to znamená, že se nemnoží ani netvoří virové bílkoviny. Může se ale pod vlivem různých stimulů aktivovat. A to je jádro problému. Vysadí-li HIV-pozitivní pacient antiretrovirovou léčbu, po několika týdnech, nanejvýše měsících, se obnoví původní hladina viru v krvi a léčba začíná opět od začátku. Situaci dále komplikují vedlejší účinky virostatik a existence rezistentních variant viru. Nelze nebrat zřetel ani na cenu terapie, která se při narůstajícím počtu doživotně léčených pacientů začíná vymykat možnostem zdravotnictví. Do budoucna je tedy nezbytně nutné vyvinout metody vedoucí ke skutečné léčbě infekce HIV a zničení rezervoáru latentního viru v paměťových a jiných buňkách.
Aktivace umlčeného viru
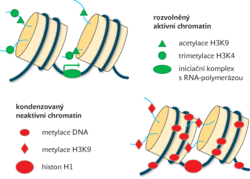
 Podstata latentního stavu HIV nebyla dlouho jasná. Teprve v posledních letech přinesla vysvětlení epigenetika, obor, který studuje dědičnost podmíněnou nikoli změnami genetické informace, ale modulací jejího vyjádření (genové exprese). Ukázalo se, že latentní proviry nemají změněnu nukleotidovou sekvenci, zato její přepis do RNA je neúčinný. Říkáme, že latentní HIV je transkripčně umlčen. Umlčené proviry se od aktivních provirů liší jednak metylací DNA v místech, kde začíná přepis do RNA, jednak metylací bílkovin histonového typu, které jsou s provirovou DNA sdruženy. Celkem osm histonových molekul vytváří globulární komplex, tzv. nukleozom, kolem kterého se obtáčí určitý úsek DNA. Některé aminokyseliny histonů mohou být doplněny o metylovou skupinu, ale mohou být též acetylovány, fosforylovány a jinak modifikovány. Kombinací těchto epigenetických značek je tvořen epigenetický kód, který rozhoduje o celkové transkripční aktivitě daného úseku DNA. Variabilita epigenetického kódu je dána i tím, že stejná modifikace různých aminokyselin může mít opačný vliv na transkripci, některé modifikace se mohou navzájem vylučovat, kombinace modifikací na sousedních aminokyselinách mohou mít vlastní význam a některé aminokyseliny mohou být modifikovány vícestupňově. Převládají-li v dané oblasti značky určitého typu, je DNA spolu s nukleozomy sbalena do struktur vyššího řádu a enzymy, které přímo či nepřímo zprostředkují transkripci do mRNA, nemají k regulovaným genům přístup. Jiné značky naopak strukturu DNA-histony rozvolňují a transkripci do RNA podporují (obr. 1). Epigenetické značky jsou primárně určeny k regulaci exprese buněčných genů a uspořádání genomu v buněčném jádře, v případě začlenění retroviru převezmou ovšem i jeho regulaci.
Podstata latentního stavu HIV nebyla dlouho jasná. Teprve v posledních letech přinesla vysvětlení epigenetika, obor, který studuje dědičnost podmíněnou nikoli změnami genetické informace, ale modulací jejího vyjádření (genové exprese). Ukázalo se, že latentní proviry nemají změněnu nukleotidovou sekvenci, zato její přepis do RNA je neúčinný. Říkáme, že latentní HIV je transkripčně umlčen. Umlčené proviry se od aktivních provirů liší jednak metylací DNA v místech, kde začíná přepis do RNA, jednak metylací bílkovin histonového typu, které jsou s provirovou DNA sdruženy. Celkem osm histonových molekul vytváří globulární komplex, tzv. nukleozom, kolem kterého se obtáčí určitý úsek DNA. Některé aminokyseliny histonů mohou být doplněny o metylovou skupinu, ale mohou být též acetylovány, fosforylovány a jinak modifikovány. Kombinací těchto epigenetických značek je tvořen epigenetický kód, který rozhoduje o celkové transkripční aktivitě daného úseku DNA. Variabilita epigenetického kódu je dána i tím, že stejná modifikace různých aminokyselin může mít opačný vliv na transkripci, některé modifikace se mohou navzájem vylučovat, kombinace modifikací na sousedních aminokyselinách mohou mít vlastní význam a některé aminokyseliny mohou být modifikovány vícestupňově. Převládají-li v dané oblasti značky určitého typu, je DNA spolu s nukleozomy sbalena do struktur vyššího řádu a enzymy, které přímo či nepřímo zprostředkují transkripci do mRNA, nemají k regulovaným genům přístup. Jiné značky naopak strukturu DNA-histony rozvolňují a transkripci do RNA podporují (obr. 1). Epigenetické značky jsou primárně určeny k regulaci exprese buněčných genů a uspořádání genomu v buněčném jádře, v případě začlenění retroviru převezmou ovšem i jeho regulaci.
 Transkripčně umlčené proviry HIV jsou charakterizovány především metylací DNA a devátého lysinu histonu 3. Není náhodou, že poznatky o epigenetické regulaci retrovirů přicházely nejdříve ze studia jednodušších virů, jako je kuřecí virus Rousova sarkomu, jehož transkripční umlčování v savčích buňkách je známo od sedmdesátých let. S poznáním epigenetické regulace exprese HIV se naskýtá možnost lékového ovlivnění a případné reaktivace latentního rezervoáru. Infikované buňky by zničila replikace aktivovaného viru, který ovšem nemůže infikovat další buňky díky zablokované reverzní transkripci a vyzrávání virových částic. Konečným výsledkem takové kombinované léčby by mohl být pacient zbavený latentního rezervoáru, u něhož se po vysazení antiretrovirové terapie již neobnoví replikace viru v krvi. Této představě nahrává fakt, že latentní HIV je v in vitro systémech aktivován působením nízkomolekulárních inhibitorů metylace DNA, histonové deacetylace a nověji též histonové metylace. A co víc, některé z nich jsou již pro aplikaci na člověku vyzkoušeny a schváleny pro léčbu onkologických onemocnění. Odpadá tedy zdlouhavé a finančně náročné testování bezpečnosti a dávkování. První slibné výsledky přinášejí probíhající klinické zkoušky s malým počtem pacientů a inhibitorem histonových deacetyláz vorinostatem.
Transkripčně umlčené proviry HIV jsou charakterizovány především metylací DNA a devátého lysinu histonu 3. Není náhodou, že poznatky o epigenetické regulaci retrovirů přicházely nejdříve ze studia jednodušších virů, jako je kuřecí virus Rousova sarkomu, jehož transkripční umlčování v savčích buňkách je známo od sedmdesátých let. S poznáním epigenetické regulace exprese HIV se naskýtá možnost lékového ovlivnění a případné reaktivace latentního rezervoáru. Infikované buňky by zničila replikace aktivovaného viru, který ovšem nemůže infikovat další buňky díky zablokované reverzní transkripci a vyzrávání virových částic. Konečným výsledkem takové kombinované léčby by mohl být pacient zbavený latentního rezervoáru, u něhož se po vysazení antiretrovirové terapie již neobnoví replikace viru v krvi. Této představě nahrává fakt, že latentní HIV je v in vitro systémech aktivován působením nízkomolekulárních inhibitorů metylace DNA, histonové deacetylace a nověji též histonové metylace. A co víc, některé z nich jsou již pro aplikaci na člověku vyzkoušeny a schváleny pro léčbu onkologických onemocnění. Odpadá tedy zdlouhavé a finančně náročné testování bezpečnosti a dávkování. První slibné výsledky přinášejí probíhající klinické zkoušky s malým počtem pacientů a inhibitorem histonových deacetyláz vorinostatem.
Využití retrovirových vektorů
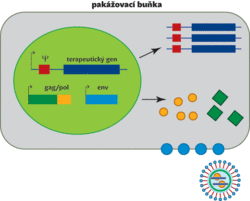
Podobně jako latentní proviry HIV mohou být epigeneticky umlčeny retrovirové vektory, které se používají pro přenos genů a které mohou v krajním případě posloužit ke genové terapii. Princip retrovirového vektoru je následující: geny kódující strukturní a enzymaticky aktivní virové bílkoviny jsou nahrazeny genem, který má být vektorem přenesen, a ponechány jsou jen regulační sekvence a nekódující sekvence specificky rozeznávané při reverzní transkripci a sestavování infekčních virových částic. Chybějící virové bílkoviny jsou dodány z klonovaných virových genů a vyrobeny v tzv. pakážovacích buňkách, ve kterých je zároveň do rekombinantních virových částic „zabalen“ replikace neschopný genom retrovirového vektoru. Vzniklé virové částice jsou schopny infikovat cílovou buňku, včlenit se do jejího genomu a produkovat kýženou bílkovinu. Nejsou ale schopny vytvářet dceřiné virové částice a šířit se do buněk sousedních (obr. 2).
Praktickému využití retrovirových vektorů pro genovou terapii brání několik nedořešených problémů. Předně, retroviry se do DNA hostitelské buňky integrují téměř náhodně a mohou poškodit geny v cílovém místě. To nemusí být ten nejhorší genotoxický účinek, protože většina buněčných funkcí je zajištěna redundantně a buňka s vážně poškozeným esenciálním genem konec konců zahyne. Retrovirový vektor ale může ovlivňovat expresi genů poměrně vzdálených od místa integrace a není vyloučeno, že takto konstitutivně aktivuje geny indukující buněčné dělení. Vznikne tak buňka dělící se rychleji než ostatní, klonálně se namnoží na úkor ostatních buněk, časem nahromadí další mutace a přemění se v buňku nádorovou. Klonální expanze buněk s integrovaným vektorem byla pozorována in vitro a teoretické předpovědi se bohužel potvrdily i při klinické studii, při které byla retrovirovým vektorem léčena těžká kombinovaná imunodeficience vázaná na chromozom X. Toto onemocnění je podmíněno chybějícím genem pro adenosindeaminázu (ADA) a projevuje se absencí všech krvinek lymfoidní řady. Nabízí se odebrání kostní dřeně pacienta, dodání funkčního genu ADA retrovirovým vektorem a následná autologní transplantace takto upravených dřeňových buněk. Ačkoli tato léčba byla úspěšná a vedla zprvu k rekonstituci imunitního systému, po určité době se u několika pacientů objevily atypické leukemie a byla prokázána aktivace onkogenního genu LMO2 způsobená inzercí vektoru.
Druhým problémem je postupné vyhasínání léčebného efektu retrovirových vektorů. Stejně jako proviry HIV jsou i integrované proviry vektorů transkripčně umlčovány epigenetickými mechanismy a léčbu je v takovém případě třeba opakovat. Řešením je opatřit retrovirový vektor krátkou sekvencí DNA, která vektor ochrání před metylací a umlčením. V našich experimentech se nám osvědčilo včlenit do regulačních sekvencí vektoru krátký úsek buněčné DNA, tzv. ostrov CpG. Tím napodobujeme přirozenou situaci v genomu, kde ostrovy CpG udržují v aktivním nemetylovaném stavu geny potřebné pro běžný chod každé buňky. Chráněné vektory potom zůstávají aktivní kdekoli v hostitelském genomu, i ve velké vzdálenosti od genů, kde je normálně umlčování integrovaných provirů nejúčinnější.
Konečná představa účinné a bezpečné genové terapie předpokládá ještě vyřešení sekvenčně specifické integrace retrovirového vektoru. Pokud dovedeme začlenit vektor přednostně do oblasti mezi geny nebo do oblastí, kde se geny vyskytují velice řídce (tzv. genové pouště), nebude mít vektor příležitost aktivovat žádné okolní onkogenní sekvence. Nabízí se využít integrační místo pro virus asociovaný s adenovirem, které je empiricky nejlépe charakterizováno jako bezpečné. Transkripční umlčení vektoru v takovém místě už dokážeme zvládnout výše popsanými metodami. Pro specifickou integraci vektoru bude pravděpodobně možno využít endonukleáz TALEN nebo endonukleáz se „zinkovými prsty“ (Vesmír 75, 210, 1996/4). Obě technologie jsou již dostatečně rozpracovány a spějí k rutinnímu využití.
Endogenní retroviry
Druhým případem, kdy retroviry působí na svého hostitele pozitivně, jsou některé retroviry endogenní. Retrovirová infekce se většinou odehrává na úrovni somatických buněk. Retrovirus může vyvolat onemocnění, často nádor nebo leukemii, jeho hostitel zahyne a s ním i retroviry integrované v jeho DNA. Jinak tomu je v případě, že virus pronikne do buněk zárodečné linie, z nichž vznikají vajíčka a spermie. V takovém případě může být integrovaný provirus přenesen do příští generace, a pokud svého nového hostitele nepoškozuje, může se stát trvalou součástí genomu v linii jeho potomků. Děje se tak klonálně, to znamená, že provirus je stále v témže místě genomu. Tyto endogenní retroviry si mohou určitou dobu udržet schopnost produkovat infekční potomstvo, dříve nebo později ale podlehnou bodovým mutacím a přestavbám, takže v průběhu evoluce se zachovávají jako nefunkční zbytky a nakonec úplně zmizí. Přesto v dané evoluční fázi každého druhu obratlovců představují endogenní retroviry podstatnou část genomu. Např. lidská DNA je endogenními retroviry tvořena z 8 %, což je mnohem více než 1,5 % sekvence kódující vlastní lidské bílkoviny. Vznik endogenních retrovirů můžeme pozorovat i v současnosti, takřka v přímém přenosu. V populaci australských koalů se šíří nový retrovirus vytvářející endogenní kopie, podobně u amerických jelenců nacházíme endogenní retrovirus, který si zachovává schopnost produkovat infekční potomstvo a šíří se horizontálně.
Lidská sada endogenních retrovirů je výsledkem opakovaných infekcí během evoluce. Každá infekce po sobě zanechala rodinu endogenních retrovirů, které byly původně sekvenčně shodné, ale postupně se rozrůznily pod vlivem mutací a přestaveb. Některé rodiny jsou specificky lidské, jiné sdílíme se šimpanzi, některé s opicemi starého světa a některé se všemi primáty, podle toho kdy příslušný retrovirus infikoval naše předky. Je zajímavé, že současné lidstvo se prakticky shoduje ve všech retrovirových kopiích. Předpokladem takové fixace je jednak malý počet jedinců v populaci, to znamená, že naši prapředkové v určité evoluční fázi přežili jen v malém množství. Za druhé to znamená, že žádná rodina endogenních retrovirů již není aktivní a neprodukuje nové endogenní kopie.
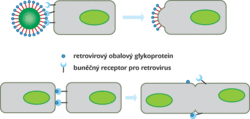
Takové množství provirových sekvencí nemohlo uniknout ani pozitivní selekci a využití ve prospěch hostitelské buňky. Regulační sekvence retrovirů bývají často převzaty pro regulaci buněčných genů a někdy mohou být využity i retrovirové geny a jimi kódované bílkoviny. Jeden příklad je mimořádně zajímavý. Provirus HERVWE1 na lidském chromozomu 7 si zachovává funkční gen pro obalový glykoprotein. Infekční retroviry prostřednictvím obalových glykoproteinů adherují k buněčným receptorům a fúzují s hostitelskou buňkou. Glykoprotein endogenního retroviru, tzv. syncytin, není ovšem na povrchu infekční virové částice, ale na membráně buňky a navozuje splývání jednotlivých buněk do mnohojaderných syncytií (obr. 3). Splývání buněk pod vlivem syncytinu se odehrává výlučně v placentě a vytváří syncytiální vrstvu na povrchu choriových klků, kde probíhá výměna plynů, živin a metabolických zplodin mezi plodem a matkou. Přepis genu pro syncytin je epigenetickým způsobem regulován tak, aby nenavozoval buněčné fúze jinde než v placentě. Zde je ovšem syncytin naprosto nezbytný a jeho chybění znamená poruchu ve vývoji placenty a eklampsii1) ohrožující matku i plod.
Uvedené příklady názorně ukazují, že retroviry nemusí lidem a zvířatům jen škodit. Evoluce dokáže vytvořit nové buněčné funkce i z nebezpečných parazitů. My snad budeme v budoucnu schopni využití retrovirů napodobit a opravovat poškozené geny bezpečnými a účinnými retrovirovými vektory. Praktické využití, jakkoli se zdá na dosah, bude ale záviset na pokračování teoretického výzkumu na modelových retrovirech a laboratorních zvířatech. Příkladem může být tradiční a stále inspirativní studium viru Rousova sarkomu a jeho interakce s přirozeným hostitelem, slepicí. V šedesátých a sedmdesátých letech byly získány prioritní poznatky o biologii retrovirů díky geneticky definovaným liniím slepic a originálnímu izolátu, tzv. pražskému kmeni viru Rousova sarkomu. V současnosti jsou všechny dříve vytvořené vědecké nástroje využívány pro pokrok v oblasti vektorů.
Popsaný výzkum retrovirů v Ústavu molekulární genetiky byl umožněn díky podpoře Grantovou agenturou České republiky (granty 301/09/P667, P502/10/1651, P502/11/2207 a P304/12/1736).
Literatura
Blažková a kol.: CpG methylation controls reactivation of HIV from latency. PLoS Pathog. 5, e1000554, 2009.
Plachý a kol.: Proviruses selected for high and stable expression of transduced genes accumulate in broadly transcribed genome areas. J. Virol. 84, 4204–4211, 2010.
Trejbalová a kol.: Epigenetic regulation of transcription and splicing of syncytins, fusogenic glycoproteins of retroviral origin. Nucleic Acids Res. 39, 8728–8739, 2011.
Šenigl a kol.: Transcriptional provirus silencing as a crosstalk of de novo DNA methylation and epigenomic features at the integration site. Nucleic Acids Res. 40, 5298–5312, 2012.
Poznámky
1) Eklampsie je nejvážnější komplikace v těhotenství a nejvýznamnější příčina úmrtí plodu a těhotných žen v rozvinutých zemích. Je charakterizována vývojovými defekty, nedokysličením placenty a vysokým krevním tlakem. Končí potratem.
ŽIVOTNÍ CYKLUS RETROVIRŮ
Retroviry představují velmi specifickou skupinu RNA virů, která se vyznačuje střídavým ukládáním své genetické informace do RNA a DNA. Infekční částice obsahují dvě molekuly RNA uložené v bílkovinné kapsidě, zvnějšku navíc chráněné cytoplazmatickou membránou buněčného původu se začleněnými virovými obalovými glykoproteiny. Životní cyklus retroviru začíná navázáním infekční částice na specifický povrchový receptor a proniknutím do buňky fúzí virové a buněčné cytoplazmatické membrány. Poté následuje přepis virové RNA do dvouřetězcové DNA enzymem zvaným reverzní transkriptáza. To je unikátní krok, jehož objev ve své době naboural tzv. centrální dogma molekulární biologie, které popisuje tok genetické informace ve směru DNA → RNA → bílkoviny. Ve formě DNA se genom retroviru začleňuje jako tzv. provirus do hostitelské DNA, a to účinkem dalšího virového enzymu, integrázy. Ve formě proviru se retrovirová genetická informace přepisuje podobně jako běžné buněčné geny zpět do RNA, která může být využita jako genom nově vznikajích infekčních částic nebo poslouží jako předloha pro syntézu virových bílkovin. Virové bílkoviny sestavují nové infekční částice v cytoplazmě nebo na cytoplazmatické membráně hostitelské buňky a zabalí dvě molekuly virové RNA. Infekční částice vypučí z buňky a po dozrání vně buňky účinkem virového enzymu proteázy je schopna napadnout novou buňku.
Ke stažení
 článek ve formátu pdf [611,62 kB]
článek ve formátu pdf [611,62 kB]
O autorovi
Jiří Hejnar


























