Přemůže molekulární biologie aids?
Nejrozšířenější infekční původce aidsu je retrovirus (RNA-virus) HIV-1, který při svém šíření lidskou populací velmi rychle mutuje. Tato vlastnost spolu se schopností unikat obranným mechanizmům imunitního systému znemožňuje přípravu účinné vakciny k aktivní imunizaci.  Ta je ostatně u virových infekcí obtížnější než u infekcí bakteriálních, což je způsobeno užším spektrem proteinů a jejich potenciálních epitopů (imunogenně účinných míst) ve virové částici (virionu) oproti bohatšímu spektru bakteriálních proteinů. Podobně pasivní imunizace protilátkami proti obalovým proteinům virionu, např. neutralizačními protilátkami proti proteinu gp120, nevedly k žádoucímu efektu. Protein gp120 obsahuje vazebné místo pro receptor CD4 na povrchu pomocných lymfocytů T, které umožní vstup viru do buněk. Ale i tento protein podléhá značné mutační variabilitě. Podpůrný efekt mohou mít přirozené protivirové bílkoviny organizmu, např. interferon a, cytokiny (lymfokiny) ap.
Ta je ostatně u virových infekcí obtížnější než u infekcí bakteriálních, což je způsobeno užším spektrem proteinů a jejich potenciálních epitopů (imunogenně účinných míst) ve virové částici (virionu) oproti bohatšímu spektru bakteriálních proteinů. Podobně pasivní imunizace protilátkami proti obalovým proteinům virionu, např. neutralizačními protilátkami proti proteinu gp120, nevedly k žádoucímu efektu. Protein gp120 obsahuje vazebné místo pro receptor CD4 na povrchu pomocných lymfocytů T, které umožní vstup viru do buněk. Ale i tento protein podléhá značné mutační variabilitě. Podpůrný efekt mohou mít přirozené protivirové bílkoviny organizmu, např. interferon a, cytokiny (lymfokiny) ap.
Terapie zidovudinem
Dosud nejvýraznějšího efektu lze dosáhnout chemoterapií, která zasahuje do životního cyklu viru HIV. S její pomocí lze rozvoj infekce výrazně zpomalit, ne však zastavit. Hlavním reprezentantem této skupiny léčiv je 3'-azido-2',3'-dideoxytymidin (AZT, azidotymidin, zidovudin – viz také Vesmír 74, 553, 1995/10). Je natolik podobný přirozenému nukleosidu tymidinu, že je enzymovými pochody v buňce přeměněn na příslušný trifosfát, který je, na rozdíl od přirozeného substrátu tymidintrifosfátu, látkou, která zabraňuje v působení reverzní transkriptáze obsažené ve virionu. Reverzní transkriptáza zahajuje životní cyklus viru v napadené buňce hostitele. Přepíše informaci z genomu virové RNA na DNA hostitelské buňky. Inhibitor reverzní transkriptázy tomu zabrání, čímž viru znemožní tvorbu virové mRNA a následnou syntézu virových bílkovin v ribozomech hostitelské buňky. Zároveň zidovudin předčasně ukončí zpětný přepis na DNA tím, že se do syntetizovaného vlákna DNA začlení namísto přirozeného tymidintrifosfátu. Tak je znemožněno další prodlužování vlákna, neboť chybí příslušná 3'-OH skupina na cukru 2'-deoxyribóze, která by umožnila vazbu dalšího deoxynukleosidtrifosfátu.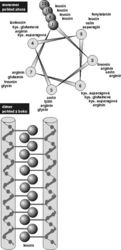 Účinnost zidovudinu však závisí nejen na rychlosti jeho fosforylace v buňce, ale zejména na citlivosti reverzní transkriptázy vůči inhibitoru. Ta je ovlivněna mutacemi virové RNA v úseku kódujícím reverzní transkriptázu a může se i úplně vytratit – virus je rezistentní vůči zidovudinu. Problém vzniku rezistentních virů se ostatně týká i dalších inhibitorů reverzní transkriptázy. Strategie léčby HIV se proto obrací stále více k možnostem zásahu na úrovni samotné RNA viru.
Účinnost zidovudinu však závisí nejen na rychlosti jeho fosforylace v buňce, ale zejména na citlivosti reverzní transkriptázy vůči inhibitoru. Ta je ovlivněna mutacemi virové RNA v úseku kódujícím reverzní transkriptázu a může se i úplně vytratit – virus je rezistentní vůči zidovudinu. Problém vzniku rezistentních virů se ostatně týká i dalších inhibitorů reverzní transkriptázy. Strategie léčby HIV se proto obrací stále více k možnostem zásahu na úrovni samotné RNA viru.
Útok na virovou RNA
Možnosti jsou hned tři. První z nich je použití antisense-oligonukleotidů, tj. jednovláknových řetězců DNA doplňkových k určité části mRNA viru. Vazbou na mRNA (hybridizací) se zabrání ribozomům hostitelské buňky překládat virovou mRNA na virové proteiny (inhibice translace). Nevýhodou tohoto postupu je rozklad oligonukleotidů nukleázami hostitelské buňky. Tomu by bylo možno čelit modifikací struktury antisense-nukleotidu, např. náhradou kyslíkových atomů ve fosfodiesterových spojkách mezi nukleosidy sírou.Jiná možnost se nabízí ve využití ribozymů. To jsou molekuly RNA, které jsou nejen nositeli informace, ale mají též katalytickou aktivitu. Za tento objev byl americký badatel T. R. Cech poctěn r. 1989 Nobelovou cenou. Ribozymy mají podobně jako antisense-nukleotidy schopnost hybridovat s jinými nukleotidy podle principu párování purinových a pyrimidinových bází, známého např. z modelu dvoušroubovice DNA. Navíc dovedou rozrušovat fosfodiesterové vazby mechanizmem tzv. transesterifikace. Mohou fungovat nejen v reakcích umožňujících samosestřih (self-splicing) vlastní RNA, ale též v tzv. trans-reakcích, to znamená, že mohou štěpit i jiné molekuly RNA. Byly skutečně učiněny pokusy využít této vlastnosti začleněním ribozymů do genomové RNA viru prostřednictvím vhodných vektorů. Slibné se zdálo zejména využití takových ribozymů, které byly zaměřeny na regulační oblasti RNA-genomu. Problémem těchto postupů je ovšem zajistit transport ribozymů do buněk organizmu a stejně jako u antisense-nukleotidů vyvstává nutnost ochránit je před působením nitrobuněčných ribonukleáz hostitele, které RNA degradují.
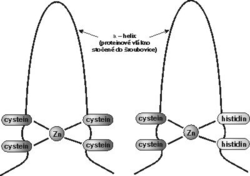 Konečně další možností jak působit na RNA viru, i když nepřímo, je zabránit expresi RNA zásahem do bílkovin, které s RNA vstupují do specifické interakce prostřednictvím tzv. zinkových prstů (viz obrázek). Vazba těchto bílkovin na RNA je nutná k uspořádání virové RNA do nově tvořených virových částic. Takovými bílkovinami jsou prekurzorové polyproteiny Pr55gag a Prl60gag-pol. Jejich produktem, vzniklým proteolytickým štěpením, je u HIV-1 nukleokapsidový protein p7 (p7NC). Spolu s molekulami p9NC vytváří obal kolem vlákna virové RNA.
Konečně další možností jak působit na RNA viru, i když nepřímo, je zabránit expresi RNA zásahem do bílkovin, které s RNA vstupují do specifické interakce prostřednictvím tzv. zinkových prstů (viz obrázek). Vazba těchto bílkovin na RNA je nutná k uspořádání virové RNA do nově tvořených virových částic. Takovými bílkovinami jsou prekurzorové polyproteiny Pr55gag a Prl60gag-pol. Jejich produktem, vzniklým proteolytickým štěpením, je u HIV-1 nukleokapsidový protein p7 (p7NC). Spolu s molekulami p9NC vytváří obal kolem vlákna virové RNA. 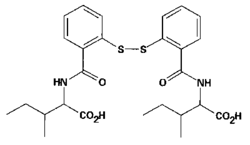 Tytéž zinkové prsty, o nichž byla řeč v souvislosti s prekurzorovými polyproteiny, jsou u jejich produktu p7NC nezbytné pro časné fáze infekce.
Tytéž zinkové prsty, o nichž byla řeč v souvislosti s prekurzorovými polyproteiny, jsou u jejich produktu p7NC nezbytné pro časné fáze infekce.
Proteiny se specifickou vazbou na DNA
Zinkové prsty fungují i v jiných systémech a umožňují specifickou vazbu regulačních bílkovin s nukleovými kyselinami. Byly objeveny v bílkovinách regulujících přepis DNA na RNA u různých organizmů (u savců např. v rodině receptorů steroidních hormonů). Jinými takovými motivy regulačních bílkovin vstupujících do interakce s DNA jsou bílkoviny obsahující motiv helix-závit-helix (viz obrázek) nebo motiv leucinového zipu (viz obrázek).Obecnou vlastností těchto motivů je jejich vysoce specifická schopnost reagovat pouze s určitými definovanými úseky DNA, které odpovídají nikoli strukturním, nýbrž regulačním genům. Přitom jen malé oblasti těchto regulačních genů vstupují do interakce s odpovídajícími nevelkými oblastmi regulačních proteinů (induktorů a represorů). Tato interakce je založena převážně na vazbě vodíkovými můstky a slabšími van der Waalsovými silami, nebo též na elektrostatické přitažlivosti opačných nábojů. 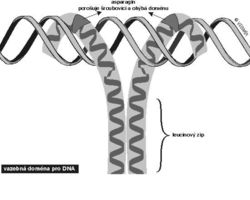 Jestliže se najde některý z uvedených motivů v bílkovině s neznámou funkcí, je velmi pravděpodobné, že se tato bílkovina specificky váže na DNA a že má funkci regulační. Jsou to právě regulační proteiny a regulační geny, které v buňce rozhodují o expresi (zapnutí nebo vypnutí) odpovídajícího strukturního genu. U mnohobuněčných organizmů, včetně lidského, rozhodují o diferenciaci a specializaci různých buněk, tkání a orgánů.
Jestliže se najde některý z uvedených motivů v bílkovině s neznámou funkcí, je velmi pravděpodobné, že se tato bílkovina specificky váže na DNA a že má funkci regulační. Jsou to právě regulační proteiny a regulační geny, které v buňce rozhodují o expresi (zapnutí nebo vypnutí) odpovídajícího strukturního genu. U mnohobuněčných organizmů, včetně lidského, rozhodují o diferenciaci a specializaci různých buněk, tkání a orgánů.
Zinkové prsty a virus HIV
Jistým překvapením tedy bylo, že i p7 nukleokapsidový protein HIV-1 takové zinkové prsty obsahuje a že právě ony mohou být cílem zásahu chemoterapie aidsu.Mutace virové RNA, které by pozměnily aminokyselinové sekvence potřebné k vytvoření zinkových prstů, jsou totiž neslučitelné s životním cyklem viru, jsou mutačně intolerantní. Jak už bylo řečeno, zinkové prsty v nukleokapsidu p7 jsou nezbytné pro ranou fázi infekce HIV. Tytéž zinkové prsty v prekurzorových polyproteinech Pr55gag a Prl60gag-pol, z nichž p7 vzniká, jsou nutné pro uspořádání RNA pomnoženého viru do nové virové částice. Zinkový motiv HIV-1 má sekvenci Cys-X2-Cys-X4-His-X4-Cys (ve zkratce CCHC, přičemž Cys značí cysteinový zbytek, His znamená histidinový zbytek a X je zbytek jiné aminokyseliny v polypeptidovém řetězci). Zbytky tří cysteinů a jednoho histidinu, které vážou koordinačně zinek, a prostorové uložení zinkových prstů, jsou u známých retrovirů absolutně konzervovány a mutace v těchto místech mají za následek vznik virů zcela neinfekčních. V p7 nukleokapsidovém proteinu (p7NC) jsou takové zinkové prsty dva.
Skupina badatelů z National Cancer Institute v Bethesdě v USA podala v listopadu 1995 v časopisu Science zprávu o inhibitorech zinkových prstů nukleokapsidového proteinu p7 viru HIV-1 jako o možných kandidátech léčby aidsu. Princip léčby spočívá v tom, že zasahuje do bílkovinného produktu odpovídajícího mutačně značně rezistentnímu místu RNA, což je předpoklad bránící vzniku rezistence na taková léčiva. Navrženými chemoterapeutiky jsou deriváty benzamidů substituovaných disulfidem (DIBA – disulfide substituted benzamides, viz obrázek), které jsou značně elektrofilní. Tato jejich vlastnost modifikuje cysteinové tioláty (soli tiolů) koordinačně vázající zinek v zinkových prstech. Výsledkem je vypuzení zinku z tetraedrové struktury vazebných aminokyselinových zbytků (in vitro). Možnost takového léčebného postupu byla ověřena v kulturách buněk infikovaných virem. Jedna z testovaných látek (DIBA-4) měla i vhodné farmakokinetické parametry v testu na myších.
Naznačený postup bude ještě vyžadovat ověření v dlouhodobě sledovaných buněčných kulturách a ve farmakologických testech na pokusných zvířatech, avšak ukazuje novou cestu vývoje dalšího typu látek zaměřených na zinkové prsty bílkovinných produktů ve virionech retrovirů.
I nadále zůstává strategií léčby aidsu kombinovaný přístup s využitím všech dosavadních terapeutických možností, zejména chemoterapie. Současně se budou hledat další cesty chemoterapie a imunologie, které by se opíraly o rozvíjející se poznatky molekulární biologie. Ty, jak doufáme, jednou povedou ke zvládnutí nebezpečné infekce, jíž pro lidskou populaci aids nesporně je.
Literatura
R. Yarchoan, H. Mitsuya, S. Broder: Sci. Amer. 259, 88, 1988W. C. Greene: Sci. Amer. 269, 57, 1993
M. Kiehntopf, E. L. Esquivel, M. A. Brach, F. Herrmann: Lancet 345, 1057, 1995
W. G. Rice, J. G. Supko, L. Malspeis, R. W. Buckheit Jr., D. Clanton, M. Bu, L. Graham, C. A. Schaeffer, J. A. Turpin, J. Domagala, R. Gogliotti, J. P. Brader, S. M. Halliday, L. Coren, R. C. Sowder II, L. O. Arthur, L. E. Henderson: Science 270, 1194, 1995
D. K. Granner v knize Harper’s Biochemistry, 23. vydání, Prentice Hall International Inc., 1993, kapitola 41
SLOVNÍČEK
inhibitor – látka bránící působení (např. enzymu)nukleosid – sloučenina purinové nebo pyrimidinové báze a ribózy nebo deoxyribózy. Nukleosidy se za pomocí kyseliny fosforečné spojují v řetězce, podle typu ribózy vzniká RNA respektive DNA.
prekurzor – výchozí látka, z níž vzniká chemickou přeměnou výsledný produkt.
ribozom – soustava ribonukleoproteinových částic, pomocí nichž se tvoří bílkoviny podle informace „přinesené“ z jádra buňky molekulou mRNA.
ribozym – molekula RNA s enzymovými schopnostmi; katalyzuje štěpení a ligaci oligonukleotidových substrátů.
virion – „cestovní“ podoba viru neboli virová nukleová kyselina (RNA nabo DNA) „zabalená“ do proteinového obalu. Umožňuje viru opustit jednu hostitelskou buňku a přemístit se do jiné (infikovat ji). Uvnitř buněk jsou viry obvykle bez proteinového obalu – tedy jen v podobě příslušné nukleové kyseliny.

























