Kryptobiotické stavy aneb Vratná zastavení životních dějů
Molekulární kyslík (O2) hraje klíčovou roli v energetickém metabolismu. Je-li ho v prostředí dostatek, každá molekula glukózy může být v buňce přeměněna nejméně na 34 molekul „tvrdé energetické měny“ – adenozintrifosfátu (ATP). Pokud ale kyslík chybí, je dýchací řetězec vyřazen z činnosti a anaerobní oxidace glukózy poskytne buňce pouze 2–6 molekul ATP (viz rámeček).
Žádný živočich (Metazoa) nedokáže trvale přežívat (prodělat kompletní vývojový cyklus) ve světě bez kyslíku. Mnozí jsou však přizpůsobeni životu v prostředí s velmi nízkou hladinou kyslíku. Například ve vysokých nadmořských výškách, v bahenních sedimentech na dně jezer a moří nebo v trávicím traktu. A mnozí další sice žijí plně aerobně, ale jsou schopni překonat dočasný nedostatek (hypoxii), popřípadě dočasnou absenci (anoxii) kyslíku.
Přežívání v anoxických podmínkách ještě nemusí být anoxybióza
Trvá-li hypoxie jen krátkou chvíli, může anaerobní dodávka energie stačit i pro impozantní výkon. Například převážná část (asi 80 %) desetisekundové svalové práce sprintera na 100 m je kryta právě anaerobní dodávkou ATP. Musí být, protože přívod kyslíku krevním oběhem je příliš zdlouhavý, než aby dokázal držet krok s rychlou svalovou spotřebou. Sprinterovy svaly pracují na dluh, který je záhy splacen aerobní metabolickou aktivitou jater a dalších orgánů, jež odstraní nahromaděné zplodiny, především laktát. Značná chemická energie zbývající ve vazbách molekuly laktátu může být dále vytěžena, opět se ziskem ATP.
Podobně si anaerobní glykolýzou vypomáhají i potápějící se živočichové, od žab až po kytovce. A dělá to i potápěč bez přístrojů nebo třeba horolezec. Jestliže se ovšem nedostatek kyslíku (nebo energie obecně) protahuje na delší dobu (řádově na minuty nebo hodiny), lze rozumně přežít jen při značně zpomaleném životním tempu. To je strategie hibernujících savců, diapauzního hmyzu, ryb přezimujících pod ledem nebo zaplavených bezobratlých živočichů v říční nivě. Adaptace pro přežití takových situací jsou samozřejmě komplexní a u různých druhů různé, ale jedno mají společné: životní procesy stále pomalu běží, i když kyslík v prostředí chybí. Nejde ještě o kryptobiotický stav, ale o anoxický metabolismus. Anaerobní procesy vyrábějí energii, která se obratem spotřebovává při udržování rovnováhy vnitřního prostředí, svalové práci a nervové činnosti.
Teoretický limit anoxybiózy
 Dosažení kryptobiotického stavu, kdy jsou všechny životní procesy zastaveny, je snadno představitelné a prokazatelně možné buď při nedostatku vody (anhydrobióza), nebo při nízké teplotě (kryobióza). V obou případech se snižuje pohyblivost molekul a částic (viz předchozí dvě části seriálu). Co když je ale limitujícím faktorem pouze nedostatek kyslíku? Tehdy se molekuly stále normálně pohybují ve vodném prostředí a nechybí jim ani termální energie. Nedostává se pouze energie chemická, kterou by bylo možné s pomocí kyslíku vyrábět. Je vůbec možné za těchto okolností zastavit metabolismus a vstoupit do anoxybiózy?
Dosažení kryptobiotického stavu, kdy jsou všechny životní procesy zastaveny, je snadno představitelné a prokazatelně možné buď při nedostatku vody (anhydrobióza), nebo při nízké teplotě (kryobióza). V obou případech se snižuje pohyblivost molekul a částic (viz předchozí dvě části seriálu). Co když je ale limitujícím faktorem pouze nedostatek kyslíku? Tehdy se molekuly stále normálně pohybují ve vodném prostředí a nechybí jim ani termální energie. Nedostává se pouze energie chemická, kterou by bylo možné s pomocí kyslíku vyrábět. Je vůbec možné za těchto okolností zastavit metabolismus a vstoupit do anoxybiózy?
Jeden ze základních axiomů biochemie a biologie praví, že plně hydratované buňky se za fyziologických teplot nacházejí ve stavu dynamické rovnováhy (homeostázy) a svoji integritu mohou udržet pouze při neustálém obratu chemické energie, tedy jedině s aktivním metabolismem. Důvodů je víc, ale jeden úplně stačí: stabilita globulárních proteinů je ve vodném prostředí limitována. Pokud by molekuly proteinů nebyly neustále odbourávány a nahrazovány novými, popřípadě opravovány (což obojí vyžaduje přístup k volné energii ve formě ATP), brzy by denaturovaly a buňku i celý organismus by čekala smrt. Tento axiom teoreticky vylučuje existenci skutečně anoxybiotického (ve smyslu „anenergobiotického“) stavu. V praxi se však někteří živočichové mohou tomuto stavu blížit.
Anoxie směruje život do pomalého jízdního pruhu
Modelovými obratlovci, kteří přežívají bez kyslíku, jsou karasi (Carassius carassius) a želvy (hlavně želva pestrá, Chrysemys picta belli). Přezimují ve vodě anoxických tůní, jež jsou navíc často pokryty ledem, který brání difuzi kyslíku ze vzduchu do vody (viz Vesmír 84, 604, 2005/10). Delší přežívání bez kyslíku je možné jedině po důkladné fyziologické přípravě na přezimování. Tato aklimatizace představuje komplexní změnu fenotypu (od změny exprese genů až po změny v chování a morfologii), ale přidržme se energetiky jako ústředního problému.
Především je nutné se předem zásobit dostatečným množstvím fermentovatelného substrátu, to znamená nahromadit glykogen v jaterních buňkách. Zásoba může vystačit až na půl roku anaerobního metabolismu.1) Samozřejmě za předpokladu, že celková metabolická rychlost značně poklesne, typicky na 5–10 %. K tomu přispívá nízká tělní teplota během přezimování. Výrazný pokles (zhruba na 20 %) ale zaznamenáme i za konstantní teploty.
Právě toto regulované zpomalení metabolismu a schopnost udržet rovnováhu mezi produkcí a spotřebou ATP jsou charakteristickým rysem úspěšných příležitostných anaerobů. Někdy je tento rys přirovnáván k automatickému přepnutí na nouzové osvětlení pří snížené dodávce elektřiny. Nedostává-li se kyslík, musí se uskrovnit dva největší konzumenti buněčné energie:
- Obrat proteinů, jež za normálních podmínek spotřebovává až polovinu energie, klesá na méně než desetinu obvyklých hodnot.
- Aktivní transport iontů, který je nutný pro udržování membránového potenciálu a spotřebovává běžně třetinu energie buňky, klesá zhruba na čtvrtinu původní spotřeby.
Dále se téměř zastaví biosyntéza glukózy, omezí se produkce močoviny a samozřejmě i spotřeba energie ve svalech. Tato akutní „obranná“ fáze probíhá záhy po detekci nízké hladiny kyslíku v organismu, a je posléze doplněna fází „záchrannou“. Během ní se buňka přeprogramuje na režim dlouhodobého přežití při nízké dodávce energie. Je potlačena aktivita genů, které kódují enzymy glukoneogeneze, Krebsova cyklu a dalších utlumených metabolických drah. Naopak je stimulována aktivita genů, které kódují enzymy glykogenolýzy a glykolýzy či třeba proteiny s chaperonovou funkcí (Vesmír 78, 372, 1999/7 a 77, 15, 1998/1).2) Fermentační procesy a následná spotřeba ATP za anoxie nevyhnutelně vedou k okyselení cytosolu buněk a krve (k metabolické acidóze). Do výbavy úspěšného anaeroba musí proto patřit i prostředky pro boj s acidózou.
Z pomalého jízdního pruhu až do garáže?
Ačkoli někteří obratlovci dokážou velmi zpomalit svůj životaběh, žádný ho nedokáže zcela zastavit. Když navíc „odečteme“ přímý vliv nízké teploty, doba přežití se významně zkrátí. Například u přezimujících karasů nebo želv se ze 6 měsíců přežití v anoxii za teplot mírně nad nulou dostaneme na zhruba 2 týdny za teplot 15–20 °C nebo na pouhé 2 dny za teplot kolem 25 °C. Bezobratlí živočichové pravděpodobně vydrží mnohem víc. Bohužel neexistuje mnoho přesných údajů. Víme, že většina druhů suchozemských bezobratlých živočichů překonává nepříznivá období roku v dormantním stavu (v diapauze). Charakteristickým a především u hmyzu velmi dobře zdokumentovaným znakem diapauzy je právě šetření energií a výrazné zpomalení metabolismu (řádově na 1–20 % normálu).3) Za anoxických podmínek může být zpomalení metabolismu ještě hlubší. Například dolní tok Amazonky postihují každý rok záplavy a hladina řeky se na pár měsíců zvedá o několik metrů. Mnoho suchozemských živočichů volí nejjednodušší způsob obrany – ustoupí směrem nahoru, do korun stromů, nebo směrem do stran, za hranice zaplaveného území. Drobní půdní a povrchoví živočichové ale tuto možnost nemají – buď musí umět dýchat i pod vodou, nebo musí zaplavení přečkat bez kyslíku.4)
Larvy amazonského svižníka Phaeoxantha klugi přežijí při hluboké dormanci v půdních chodbičkách téměř čtyřměsíční zaplavení vodou při teplotě kolem 29 °C.5) Jsou-li v laboratoři vystaveny úplné anoxii (také za teploty 29 °C), 50 % z nich přežívá 26 dní. Tedy mnohem déle než ti nejlepší obratlovčí anoxybionti. Nemáme žádná měření metabolické rychlosti těchto svižníků, ale je jisté, že jejich anoxický metabolismus, limitovaný pouze energií, a nikoli vodou nebo teplotou, musí být velice pomalý.
Diapauzní cysty artémií
Žábronožky z rodu Artemia jsou korýši, kteří snad jako jediní živočichové trvale žijí v silně zasolené vodě asi pěti set jezer na všech kontinentech vyjma Antarktidy. Patrně jde o komplex blízce příbuzných druhů, ale někteří autoři je shrnují pod jediný druh, žábronožku slaniskovou nebo slaništní (A. salina). Přežití v zasolené vodě je jistě dobrý námět pro samostatný článek. Zde jen zmiňme, že voda s vysokým obsahem soli má nevyhnutelně i nízký obsah kyslíku. Například v Mrtvém moři je obsah kyslíku snížen na 0,8 ml O2 na litr vody (běžné hodnoty v mořské vodě se pohybují mezi 4–6 ml a ve sladké vodě je za teploty 15 °C a normálního tlaku rovnovážný obsah kyslíku 7 ml).
V podzimních měsících kladou žábronožky oplodněná vajíčka, která zastaví svůj vývoj ve stadiu gastrulovaného embrya (shluk asi 4000 buněk), vyrobí si nepropustný vnější obal (cystu) a vstupují do diapauzního stavu. Cysty plavou na hladině jezera a dříve či později je vítr a vlny zanesou ke břehu, kde je uloží do nánosů bahna, bakterií, sinic a řas. V tomto silně hypoxickém prostředí mohou zcela vyschnout a přetrvat v anhydrobióze (viz první díl).
Cysty artémií mají však ještě jednu fascinující schopnost. V laboratoři je lze za úplné anoxie udržet v diapauze až sedm let – a dokonce v plně hydratovaném stavu a za pokojové teploty.6) Nezastaví se tedy během diapauzy jejich metabolismus? Jestliže ano, jak se to slučuje s teoretickými základy biochemie? Měření extrémně pomalého metabolismu je samo o sobě technický oříšek. Když naměříme nulu, může to vypovídat jen o citlivosti použitých přístrojů. Navíc jedna cysta artémie je pro měření příliš malá, a proto se jich vždy měří mnoho najednou. Určité procento cyst však není v diapauze, neboť ji ukončily buď spontánně, nebo v důsledku manipulace. Jejich metabolismus je tudíž normální a narušuje přesnost měření. Připočtěme si ještě mikrobiální kontaminaci měřených vzorků a samovolné reakce v mrtvých cystách a máme problém.
Jedno ale lze říci určitě: není-li metabolismus zcela zastaven, je minimálně 50 000× pomalejší (0,002 % původní hodnoty). Aktivní metabolismus by se prozradil únikem tepla, který lze zachytit mikrokalorimetrem. Naměřené hodnoty však byly buď pod hranicí citlivosti přístrojů, nebo extrémně nízké.7) Izotop uhlíku 14C dodávaný ve formě 14CO2 se nezabudovával do makromolekul proteinů a nukleových kyselin vůbec, nebo se zabudovával jen minimálně.8) To naznačuje, že proteosyntéza, buněčný cyklus a transkripce genů v cystě téměř neprobíhají. Kupodivu nelze pozorovat ani žádné známky denaturace a agregace proteinů. Po léta neměnné hladiny ATP a glykogenu ukazují na celkově ametabolický stav. Nehromadí se ani laktát nebo jiné zplodiny anaerobního metabolismu.6)
Krůček od anoxybiózy
Uvedená fakta o diapauzních cystách artémií dráždí svou neslučitelností s obecnou představou o nutnosti obratu chemické energie pro udržení životaschopnosti hydratovaného organismu za pokojových teplot. Jestliže neběží procesy proteosyntézy, proteolýzy ani opravy proteinů, co tedy udržuje proteiny po léta ve správné konformaci? Cysty obsahují dost vysoké koncentrace trehalózy (až 17 % suché hmoty) a glycerolu (až 2,5 % suché hmoty). To může částečně vysvětlit stabilitu proteinů, ale možná jsou tyto metabolity přichystány spíše pro očekávanou eventualitu vyschnutí.
V cystách je také velké množství malého šokového proteinu p26 z rodiny α-krystalinů. Ten dokáže stabilizovat ostatní proteiny v buňce bez nároku na ATP. Není totiž jejich aktivním opravářem (to by stálo ATP), spíš interaguje s exponovanými hydrofobními doménami částečně denaturovaných proteinů a brání jejich vzájemné agregaci.9) Brání také rozpadu tubulinových polymerů a konzervuje tím jemné strukturování prostoru uvnitř buněk.10)
Protein p26 poskytl také další klíč k záhadě energetického stavu diapauzních cyst (a také hřebíček do rakve ametabolické teorie). Diapauzní cysty obsahují relativně velké množství guanozinových nukleotidů (až 2 % sušiny). Když se měřily změny koncentrací různých nukleotidů během šestileté anoxie, velmi pomalu ubýval di-guanozintetrafosfát.11) Patrně byl konvertován na guanozintrifosfát (GTP), který je s ATP zaměnitelný. Na co se ovšem energie z GTP či ATP spotřebovává? Dobrým kandidátem je právě protein p26. Ačkoli nepotřebuje ATP ani GTP k chaperonové funkci, potřebuje energii pro transport do jádra. Protein p26 skutečně váže GTP a pracuje jako GTPáza (odštěpuje fosfor od molekuly GTP za uvolnění energie).
Ačkoli se velká část metabolismu anoxických diapauzních cyst artémií asi opravdu zastavuje, přece jen pozorujeme známky mobilizace energetických zásob a jejich konverze na GTP. Zatím chybí lepší představa o procesech, které by energii z GTP využívaly, ale je jisté, že spící cysty zůstávají malý krůček od úplné anoxybiózy. Můžeme tedy také klidně spát, neboť základní axiomy biochemie stále platí…
Poznámky
1) Penney D. G.: Frogs and turtles: different ectotherm overwintering strategies, Comp. Biochem. Physiol. 86A, 609–615, 1987.
2) Hochachka P. W. et al.: Unifying theory of hypoxia tolerance: molecular/metabolic defense and rescue mechanisms for surviving oxygen lack, PNAS USA 93, 9493–9498, 1996.
3) Košťál V.: Eco-physiological phases of insect diapause, J. Insect Physiol. 52, 113–127, 2006.
4) Adis J., Junk W. J.: Terrestrial invertebrates inhabiting lowland river floodplains of Central Amazonia and Central Europe: a review, Freswater Biology 47, 711–731, 2002.
5) Zerm M., Adis J.: Exceptional anoxia resistance in larval tiger beetle, Phaeoxantha klugii (Coleoptera: Cicindelidae) from Central Amazonian floodplains (Brazil), Physiol. Entomol. 28, 150–153, 2003.
6) Clegg J. S.: Embryos of Artemia franciscana survive four years of continuous anoxia: the case for complete metabolic rate depression, J. Exp. Biol. 200, 467–475, 1997.
7) Hand S. C.: Heat flow is measurable from Artemia franciscana embryos under anoxia, J. Exp. Zool. 273, 445–449, 1995.
8) Clegg J. S. et al.: The metabolic status of diapause embryos of Artemia franciscana, Physiol. Zool. 69, 49–66, 1996.
9) Liang P. et al.: Purification, structure and in vitro mole- cular-chaperone activity of Artemia p26, a small heat shock/alpha-crystallin protein, Eur. J. Biochem. 243, 225–232, 1997.
10) Day R. M. et al.: A small heat shock/alpha-crystallin protein from encysted Artemia embryos suppresses tubulin denaturation, Cell Stress & Chaperones 8, 183–193, 2003.
11) Warner A. H., Clegg J. S.: Diguanosine nucleotide metabolism and the survival of Artemia embryos during years of continuous anoxia, Eur. J. Biochem. 268, 1568–1576, 2001.
Anaerobní metabolismus živočichů
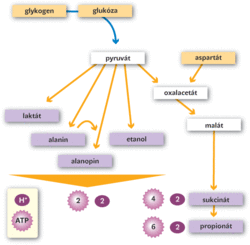 Oxidace glukózy na pyruvát (glykolýza) je ústřední metabolickou drahou každé živočišné buňky. Probíhá bez nároku na molekulární kyslík. Každá molekula glukózy je v ní přeměněna na dvě molekuly pyruvátu za současné čisté produkce dvou molekul ATP. Elektrony z molekuly glukózy jsou předávány oxidačnímu činidlu NAD+, jež je redukováno na NADH. Zároveň se do média uvolňují protony (H+). Další protony se uvolňují při hydrolýze ATP (ATP se neskladuje, ale slouží jako zdroj energie pro nejrůznější procesy v buňce). Volné protony zvyšují kyselost (snižují pH) prostředí. Různé fermentační dráhy mají různou výtěžnost ATP a také různý molární poměr produkovaného ATP : H+ na jednu molekulu substrátu (substráty jsou ve žlutých rámečcích). Výsledný poměr ATP : H+ je uveden pouze pro glukózu. Pro glykogen bude zisk vždy o jeden mol ATP vyšší. Hladiny aspartátu jsou relativně vysoké u různých mlžů. Jeho konverzí na propionát je možné získat také 2 moly ATP.
Oxidace glukózy na pyruvát (glykolýza) je ústřední metabolickou drahou každé živočišné buňky. Probíhá bez nároku na molekulární kyslík. Každá molekula glukózy je v ní přeměněna na dvě molekuly pyruvátu za současné čisté produkce dvou molekul ATP. Elektrony z molekuly glukózy jsou předávány oxidačnímu činidlu NAD+, jež je redukováno na NADH. Zároveň se do média uvolňují protony (H+). Další protony se uvolňují při hydrolýze ATP (ATP se neskladuje, ale slouží jako zdroj energie pro nejrůznější procesy v buňce). Volné protony zvyšují kyselost (snižují pH) prostředí. Různé fermentační dráhy mají různou výtěžnost ATP a také různý molární poměr produkovaného ATP : H+ na jednu molekulu substrátu (substráty jsou ve žlutých rámečcích). Výsledný poměr ATP : H+ je uveden pouze pro glukózu. Pro glykogen bude zisk vždy o jeden mol ATP vyšší. Hladiny aspartátu jsou relativně vysoké u různých mlžů. Jeho konverzí na propionát je možné získat také 2 moly ATP.
Aby glykolýza mohla pokračovat, redukované činidlo NADH se musí oxidovat zpět na NAD+. A to právě zajišťují různé fermentační reakce, jejichž konečné produkty jsou ve fialových rámečcích. Laktátová fermentace je nejběžnější způsob získávání energie. Najdeme ji u většiny příležitostných živočišných anaerobů i u obyvatel míst s nedostatkem kyslíku. Malý podíl produkovaného pyruvátu je často přeměněn na aminokyselinu alanin. Někteří bezobratlí, zvláště kroužkovci žijící v hypoxickém bahně na dně moří, potom spojují alanin s pyruvátem za vzniku alanopinu (a přitom oxidují NADH). Podobné dráhy najdeme také u mlžů obývajících hypoxické mořské sedimenty. Finální produkty se liší v závislosti na použité aminokyselině (lysin → lysopin, arginin → oktopin). Etanol je koncovým produktem fermentace například u karasů, kteří jej uvolňují pomocí žaber do vody. Parazitičtí červi (tasemnice, hlístice, motolice) oxidují NADH při redukci oxalacetátu na malát, a ten potom vstupuje uvnitř mitochondrie do dalších reakcí, jež produkují další molekuly ATP.
Ke stažení
 článek ve formátu pdf [604,01 kB]
článek ve formátu pdf [604,01 kB]

























