Genetika a nádory
Před lety jsem se věnoval objasňování úlohy genů při vzniku nádorů (Vesmír 45, 229, 1966/8; 66, 65, 1987/2). Od té doby se tato problematika rozkošatěla natolik, že dnes mohu nanejvýš charakterizovat vybraná fakta, ukázat na jejich propojení a shrnout jejich význam.
Geny vyvolávající nádory
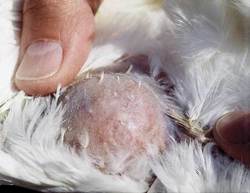
Klíčovým vstupem do genetiky nádorů zůstávají onkogeny. Jde buď o pozměněné geny, nebo o aktivované geny normální, zvané protoonkogeny. Jejich název je poněkud nepřesný, neboť tyto geny plní v buňce důležité funkce a nemají se vznikem nádorů bezprostřední souvislost. Onkogenními se stávají až v důsledku určitých změn ve své struktuře nebo v důsledku zvýšeného vyjádření (exprese).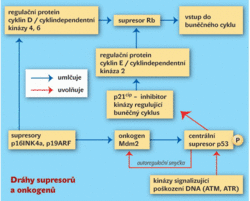 Některé onkogeny způsobí vznik nádorů přímo, v jednostupňovém procesu. Mezi ně patří v-src, získaný původně z viru Rousova sarkomu. Ten způsobuje vznik progresivně rostoucích nádorů i poté, když je do kuřat vnesen jako čistá klonovaná DNA (obrázek 2). Zmíněný prototypový onkogen není úplnou výjimkou, podobně se chová onkogen v-myb, způsobující zhoubné bujení krevních buněk (myeloblastózu) u kuřat, a konečně i lidský onkogen BCR-ABL, který je odpovědný za chronickou myeloidní leukemii u člověka. Nádorotvorné působení řady dalších onkogenů závisí i na spoluúčasti jiných buněčných genů. Obecně se onkogeny chovají jako dominantní geny, které aktivují řadu buněčných událostí, obzvláště signálních cest. Aktivační působení onkogenu může být i tak extrémní, že aktivuje až 15 % genů organismu.
Některé onkogeny způsobí vznik nádorů přímo, v jednostupňovém procesu. Mezi ně patří v-src, získaný původně z viru Rousova sarkomu. Ten způsobuje vznik progresivně rostoucích nádorů i poté, když je do kuřat vnesen jako čistá klonovaná DNA (obrázek 2). Zmíněný prototypový onkogen není úplnou výjimkou, podobně se chová onkogen v-myb, způsobující zhoubné bujení krevních buněk (myeloblastózu) u kuřat, a konečně i lidský onkogen BCR-ABL, který je odpovědný za chronickou myeloidní leukemii u člověka. Nádorotvorné působení řady dalších onkogenů závisí i na spoluúčasti jiných buněčných genů. Obecně se onkogeny chovají jako dominantní geny, které aktivují řadu buněčných událostí, obzvláště signálních cest. Aktivační působení onkogenu může být i tak extrémní, že aktivuje až 15 % genů organismu.
Závažnou otázkou je, zda onkogen může být umlčen a jaké důsledky z toho plynou. Tento problém byl sledován u onkogenu v-src, který způsobuje nádorovou přeměnu nejenkuřecích, nýbrž i některých savčích buněk. Takové savčí buňky mohou spontánně umožnit vznik normálním buňkám (zvaným revertanty), které už vlastnosti nádorových buněk nemají. Jak víme ze zkušenosti, nejvýraznější příčinou vzniku revertant je metylace DNA onkogenu, což představuje přirozený proces, jímž se buňka vyrovnává s cizorodou genetickou informací. Onkogeny tedy mohou být (s nízkou frekvencí) buňkou umlčovány, aniž dojde k jejich mutaci. A co když se onkogen vyloučí z celé populace buněk nádoru? Možnost odpovědět na tuto otázku poskytly nové metody genových manipulací. Spočívají v tom, že funkční onkogen vyvolávající nádor u experimentálního zvířete je obklopen kontrolními oblastmi, jež dovolují onkogen z již vytvořeného nádoru vyřadit. Tato metodologie byla uplatněna u několika onkogenů a vedla k závěru, že vyřazení onkogenu vyvolá ústup (regresi) původního nádoru, spojený většinou s programovanou smrtí (apoptózou) nádorových buněk.
 Ve světle těchto nálezů se nám onkogeny jeví jako geny, které nejen odstartují nádorové bujení, ale jsou potřebné i pro udržení nádorového stavu buněk. Proto nás nepřekvapí, že současné pokusy o chemoterapii jsou zaměřeny na látky zahrnující i působení produktů onkogenů. Dobrým příkladem je imatinib, který se střetává s funkcí onkogenu BCR-ABL a je účinný – i když většinou dočasně – proti chronické myeloidní leukemii.
Ve světle těchto nálezů se nám onkogeny jeví jako geny, které nejen odstartují nádorové bujení, ale jsou potřebné i pro udržení nádorového stavu buněk. Proto nás nepřekvapí, že současné pokusy o chemoterapii jsou zaměřeny na látky zahrnující i působení produktů onkogenů. Dobrým příkladem je imatinib, který se střetává s funkcí onkogenu BCR-ABL a je účinný – i když většinou dočasně – proti chronické myeloidní leukemii.
Dosud známe asi 100 onkogenů, což zdaleka není konečné číslo. Na druhé straně víme poměrně málo o tom, co ze spektra jejich působení na události v buňce představuje ty momenty, které rozhodují o nádorové změně.
Geny potlačující nádory – nádorové supresory
Stejně významné jako onkogeny jsou geny, které vznik nádorů potlačují. Nazývají se supresory. Chovají se jako recesivní, to znamená, že stačí jeden z párových genů (alel) k tomu, aby protinádorový účinek zůstal zachován. Jestliže však dojde ke ztrátě obou alel, je zrušena supresorová aktivita, tudíž i protinádorové působení supresoru a aktivita potlačující nádor pomine. Supresorových genů známe též řadu, ale tři z nich mají při vzniku nádorů obecný význam. První z nich je p53. Nádorový supresor navozuje buď buněčnou smrt (apoptózu), nebo stárnutí (senescenci) buňky, a to zamezením jejího vstupu do mitózy. Stárnutí se objevuje u buněk, jejichž genom byl poškozen, ale ještě jej lze opravit. Když se oprava nepodaří, podlehnou buněčné smrti. Vzhledem ke klíčové roli p53 v zachování neporušené genetické informace buněk nás nepřekvapuje, že p53 stanul v centru pokusů o navození rezistence vůči nádorům. V té souvislosti se podařilo prokázat, že je možno navodit odolnost vůči nádoru i u těch zvířat, kde se chybný gen p53 podařilo opravit. Pro další uplatnění tohoto poznatku se objevila vážná překážka, a to že gen p53 účinně mutuje a stává se onkogenem. Nakonec toto zjištění nebylo ani tak překvapující, neboť nádorový supresor p53 byl původně popsán ve své mutované formě jako onkogen. Velké naděje vkládané do terapie pomocí p53 tak dosud zůstávají nenaplněny. Nadějné jsou v tomto smyslu také gen Ink4a/ARF a určitý typ microRNA, které fungují jako p53.Gen p53 je článkem i v jiných událostech kontrolujících vstup do mitózy, kde se objevují další geny potlačující nádor a jeden onkogen (obrázek 1).
Tak vzniká tok událostí, které částečně známe a které kontrolují buněčný cyklus. Geny potlačující nádor jsou významnou součástí těchto událostí a jejich ovlivnění bude nadále představovat cíl protinádorové léčby.
Jiné umlčování genů – epigenetické události
Geny podílející se na vzniku nádorů mohou být modifikovány nejen strukturální přestavbou, jako jsou mutace, které mají za následek změnu čtení genetického kódu, ale i v důsledku vratných změn genetické informace, jimž říkáme epigenetické události. Mezi ně patří hlavně metylace cytozinu, který je jednou ze čtyř bází tvořících genetický kód. Metylací je gen umlčen, aniž se poruší jeho struktura. Dlužno dodat, že proces metylace zůstává neobjasněn a zahrnuje vyjma příslušné enzymy i proteiny úzce spojené s DNA (histony).Umlčování genu metylací má své důsledky také pro vznik nádorů. Jak jsme již uvedli, metylace onkogenu v-src vede k vzniku normálních buněk z buněk nádorových. U lidí má velký význam umlčování supresorových genů prokázané v řadě případů (časté je u Ink4a). Jestliže je gen potlačující bujení umlčen, buňky nekontrolovaně vstoupí do mitózy a začnou se množit, což podporuje vznik nových mutant s nádorovými vlastnostmi. Tedy nejen genetické, ale i epigenetické změny leží v základech nádorových změn.
Další účastníci uplatňující se v nádorovém procesu
Již z dřívějších dob víme, že nádorové buňky mohou podléhat kontrole buněk normálních. To znamená, že nádorový charakter buňky může být potlačen okolními normálními buňkami v procesu, který se označuje jako kontaktní inhibice. Na něm se podílejí povrchové molekuly buněk a řada působků vylučovaných normálními buňkami. Nádorová tkáň tedy závisí na charakteru mikroprostředí, jež je určováno normálními buňkami, které obklopují nádor nebo do něj vnikají. Tak alespoň v řadě případů normální složky mikroprostředí obměňují růst nádoru.Iniciátory nádorového bujení jsou některé i viry a chemické látky (karcinogeny). Nádorotvorný účinek virů byl detailně probádán a mělo by se o něm referovat zvlášť. Chemické karcinogeny byly rozpoznány jako první vnější faktor mající nádorotvorný účinek. Jejich působení prochází několika stupni. První je iniciace, při které karcinogen vyvolá nepříliš specifikované genetické změny. Nádor se objeví až v druhém stupni, zvaném promoce, a to pod vlivem látek povzbuzujících buněčné bujení (proliferaci). Je tedy chemická karcinogeneze minimálně dvojstupňový proces, kde se vyjma genetické změny uplatní pochody svázané s buněčným množením, a tedy i s proliferací.
Zajímavá je otázka lidských nádorových kmenových buněk. Ta byla nastolena v případě některých lidských nádorů, které bylo možno přenést na nahé myši jen po injekci velkého množství nádorových buněk. Z toho bylo vyvozováno, že schopnost proliferace má jen malý zlomek populace nádorových buněk. Tyto nálezy byly dále rozšířeny a interpretovány tak, že v nádoru existuje kmenová buněčná linie, z níž se odvozují (segregují) nádorové buňky. Evidentní kritická připomínka k těmto pokusům je opřena o hojnou zkušenost ukazující na to, že účinnost přenosu lidských nádorových buněk do zvířat je z mnoha příčin obecně nízká. Také nemáme k dispozici sérii průkazných pokusů na zvířecích modelech.
Samozřejmě není vyloučena možnost, že nádorové kmenové buňky jsou přítomny jen v lidských nádorech, i když se to zdá být nepravděpodobné. Jestliže takové buňky existují, potom by opět bylo třeba vyjasnit, jaké genetické či epigenetické faktory odpovídají za segregaci nádorových buněk. V této oblasti zůstává neobjasněna základní otázka. Je nádorová změna následována návratem k zjednodušenému stavu odpovídajícímu kmenovým buňkám (tj. dediferenciace), nebo je nádorová transformace sama spojena se schopností instruovat jiné buňky tak, aby se staly kmenovými? Odpověď zatím chybí.
Řada známých i neznámých
Od mého prvního článku na toto téma uběhlo 40 let. Během nich jsme poznali geny, které tvorbu nádorů vyvolávají, i ty, které ji potlačují, signální dráhy, které se k nim vážou, i řadu buněčných a molekulárních faktorů ovlivňujících nádorový proces. Ani to zatím nestačilo pro ustavení dlouhodobé účinné léčby nádorů. Nová léčiva jako imatinib byla vyvinuta na základě znalostí struktury onkogenu a jeho produktu a mají zatím spíše krátkodobý účinek. Publikovaná srovnávací studia genomu některých typů nádorů napovídají, že se ve vzniku nádorového bujení může uplatňovat řada dosud neznámých onkogenů a supresorů. Navíc se dostává do popředí i otázka obměňování nádorových vlastností normálními buňkami. Lze tedy uzavřít, že naše znalosti nádorových procesů jsou více než neúplné a zbývá mnoho prostoru k získání ucelenějších poznatků a k jejich propojení. To by mělo významně přispět k vývoji nových účinnějších léčebných postupů. Nádorový výzkum tedy potřebuje nové, mladé hlavy nadšenců, kteří se nezaleknou neúspěchů a kteří budou domýšlet a dopracovávat nejen již otevřené, ale i nové oblasti tohoto výzkumu.Ke stažení
 článek ve formátu pdf [469,02 kB]
článek ve formátu pdf [469,02 kB]















