Případ jedenadvacáté aminokyseliny
Selen patří mezi životně důležité stopové prvky. 1) Člověk ho potřebuje několik desítek mikrogramů denně a při dlouhodobém nedostatku je vystaven riziku řady závažných zdravotních poruch – od ischemické choroby srdeční, aterosklerózy, anemie, poruch imunitního systému, endokrinologických a neurologických onemocnění až po některé karcinomy. V Číně jsou oblasti se zvláště nízkou koncentrací selenu v půdě, kde obyvatelstvo trpí kardiomyopatií nazývanou kchešanská nemoc. 2) V Zairu je nedostatek selenu spolu s nedostatkem jodu příčinou častého výskytu myxedematozního kretenizmu.
Selen je nezbytný pro aktivitu několika skupin oxidoreduktáz, v jejichž aktivních místech je aminokyselina selenocystein. Proteiny, které selenocystein obsahují ve své struktuře, nazýváme selenoproteiny (viz rámeček).
Vznik a výjimečnost selenoproteinů
Selenocysteiny jsou obsaženy sotva v jednom promile z desítek tisíc proteinů našeho těla, a obvykle je v takové bílkovině jenom jeden z nich. Tyto aminokyseliny však mají pozoruhodné účinky a několik jedinečných rysů biosyntézy. Abychom mohli vysvětlit, čím jsou výjimečné, připomeneme několik obecných pravidel, jimiž se řídí uplatnění genetické informace.Genetický kód má téměř univerzální platnost (Vesmír 77, 388, 1998/7), a proto můžeme ke studiu jednoho typu organizmů využívat nástroje vypůjčené jinde. Protein vzniklý překladem lidského genu bude stejný, ať k jeho pořízení použijeme králičí retikulocyty, buněčnou kulturu ze zlatého křečka nebo bakterii Escherichia coli (musíme samozřejmě vládnout technikami, které je přimějí ke spolupráci). Každé ze čtyřiašedesáti možných kombinací čtyř nukleotidů v kodonu (trojici nukleotidů) je přiřazen jednoznačný význam. Jednašedesát kodonů kóduje některou z dvaceti aminokyselin, tři zbývající (stop-kodony UGA, UAA a UAG) slouží jako signál k ukončení vznikajícího bílkovinného řetězce.
V řadě proteinů jsou přítomny i další aminokyseliny, které do „dvacítky vyvolených“ nepatří. Ty vznikají až na sestaveném proteinu „opracováním“ postranních řetězců aminokyselin. Například hydroxyprolin a hydroxylyzin, které jsou nezbytné pro správné fungování bílkovin pojiva, vzniknou hydroxylací prolinu a lyzinu. Kromě toho bývají na postranní řetězce často vázány další skupiny, například fosfát nebo sacharidy. Reakce, jež proteiny pozměňují, nazýváme posttranslační (probíhají až po dokončení překladu genetické informace).
Kdy a jak se selenocystein dostane do proteinového řetězce
V roce 1970 objevil D. Hatfield v mozcích a játrech telat, králíků a kuřat zvláštní serinovou tRNA (viz rámeček), která se váže na stop-kodon UGA. (Serin má k dispozici už dvě jiné, které rozpoznávají dokonce šest kodonů.) Pokud by kodon UGA byl za všech okolností jen signálem k ukončení bílkovinného řetězce, tak by existence tRNA, která jej rozpoznává, neměla žádný smysl. Má-li však někdy i jiný význam, neznamená to nic menšího než výjimku z jednoznačného čtení genetického kódu!
Časem se ukázalo, že uvnitř genů pro selenoproteiny je v místě, které odpovídá poloze selenocysteinu, přítomen kodon UGA. Selenocystein značený radioaktivním uhlíkem 14C se na toto (ani žádné jiné) místo v proteinech nezabudovává, zato serin ano. Uhlíková kostra selenocysteinu pochází tedy ze serinu. Obě aminokyseliny se liší jediným atomem, hydroxyl (OH) je u selenocysteinu zaměněn selenylem (SeH). Pokud bychom na základě obecné znalosti biochemie měli uvažovat o možném způsobu záměny, první myšlenka by téměř určitě patřila nějaké posttranslační modifikaci. Je v tom ale jeden háček: Posttranslační modifikace by byla možná, i kdyby k zabudování serinu byl využit kterýkoli ze šesti klasických kodonů. Pokud však bodovou mutací pozměníme kodon UGA na UCA, na odpovídajícím místě proteinu se ocitne jednou provždy serin – a enzym není aktivní.
Vznik selenocysteinu objasnil až r. 1992 Takaharu Mituzani. Enzym selenocystein-syntáza působí jedině na serin vázaný na onu zvláštní tRNA, nyní už nazývanou tRNASec. Zdrojem selenu pro reakci je selenofosfát. Serin vázaný na ostatní možné tRNASer se nemění. Prostřednictvím tRNASec se do proteinů může zabudovat jedině selenocystein, serin nikoli. Začlenění selenocysteinu do vznikajícího řetězce kontroluje speciální faktor, odlišný od toho, který slouží ostatním dvaceti aminokyselinám. Přeměna aminokyseliny vázané na tRNA je poměrně málo obvyklý jev, který se nazývá kotranslační modifikace.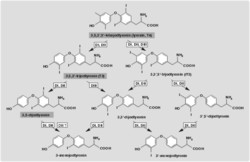
Jak oklamat stop-kodon
Výjimku z obecného pravidla lze učinit za dodržení dvou podmínek. Jednak musí existovat mechanizmus, který výjimku umožní (vynutí, prosadí), a zároveň záruka jejího správného používání, jinak by buď nastala anarchie, anebo by se někdejší výjimka stala novým pravidlem.Už bylo řečeno, že se selenocystein zabudovává jen do některých výjimečných proteinů, na místo označené kodonem, který normálně znamená ukončení syntézy. Geny pro selenoproteiny obsahují zvláštní signální sekvenci SECIS (selenocysteine insertion sequence), která se přepisuje do mRNA, ale nepřekládá do proteinů. Tato sekvence se skládá ze dvou navzájem komplementárních úseků, které jsou odděleny několika nukleotidy. Po jejich spárování vznikne vlásenková struktura se smyčkou, která ve spolupráci s několika zvláštními transkripčními faktory (jejich počet se u živočichů a bakterií liší) vytvoří předpoklady pro jiné čtení kodonu UGA a pro zabudování selenocysteinu do vznikajícího proteinu. Zvláštní signální sekvence SECIS neovlivňuje celou předlohu. Změna čtení se týká jen kodonů UGA, které jsou ve správné vzdálenosti od této sekvence a díky tomu mohou být situovány na vrcholu určité vlásenkové struktury. Stačí jediná bodová mutace v nejbližším okolí, a účinnost zabudování selenocysteinu do proteinu hned výrazně poklesne, což znamená, že se kodonu UGA vrátí (částečně nebo úplně) jeho obvyklý význam. Nezáleží na tom, jestli se změní sousední aminokyseliny – vlásenkovou strukturu dokáže narušit i konzervativní mutace.
Není bez zajímavosti, že bakterie nedovedou zabudovat selenocystein do proteinů syntetizovaných podle živočišných mRNA a naopak. Přestože obě skupiny organizmů mají tuto aminokyselinu ve svých genech zapsánu stejným kodonem, aparáty pro jeho dešifrování (signální sekvence SECIS a s ní spolupracující proteiny) jsou natolik rozdílné, že jsou tyto dva systémy neslučitelné. Není vyloučeno, že jejich původ je nezávislý. Pro tuto domněnku svědčí i velké rozdíly mezi eukaryotickými a prokaryotickými selenoproteiny (tj. nedostatek jejich sekvenční homologie).
Kromě živočichů a bakterií mají selenoproteiny ve své výbavě ještě archaea (o těchto zástupcích mikrobiální říše viz Z. Storchová, Vesmír 76, 612, 1997/11). Rostliny ani houby však selenoproteiny nevytvářejí, vůbec nemají potřebný aparát. Pokud tuto schopnost jejich předkové kdy měli, ztratila se beze stopy. Dokážou však selen zapracovávat do mnoha různých nízkomolekulárních látek, které pro nás, živočichy, mají obdobnou hodnotu jako vitaminy – díky nim můžeme využívat stopová množství selenu rozptýlená v půdě a jejím podloží. 3)
Poznámky
VÝZNAMNÉ SELENOPROTEINY
Glutation-peroxidázy (GPx): Rodina enzymů, která chrání organizmus před poškozením organickými peroxidy, peroxidem vodíku a hydroxylovými radikály, ať už z prostředí anebo z produkce vlastního metabolizmu.
Jodtyronin dejodázy (DI): Hlavním produktem štítné žlázy je hormonálně slabě aktivní tyroxin (3,5,3’,5’-tetrajodtyronin), viz obr. na protější straně.
Tioredoxin reduktázy (TR): Katalyzují NADPH-dependentní redukci tioredoxinu a řady dalších substrátů. Jsou významné pro proliferaci buněk a udržování redukčně-oxidační rovnováhy tiolů.
Selenoprotein P (SelP): Protein dosud nejasné funkce, patrně rovněž antioxidant. Obsahuje nejvíce selenocysteinů – některé formy až 12. Rekord drží dánie pruhovaná (Danio rerio), akvaristům známá také pod jménem zebřička, v jejímž SelP je dokonce 17 selenocysteinů.
Selenoprotein W (SelW): Nejmenší selenoprotein, vyskytující se nejvíce ve svalech, ale byl nalezen i v jiných tkáních. Zatím neznáme jeho funkci.
Selenofosfát syntáza (SPS2): Katalyzuje syntézu monoselenofosfátu ze selenidu a ATP za uvolnění AMP a fosforečnanu.
TRANSFEROVÉ RNA
Při překladu genetické informace hrají klíčovou roli transferové RNA a enzymy nazývané aminoacyl-tRNA syntázy. Všechny tRNA mají tvar trojlístku. Na prostředním lístku nesou antikodon, trojici nukleotidů, která je komplementární k příslušnému kodonu. Aminoacyl-tRNA syntázy připojují na jejich konec – stopku trojlístku – tu správnou aminokyselinu. Pro řadu bílkovinotvorných aminokyselin existuje několik tRNA, neboť většina aminokyselin je v genech kódována několika způsoby. tRNA pro danou aminokyselinu může být ale méně než kodonů, protože pro párování třetího nukleotidu ve dvojici kodon-antikodon platí volnější pravidla. Naproti tomu pro každou aminokyselinu stačí jedna aminoacyl-tRNA syntáza, která ji připojuje ke všem správným tRNA. (Enzym se neorietuje podle antikodonu, ale podle jiných úseků tRNA.)
Každou tRNA označujeme v pravém horním indexu zkratkou názvu aminokyseliny, k jejímuž přenosu slouží, např. serinová tRNA se značí tRNASer. Pro naše vyprávění je důležité, že aminokyselina serin je kódována šesti kodony, k jejichž rozpoznání jsou k dispozici dvě tRNASer: jedna pro dvojici AGU a AGC, druhá pro čtveřici kodonů UCX (X znamená libovolný nukleotid). Aminokyselinu k oběma připojuje tentýž enzym – seryltRNASer syntáza, která kromě toho syntetizuje i seryltRNASec, na níž působením selenocystein-syntázy vzniká selenocystein.
REGULACE PROTEOSYNTÉZY JEDNOTLIVÝCH SELENOPROTEINŮ
/Pro čtenáře s hlubším zájmem/
Všechny druhy selenoproteinů nejsou pro chod buňky (a tím i celého organizmu) důležité ve stejné míře. Vzhledem k tomu, že tvorba selenocysteinu je plně závislá na příjmu selenu s potravou, zdálo by se logické, že se vytvoří hierarchie proteosyntézy jednotlivých selenoproteinů podle dostupnosti selenu. Skutečně se zjistilo, že selenoproteiny mají v závislosti na přívodu selenu různou míru syntézy. Regulaci se sice nepodařilo nalézt na úrovni přepisu z DNA na mRNA, ale byla objevena hned ve dvou momentech následujícího kroku – proteosyntézy.
Tím prvním je stabilita příslušné mRNA (při vyšší stabilitě mRNA se vytvoří postupně více molekul příslušné bílkoviny), druhým je napojování selenocysteinu do molekuly proteinu při její tvorbě. U některých selenoproteinů se při nízkém stavu selenu v buňce nedokáže navázat SeCys-tRNASec na triplet UGA, ten zaúřaduje jako koncový a uvolní ještě nehotovou bílkovinu. Analýzami množství jednotlivých selenoproteinů a jejich mRNA byla určena jejich hierarchie, která pro játra selen-deficientních krys (různé orgány různých živočichů se v této hierarchii liší, zřejmě v rámci regulace celého organizmu) vypadá pro samotné selenoproteiny následovně (od nejzranitelnějšího enzymu k nejodolnějšímu): GPx1>DI1>SelP, TR1>>GPx4, přičemž s výjimkou GPx4 jde o pokles o 90–99 % původní hodnoty. Koncentrace příslušných mRNA se, s výjimkou GPx1, tak dramaticky nemění (jde o pokles mezi 50 a 10 %, u mRNA odpovídajícího GPx1 je pokles o 90 %) a pořadí poklesu jejich mRNA je mírně odlišné: GPx1>>DI1>TR1>SelP,GPx4.
Dále se na regulaci podílí samotná tvorba selenocysteinu ze serinu na tRNASec. Syntézu selenofosfátu, potřebného pro tuto reakci, katalyzuje enzym selenofosfát-syntáza, který je rovněž selenoproteinem a podléhá také regulaci podle dostupnosti selenu. Tím se vytváří zpětná vazba, která oba dva zmíněné regulační mechanizmy zesiluje.
Je zřejmé, že při využití výhod přítomnosti selenu pro redoxní reakce organizmu se vytvořily i mechanizmy ochrany těch nejdůležitějších selenoproteinů.
Ke stažení
 Článek ve formátu PDF [272,62 kB]
Článek ve formátu PDF [272,62 kB]

























