Úniková hra Parazit
Únikové hry zažívají v dnešní době velkou popularitu. Nejsou však na Zemi ničím novým; už mnoho milionů let je hrají parazité se svými hostiteli. Pro parazity je to hra o přežití. Prohrou ztrácejí šanci rozmnožit se a dostat své potomstvo do dalšího hostitele. Postupem času se z některých parazitů stali mistři v klamání obranných reakcí hostitele do té míry, že jsou schopni v jeho těle žít i několik desítek let.
Na jedné straně tu stojí parazit snažící se využít zdroje hostitele k produkci potomstva. A na straně druhé tu je hostitel, který brání své vnitřní zdroje pomocí profesionálně vyškolené policie zvané imunitní systém. Hostitel vybírá obranné strategie a nejúčinnější zbraně podle toho, kde se parazit nachází. U jednobuněčných parazitů nacházejících se volně v krvi hostitele závisí obrana především na protilátkách, na imunitních buňkách schopných pohlcovat větší částice (fagocytech) a na sérových proteinech podílejících se na imunitních reakcích (komplementu).
Tento arzenál imunologických zbraní má ale omezenou účinnost, pokud se parazit nachází ve střevech. Tam je obrana hostitele založena na sekretorických protilátkách typu Imunoglobulin A (IgA), antimikrobiálních peptidech a neimunitních mechanismech spočívajících v obnově střevní výstelky či zvýšeném pohybu svalstva trávicího ústrojí (peristaltice). V případě vnitrobuněčných parazitů pak přichází ke slovu buněčná složka imunity v podobě NK buněk, T lymfocytů a makrofágů. Aby parazit přežil, používá k oklamání obrany svého hostitele různé únikové strategie.
Maskování a mimikry
Velmi účinnou metodou, jak oklamat obranu hostitele, je maskování. Splynout s prostředím. Vypadat jako buňka hostitele. Mistrem v kamufláži je například parazitický prvok Trypanosoma cruzi, který u lidí způsobuje Chagasovu chorobu a dokáže v lidském těle přežít i několik desítek let. Trypanosoma disponuje velmi účinným enzymem – trans-sialidázou – kterým je schopna během několika sekund po vstupu do hostitele navázat na svůj povrch kyselinu sialovou z povrchových glykokonjugátů okolních buněk.
Kyselina sialová se vyskytuje na povrchu všech buněk hostitelského obratlovce a slouží jako tzv. molekulární občanka (self-associated molecular pattern), podle které imunitní systém pozná, že jde o buňku vlastní a ne o nepřítele. Přítomnost kyseliny sialové na povrchu zaručuje trypanosomě mimo jiné ochranu vůči komplementu (váže faktor H a tím zamezí tvorbě C3 konvertázy). Význam této únikové strategie dokresluje fakt, že trypanosoma má ve svém genomu hned 70 genů kódujících funkční formu trans-sialidázy.
Paraziti však dokáží obranu hostitele oklamat i díky vlastním molekulám, které v některých ohledech připomínají molekuly hostitele. Jakési molekulární mimikry. Tak například infekční stádia Trypanosoma cruzi (trypomastigoti) mají na svém povrchu protein T-DAF, molekulu sekvenčně i funkčně podobnou lidskému DAF (decay-accelerating factor). Stejně jako u lidí, i T-DAF urychluje rozpad C3 konvertázy a chrání tak buňku před negativními důsledky aktivace zmíněného komplementu.
Stále nový nepřítel
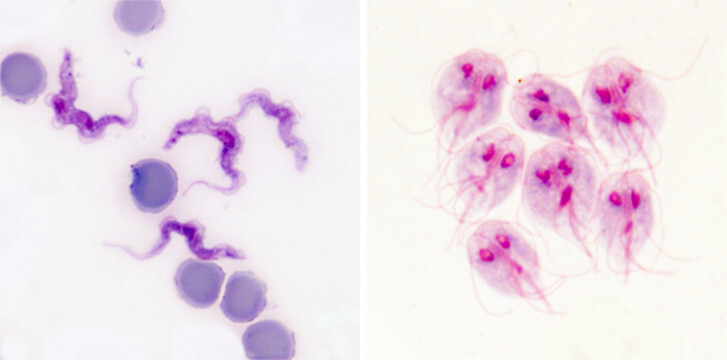
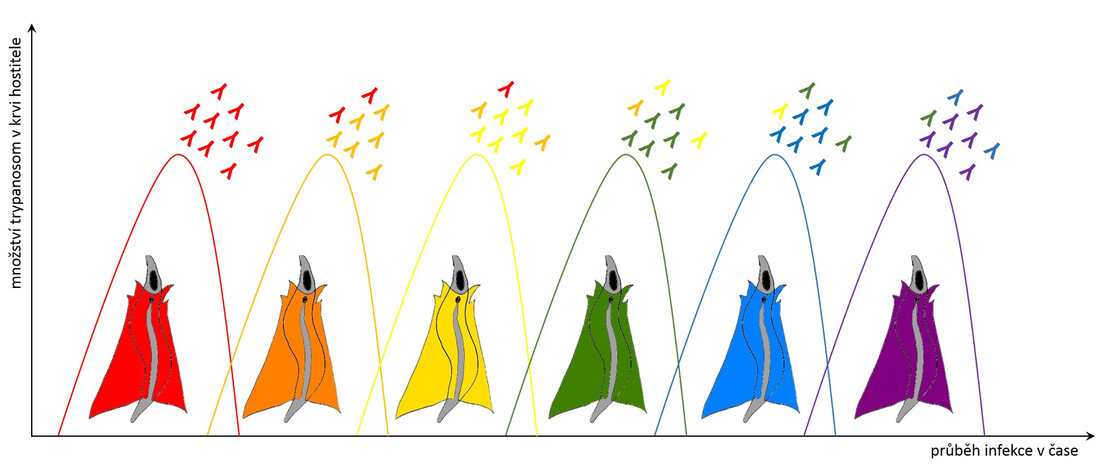
Krevní paraziti vsadili také na strategii zvanou antigenní variabilita. Typickým příkladem je původce spavé nemoci trypanosoma spavičná (Trypanosoma brucei rhodesiense a T. b. gambiense), která ve svém genomu disponuje až stovkou různých variant jednoho jediného proteinu. Tento variabilní povrchový glykoprotein (VSG, Variant Surface Glycoprotein) tvoří jakýsi kabát, který chrání životně důležité nevariabilní povrchové molekuly. Je vysoký asi 15 nm a tvořený 10 milióny molekul.
Trypanosoma má na svém povrchu vždy jen jednu variantu VSG, proti které se postupně tvoří specifické protilátky. Pokud je protilátek navázaných na VSG málo, dokáže je trypanosoma ze svého povrchu odstranit pohlcením (endocytózou). Celý svůj povrch takto očistí velmi rychle (během 12 minut), přičemž pohlcené protilátky degraduje, zatímco VSG recykluje a vrací na povrch. Postupem času však protilátek přibývá a trypanosoma podléhá … Šťastný konec (pro parazita) tu chybí jen zdánlivě. S frekvencí zhruba 1:100 000 se v jedné generaci trypanosom najde pár buněk, které začnou produkovat jinou variantu VSG a obrana hostitele začíná nanovo. Protilátky jsou proti nové populaci trypanosom neúčinné a trypanosomy se mohou v klidu začít množit do doby, než je obrana hostitele schopná vytvořit dostatečné množství protilátek proti nové variantě VSG. A tak to jde pořád dokola, po každém zdánlivém vítězství imunitního systému se vždy objeví populace trypanosom s jiným kabátem. Toto nekonečné převlékání kabátu postupně imunitní systém zcela vyčerpá.
Podobnou strategií antigenní variability disponuje i lamblie střevní (Giardia intestinalis), původce průjmového onemocnění giardiózy. Na rozdíl od trypanosomy se lamblie nevyskytuje v krvi, ale ve střevech. Žije na povrchu enterocytů tenkého střeva. Nicméně i zde je vystavena působení protilátek, především typu imunoglobulin A (IgA).
Giardie mají ve svém repertoáru až 150 genů pro různé varianty povrchového proteinu nazvaného VSP (Variant-specific Surface Protein). Každá buňka produkuje vždy jen jednu variantu VSP, ale na rozdíl od trypanosom se u giardií v daném čase vyskytuje více jedinců s odlišnými variantami.
U obou zmiňovaných druhů parazitů (Trypanosoma brucei a Giardia intestinalis) je přesmyk na novou variantu povrchového proteinu spontánní a nezávislý na vnějších podnětech, včetně přítomnosti a množství specifických protilátek.
Hra na schovávanou
Oblíbenou strategií je i únik do nitra buňky, kde je parazit „méně na ráně“. Takto uniká před složkami látkového (humorálního) imunitního systému například Plasmodium (původce malárie), Toxoplasma (původce toxoplasmózy), Leishmania (původce kožních, kožně-slizničních či orgánových forem leishmaniózy) či výše zmiňovaný původce Chagasovy choroby Trypanosoma cruzi. Ani uvnitř buňky však nejsou úplně v bezpečí. I zde imunitní systém disponuje možnostmi, jak napadenou buňku odhalit a parazit tak nesmí usnout na vavřínech.
Jak se paraziti dostávají do nitra buňky? Plasmodium a Toxoplasma patří mezi výtrusovce (Apicomplexa), kteří disponují sofistikovaným aparátem – apikálním komplexem – pro aktivní vstup do hostitelské buňky. Parazit se díky němu pomalu zavrtává do hostitelské buňky, přičemž kolem sebe zároveň vytváří ochranný obal zvaný parazitoforní vakuola. Tu tvoří membrána hostitelské buňky vylepšená molekulami parazita a chrání parazita před obrannými reakcemi hostitelské buňky.
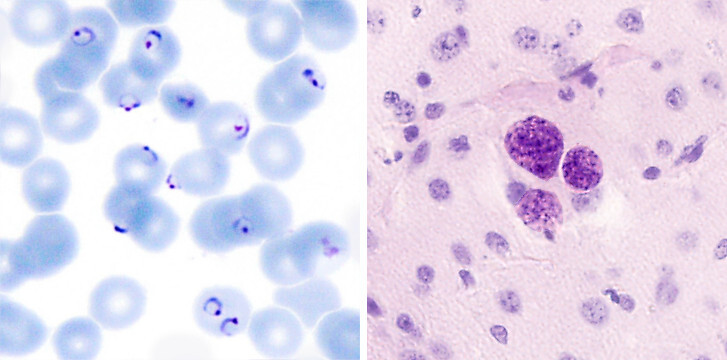
V případě plasmodia jsou nejdříve cílem jaterní buňky. Vstupní branou infekce je však kůže. Tu překoná pomocí svého krevsajícího přenašeče. V těle hostitele se pak plasmodium spoléhá mimo jiné na svou úžasnou rychlost – dalo by se říci, že je takový Usain Bolt mezi parazity. Rychlostí 1-2 mikrometry za sekundu je schopné doslova utéci daleko pomalejším buňkám imunitního systému a do půl hodiny po infekci se schovat v jaterní buňce. A za sebou zanechává pěknou spoušť. Než se usadí v jaterní buňce, několik jiných vytuneluje; proleze několika jaterními buňkami a jaterními makrofágy, což vytváří protizánětlivé prostředí vhodné pro přežití parazita. Ve vyvolené buňce se plasmodium usadí a dojde k první fázi nepohlavního množení. Buňka napěchovaná parazity však nepraská. Infikovaná jaterní buňka sice podlehne programované buněčné smrti (apoptóze), avšak ukazatel buněčné smrti v podobě fosfatidylserinu se na vnější straně membrány neobjevuje. Tato nálož parazitů obalená membránou jaterní buňky pluje krevním řečištěm kolem nic netušících složek imunitního systému až do kapilár plic. Tam konečně membrána jaterní buňky praská a parazit se vzápětí znovu ukrývá, tentokrát do červených krvinek. Výhodou červených krvinek je nepřítomnost povrchových MHC molekul zprostředkovávajících imunitnímu systému informaci o tom, co se děje uvnitř buňky.
Jeden druh lidského plasmodia jde v únikových strategiích ještě dál – zimnička tropická (Plasmodium falciparum) je schopná proměnit povrch infikované krvinky svými vlastními proteiny (hlavní složkou je PfEMP, P. falciparum Erythrocyte Membrane Protein). Ty umožní, aby se napadená krvinka navázala na vnitřní povrch cévy. Parazit se tak může ukrýt v kapilárách různých orgánů, ideálně co nejdále od sleziny jako klíčového orgánu pro odstranění infekce. Tento proces nazývaný sekvestrace je pro hostitele velmi nebezpečný a v případě usazování infikovaných krvinek v kapilárách mozku může být i smrtelný. Sekvestrace může být také příčinou falešně negativního výsledku diagnostického testu; pacienti mohou mít závažné klinické příznaky i v době, kdy jsou paraziti v periferní krvi přítomni jen v nízkých počtech.
Odlišnou strategii ve výběru hostitelské buňky zvolila Toxoplasma, která nachází úkryt v jakékoliv jaderné buňce hostitelského obratlovce. V chronické fázi infekce dochází ke zdánlivému příměří mezi toxoplasmou a imunitním systémem. Toxoplasma se ukryje uvnitř hostitelské buňky, kde se množí pomalu ve formě bradyzoitů, obklopena stěnou tkáňové cysty. Cysty nevyvolávají v tkáních zánětlivou odpověď a zřejmě nijak neovlivňují funkce okolních buněk až do doby, kdy cysta praskne, paraziti se uvolní z hostitelské buňky a začnou se opět rychle množit ve formě tachyzoitů. Ti jsou ale vnímaví vůči působení imunitního systému a jsou rychle zničeni nebo zahnáni zpět do buněk. Pokud je hostitel schopen se tachyzoitům účinně bránit, je zároveň schopen ignorovat tkáňové cysty s pomalu se množícími stádii a okolní tkáň (a potažmo hostitel) tak zůstává bez poškození. V takovém hostiteli pak může toxoplasma žít a množit se i několik desítek let, aniž by to nakaženého člověka nějak výrazněji ovlivnilo a omezovalo.
Také Trypanosoma cruzi nachází úkryt v jakékoliv jaderné buňce svého obratlovčího hostitele. Nepatří však mezi výtrusovce a tudíž jí chybí vybavení pro přímý aktivní průnik do hostitelské buňky. Je však velmi „výmluvná“ a dokáže buňku přesvědčit, aby ji pohltila. V chronické fázi infekce jsou to především buňky svalové a tukové tkáně.
Pro přežití trypanosomy je následně důležité splynutí fagosomu (membránou obaleného váčku s pohlceným parazitem) s lysozomem buněčná organela obsahující trávicí enzymy) za vzniku fagolysosomu. Kyselé prostředí fagolysosomu totiž umožňuje správné fungování molekuly Tc-Tox. Tato molekula produkovaná parazitem se chová podobně jako složka C9 sérových proteinů podílejících se na imunitních reakcích (komplementu) – tvoří póry v membráně parazitoforní vakuoly, která se rozpadá a trypanosoma uniká před trávicími enzymy do cytoplasmy, kde se následně množí.
Stejně jako u toxoplasmy, ani buňky infikované trypanosomou nevyvolávají v okolní tkáni zánětlivou reakci až do doby, kdy buňka praskne a paraziti se uvolní do mezibuněčného prostoru. V hostiteli, jehož imunitní systém funguje tak, jak má, může T. cruzi žít a množit se i několik desítek let. Pro parazita ideální stav - hostitel je pro krevsajícího přenašeče infekční po celou dobu svého života a samotná infekce je pro něj smrtelná jen výjimečně.
Pod svícnem největší tma
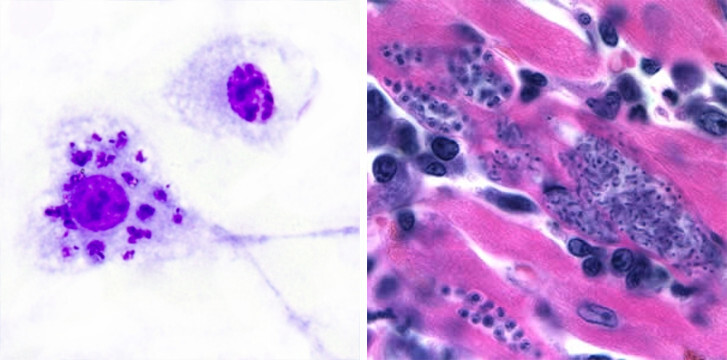
Někteří vnitrobuněční paraziti si zvolili jako svou hostitelskou buňku přímo členy obranných jednotek – makrofágy; buňky, jejichž posláním je pohltit a následně zlikvidovat vše cizorodé a nebezpečné. Zdánlivě nesmyslná strategie však umožňuje parazitům, kteří nejsou schopni aktivního proniknutí do hostitelské buňky, využít přirozené schopnosti těchto buněk pohlcovat (fagocytovat). Jen je třeba fagocyty přesvědčit, že jsou chutným soustem a následně zablokovat jejich schopnost pohlceného parazita zničit.
Takovým parazitem je třeba Leishmania, která nemá nástroje pro přímý průnik do buňky a spoléhá na pozření fagocytem. Šanci, že bude pohlcena, zvyšuje navázáním protilátek a složek komplementu na svůj povrch. Takto označena se stává „chutnější“ a oklamaný makrofág ji dobrovolně pozře, netuše, že tohle sousto mu bude ležet „v žaludku“ (fagolysosomu) ještě hodně dlouho.
Pohlcená leishmanie je obalená membránou hostitele (fagosom). Tento váček následně splývá s lysozomem, ale kyselé prostředí fagolysozomu parazitovi nevadí a spokojeně se množí. Leishmanie si během svého pobytu přetváří makrofága k obrazu svému – blokují mikrobicidní aktivity infikované buňky (tlumí respirační vzplanutí, produkci oxidu dusnatého a prozánětlivých cytokinů) a snižují jeho schopnost prezentovat leishmaniové antigeny dalším buňkám imunitního systému.
Leishmanie jsou také schopné oddálit apoptózu hostitelské buňky, ale ne jí zcela zabránit. Avšak v době, kdy makrofág buněčné smrti podlehne, jsou leishmanie již připravené uniknout a infikovat další buňku.
Trypanosoma cruzi se obranným reakcím makrofágů brání jiným způsobem. Proti účinkům kyslíkových radikálů jsou trypanosomy odolné díky produkci vlastních antioxidačních enzymů. A pomáhá i změna lokalizace v parazitované buňce – již zmiňovaný přesun z fagolysosomu do cytoplasmy.
Parazitem proti rakovině
Další výhodou úkrytu v buňkách imunitního systému je jejich pohyblivost. Paraziti tak lépe překonávají bariéry a imunitní nástrahy těla hostitele. Například Toxoplasma si velmi účinně dokáže „osedlat“ dendritické buňky a monocyty a dostat se díky nim z krevního řečiště do mozkové tkáně. Infikované buňky jsou dokonce více pohyblivé než ty neinfikované.
Také Trypanosoma brucei zřejmě využívá schopnosti bílých krvinek překonat hematoencefalickou bariéru, aby se dostala do mozkové tkáně. Je však parazitem mimobuněčným, proto jí nezbývá nic jiného než se jako malý zlodějíček krást v těsném závěsu za T lymfocyty, které jsou schopné na krátkou dobu rozvolnit jinak nepřekonatelnou bariéru.
Uvedený výčet únikových strategií jednobuněčných parazitů určitě není zcela kompletní. Stále je co objevovat. Paraziti jsou fascinující tvorové a jejich schopnost klamu a únikových strategií vede mimo jiné k odhalování základních zákonitostí fungování imunitního systému jako takového. Jejich únikové strategie jsou však i zdrojem inspirace pro vývoj nových léčebných postupů. Jako příklad lze uvést dlouhodobě známý, ale stále nedostatečně prozkoumaný protinádorový efekt infekce Trypanosoma cruzi.
K dalšímu čtení...
Lamb T. J.: Immunity to parasitic infection. Wiley-Blackwell. John Wiley & Son, 2012, DOI: 10.1002/9781118393321.
Horn D.: Antigenic variation in African trypanosomes. Molecular & Biochemical Parasitology, 2014, DOI: 10.1016/j.molbiopara.2014.05.001.
Zambrano-Villa S. et al.: How protozoan parasites evade the immune response. TRENDS in Parasitology, 18(6):272, 2002, DOI: 10.1016/S1471-4922(02)02289-4.
Ramírez-Toloza G. et al.: Is the Antitumor Property of Trypanosoma cruzi Infection Mediated by Its Calreticulin? Frontiers in Immunology, 2016, DOI: 10.3389/fimmu.2016.00268.
Volf P. et al.: Paraziti a jejich biologie, Triton 2007, ISBN: 978-80-7387-088-9.
O autorovi
Iva Kolářová