Alarmony, ochránci bakteriální RNA
| 7. 12. 2020Molekuly RNA podléhají řadě modifikací, které ovlivňují jejich prostorové uspořádání, aktivitu a stabilitu. Jak důležité pro správné fungování buněk a celých organismů tyto modifikace jsou, poznáváme až v posledních letech. Buněčný aparát může mimo jiné svým molekulám RNA nasadit ochranné čepičky – a v případě potřeby je opět „smeknout“. Do tohoto příběhu nyní promluvily i molekuly signalizující stres, které známe již půl století.
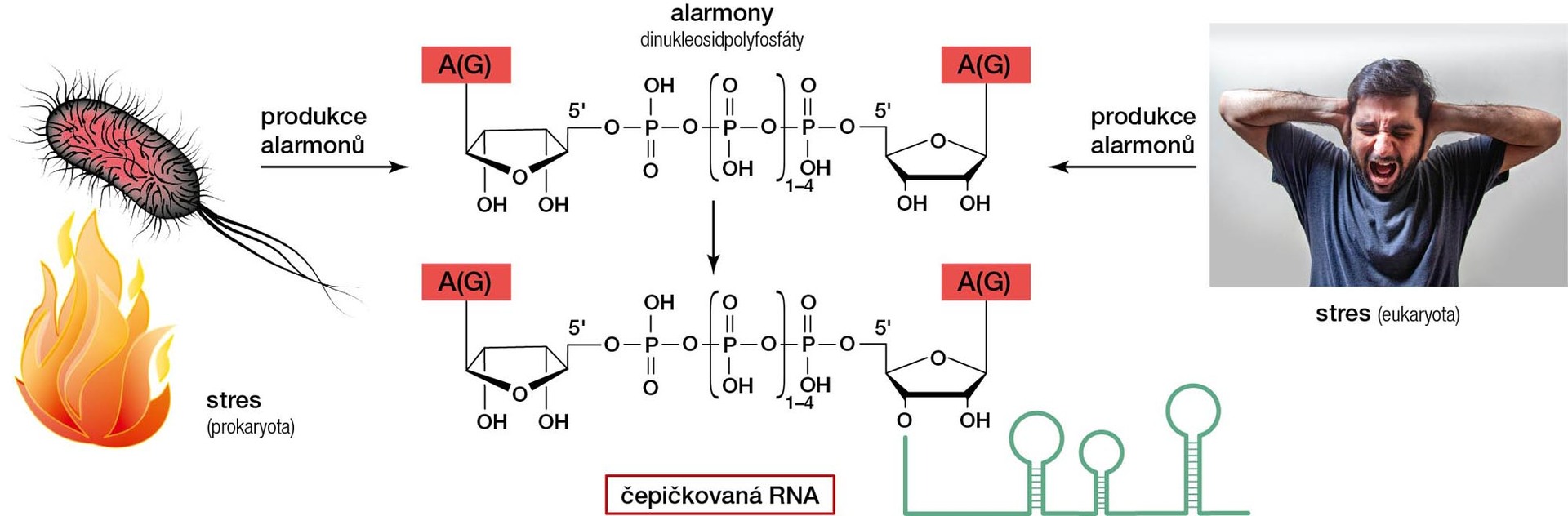
Před více než padesáti lety byly v téměř všech organismech nalezeny molekuly zvané dinukleosidpolyfosfáty, které se skládají ze dvou nukleosidů spojených oběma 5'-konci pomocí fosfátů, přičemž polyfosfátový řetězec obsahuje 2 až 7 fosfátových skupin [1]. Výzkum na modelové bakterii Escherichia coli ukázal, že se koncentrace těchto molekul výrazně zvyšuje v buňkách vystavených stresovým podmínkám (teplotnímu šoku, oxidativnímu stresu, hladovění). Právě z tohoto důvodu se dinukleosidpolyfosfátům říká alarmony. Můžeme se na to dívat tak, že tyto molekuly představují alarm a říkají organismu: „Pozor, jsi v nebezpečí stresu.“
Dodnes ale netušíme, co v buňce takový signál rozpozná a jak přesně funguje. Je však známo, že se alarmony v lidském těle podílejí např. na regulaci krevního tlaku či proliferaci buněk svaloviny cévní stěny. V buňkách vznikají pravděpodobně vícero mechanismy, nejtypičtěji pomocí enzymů aminoacyl‑tRNA- syntetáz, jejichž hlavním posláním je „nabití“ transferových RNA (tRNA) příslušnými aminokyselinami, které se pak na ribozomech podílejí na výstavbě proteinů.
RNA modifikace
V genomu je přibližně 80 % DNA přepisováno do RNA, ovšem pouze 5 % z těchto přepisů nese informace k překladu do proteinů. Zbylé RNA jsou označovány jako tzv. nekódující RNA (non-coding RNA). Přestože sekvence neboli pořadí jednotlivých nukleotidů je hlavním nositelem informace, záleží také na sekundární struktuře molekuly, tedy na jejím prostorovém uspořádání. Navíc hrají významnou roli modifikace RNA, kterých je v současné době známo okolo 170. Dlouhou dobu byly přehlíženy a až v posledních pár letech začínáme chápat, že mohou hrát klíčovou roli ve stabilitě, lokalizaci či aktivitě dané RNA. Avšak úloha většiny z nich zůstává neobjasněna. Mezi nejčastější typy vnitřních modifikací (uprostřed řetězce RNA) patří metylace, hydroxymetylace či acetylace.
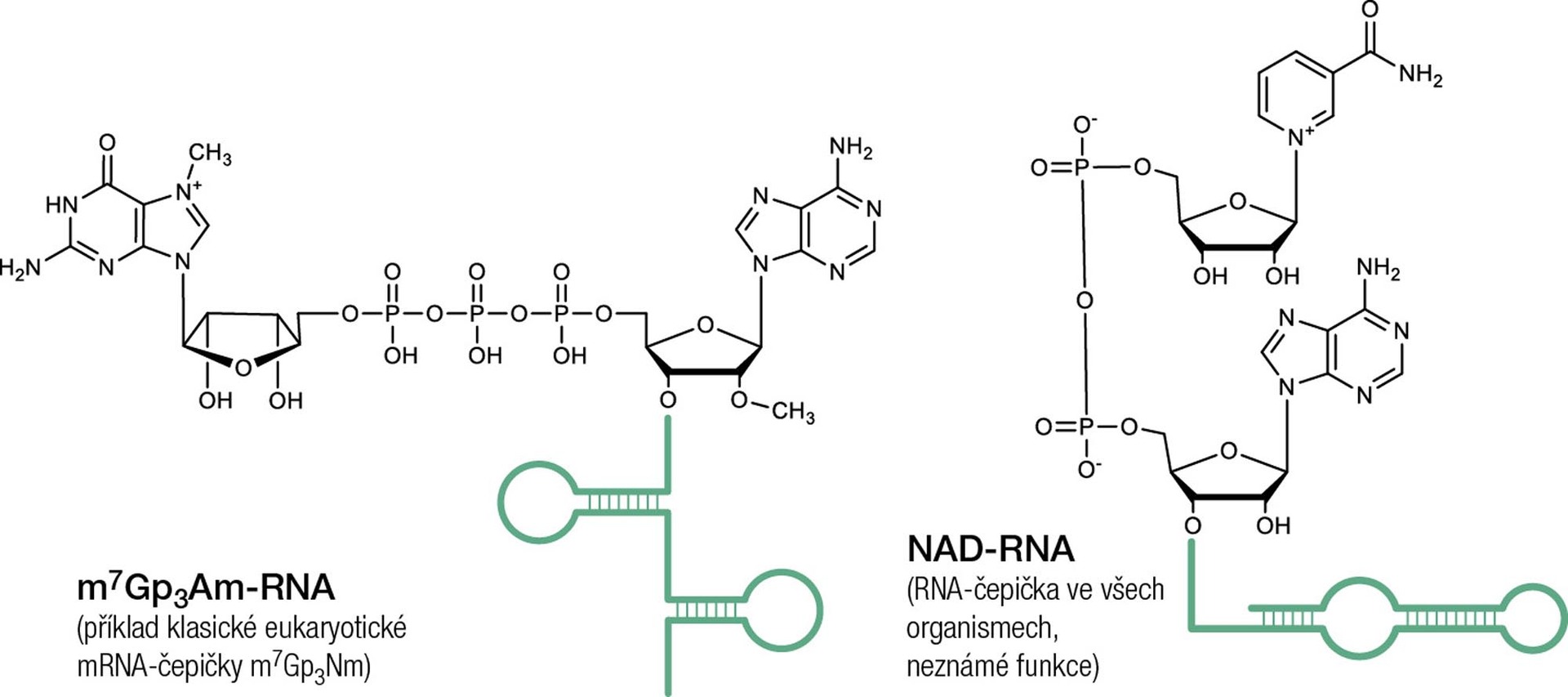
Specifickým typem RNA modifikací je i takzvaná čepička na 5'-konci RNA. Dlouho se mělo za to, že se vyskytuje pouze na mRNA v buňkách vyšších organismů (eukaryot), kde hraje důležitou roli při zahájení přepisu RNA do proteinu a zároveň ovlivňuje stabilitu RNA. Toto dogma bylo zbouráno v roce 2009, kdy se podařilo zjistit, že i jiný typ molekuly, nikotinamidadenindinukleotid (NAD), je kovalentně vázán na prokaryotickou RNA [2]. Tudíž i bakterie si chrání svoji RNA čepičkou. Později se podařilo vyvinout metodu k selektivnímu vychytávání 5'-NAD-RNA (NAD captureSeq) [3] a určit, na kterých konkrétních RNA se tato čepička nachází. Po aplikaci této metody je už jasné, že se čepička NAD-RNA vyskytuje i v lidských nebo rostlinných buňkách. Nicméně její role není doposud zcela pochopena.
Alarmony jako čepičky na RNA
O přepis z DNA do molekuly RNA se v buňkách stará RNA-polymeráza, která RNA buduje z nukleosidtrifosfátů. V naší laboratoři jsme si všimli, že chemická struktura alarmonů se jim zčásti podobá. Proto nás napadlo podstrčit RNA-polymeráze alarmony a pozorovat, co se stane. K našemu překvapení jsme zjistili, že RNA-polymeráza je snadno přijímá a využívá jako první a neklasické nukleotidy (ang. NCIN – non-canonical initiating nucletide), čímž plní roli nového druhu 5'-čepičky [4].
Veškeré in vitro pokusy jsme prováděli se dvěma typy RNA-polymeráz: bakteriofágovou RNA-polymerázou T7, která se hojně využívá v molekulární biologii, a bakteriální RNA-polymerázou E. coli.
Vezmeme-li v potaz vysokou koncentraci alarmonů v buňkách a nově odhalenou schopnost RNA-polymeráz využít tyto molekuly jako 5'-čepičky, nabízelo se zjistit, jestli se v bakteriích tento druh 5'-čepiček skutečně přirozeně vyskytuje. Za tímto účelem jsme z bakterií E. coli izolovali frakci krátké RNA s délkou do 200 nukleotidů a tu jsme dále studovali. Enzymově jsme ji rozštěpili na základní stavební kameny – nukleotidy s nízkou molekulovou hmotností – a analyzovali jsme je pomocí kapalinové chromatografie a hmotnostní spektrometrie. Metodu štěpení jsme zvolili tak, aby čepičky zůstaly netknuté a mohli jsme je detekovat.
Touto technikou se podařilo objevit devět dosud neznámých 5'-čepiček tvořených molekulami alarmonů. Překvapilo nás, že většina z nich nese na základním skeletu tvořeném dinukleosidpolyfosfátem ještě další modifikace v podobě jedné nebo dvou metylových skupin. Jednou z nově identifikovaných bakteriálních 5'-čepiček je i m7Gp4Gm, což je struktura velmi blízká eukaryotické čepičce na mRNA. Jediný rozdíl je v délce polyfosfátového řetězce, který obsahuje jeden fosfát navíc.
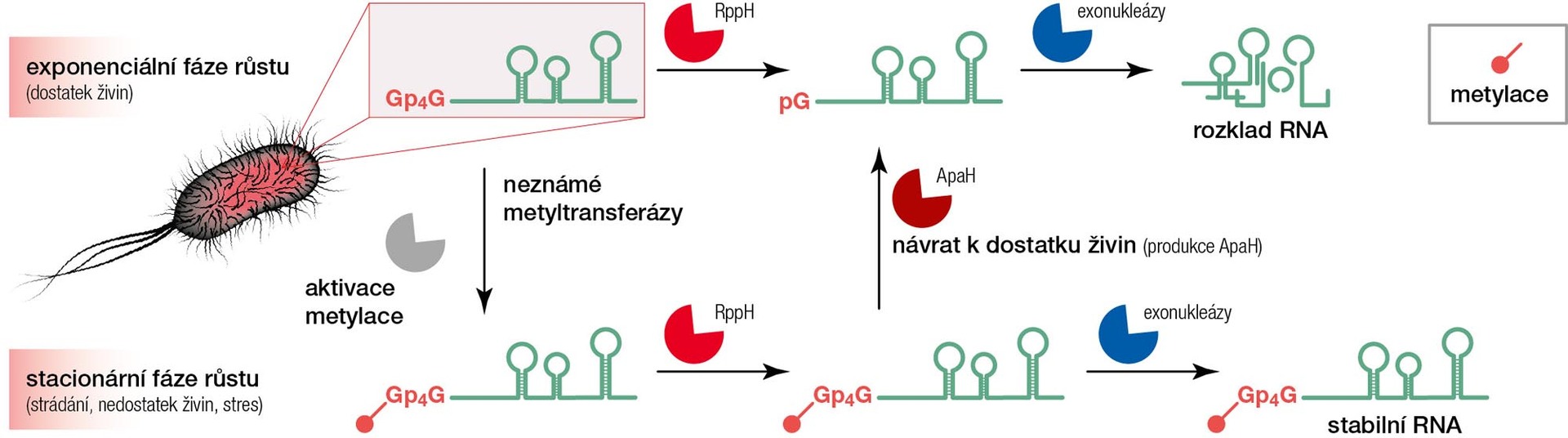
Zároveň jsme zjistili, že množství těchto RNA-čepiček je podstatně vyšší v pozdní stacionární fázi buněčného cyklu než ve fázi exponenciální. To znamená, že v exponenciální fázi růstu, kdy mají buňky dostatek všech živin, nese tyto čepičky mnohem menší podíl RNA. Oproti tomu pozdní stacionární fáze představuje jistý druh stresu: buňky nemají dostatek živin, a navíc jsou vystaveny zplodinám metabolismu a zbytkům z okolních umírajících buněk. Jak jsme zmínili v úvodu, právě během stresu roste koncentrace alarmonů uvnitř buňky. Stejně tak rostl počet typů RNA-čepiček i jejich absolutní množství.
Jak se čepičky zbavit
Přítomnost RNA v organismech je velmi pečlivě regulována. To znamená, že pokud se tvoří RNA nesoucí alarmonové čepičky, musí také existovat mechanismus, kterým jsou tyto látky odbourávány (degradovány). Samotné molekuly alarmonů jsou štěpeny enzymy nazývanými Nudix-hydrolázy (zkratka Nudix znamená nukleosiddifosfát spojený s dalším libovolným substituentem x).
Stejně jako alarmony se i tyto enzymy vyskytují ve všech živých organismech. E. coli má celkem 13 různých enzymů Nudix, my lidé jich máme dokonce 24. Jednou z jejich funkcí je včasné štěpení chybně vytvořených nukleosidtrifosfátů, které by jinak mohly být začleněny do nově vytvářeného vlákna DNA a způsobovat mutace. Zůstává otázkou, zda je na takovou činnost třeba tolik různých enzymů, a jestli tedy Nudixy nemají ještě nějakou jinou funkci.
Mezi bakteriální enzymy Nudix se řadí i RppH (5'-pyrofosfohydroláza), která je schopna štěpit difosfát a trifosfát navázaný na RNA přes 5'-konec. Produktem této reakce je 5'-monofosfátová RNA. Ta je následně dobře rozpoznatelná exonukleázami, které ji štěpí na základní stavební bloky použitelné (po dalším opracování) k syntéze nových molekul RNA. Pokusy in vitro navíc ukázaly, že je RppH schopna štěpit i jednotlivé volné alarmony.
Když jsme poskládali tyto informace dohromady, napadlo nás, že přirozenou funkcí tohoto enzymu může být štěpení alarmonů na 5'-konci RNA. Pomocí vhodně navržených experimentů se nám podařilo prokázat, že reálnou funkcí tohoto enzymu je právě odčepičkování alarmonů z RNA.
RNA bez čepičky je pak určena k degradaci. Zajímavé bylo zjištění, že přítomnost metylové skupiny na alarmonu brání RppH ve štěpení a daná RNA zůstává stabilní. Ale paralelně s tímto enzymem se nám podařilo najít ještě další enzym, zvaný ApaH, který nejenže dokáže odštěpovat alarmonové čepičky z RNA, ale nevadí mu ani metylace, které jinak brání RppH ve štěpení. Buňka má tedy možnost zbavit se jakékoliv RNA, jen musí citlivě regulovat přítomnost těchto dvou enzymů.
Nasadit a smeknout: regulace RNA
Nově objevené alarmonové čepičky v bakteriích spolu s odhalením odčepičkovávací aktivity známých hydroláz (RppH a ApaH) nás inspirovaly k navržení metabolického mechanismu, který by mohl vysvětlit funkci těchto čepiček v bakteriích. Během exponenciální fáze buněčného cyklu, kdy mají buňky dostatek živin a intenzivně se množí, je koncentrace RNA čepičkované alarmonem nízká. Buňka udržuje vyšší hladinu obou enzymů (RppH, ApaH), aby mohla neustále obnovovat zásobárnu aktuálně potřebné RNA. Když se ale buňka dostane do stavu strádání, kdy nemá dostatek živin, začne si chránit už připravenou RNA pomocí alarmonové čepičky, kterou navíc metyluje.
Důvodem je to, že buňka nemá dostatek stavebních bloků pro tvorbu nových makromolekul (RNA, proteinů) a snaží se zachovat alespoň to, co v danou chvíli má. V takové fázi si udržuje velmi nízkou koncentraci hydrolázy ApaH, která umí jako jediná štěpit metylované alarmonové RNA-čepičky. Když se buňka opět ocitne ve vhodném prostředí s dostatkem živin pro své rozmnožování, zvýší se koncentrace ApaH hydrolázy, která štěpením metylovaných alarmonových čepiček zbaví dané molekuly RNA ochrany. Nechráněné RNA mohou být rozloženy exonukleázami na základní stavební bloky a použity pro tvorbu nových RNA v nově vznikajících buňkách. Buňka je tak schopna zbavit se RNA z období strádání a může opět produkovat nové RNA dle aktuální potřeby.
Je otázkou, zda je to jediná role alarmonových čepiček, protože v takovém případě by si buňka vystačila pouze s jedním typem čepičky. My jsme doposud identifikovali devět nových čepiček a s vysokou pravděpodobností to není číslo konečné. Navíc jsou tyto alarmony známy ve všech organismech, přičemž ve vyšších organismech funguje vše mnohem složitěji.
Nabízí se nám proto řada dalších otázek. Proč existuje tolik alarmonových čepiček? Co je metyluje? Je možné, že je m7Gp4Gm čepička evolučním prekursorem klasické mRNA-čepičky m7Gp3Gm u vyšších organismů? Mají i jiné typy buněk, například lidské, takové typy RNA-čepiček? Pokud ano, jakou roli v těchto složitějších organismech hrají? Můžeme studiem alarmonů a jejich funkce v RNA konečně pochopit základní mechanismy stresu v buňkách a celých organismech?
Na tyto a mnoho dalších otázek se budeme snažit v naší laboratoři nadále nacházet odpovědi.
Známé RNA-čepičky
Čepička m7Gp3Nm na eukaryotické mRNA je důležitá kvůli interakci se skupinou proteinů, které tuto čepičku specificky rozpoznají a umožní transport mRNA z jádra buňky do cytosolu. Tam je mRNA nesoucí čepičku rozpoznávána další skupinou proteinů nazývaných translační iniciační faktory, které napomáhají (iniciují) interakci mRNA s ribozomem. Na ribozomu pak probíhá přepis a tvorba nového proteinu. V neposlední řadě hraje čepička mRNA důležitou roli při ochraně před exonukleázami – enzymy, které mají za úkol degradovat nepotřebnou RNA na výchozí stavební bloky použitelné k syntéze jiných nových RNA. Takto popsaný mechanismus platí pouze v eukaryotických buňkách, obsahujících pravé buněčné jádro. V prokaryotických buňkách, kam patří i Escherichia coli jako nejprostudovanější organismus na planetě, až donedávna RNA-čepičky známy nebyly.
NAD (nikotinamidadenindinukleotid) se vyskytuje ve všech typech živých buněk. Jedná se o kofaktor přenášející elektrony v oxidačně-redukčních reakcích, které jsou součástí nejrůznějších metabolických drah. Nedávno byl NAD prakticky ve všech organismech nalezen i jako součást RNA, v níž hraje roli 5'-RNA-čepičky.
Literatura
[1] McLennan A. G.: Ap4a and Other Dinucleoside Polyphosphates. Taylor & Francis, 1992.
[2] Chen Y. G. et al.: LC/MS analysis of cellular RNA reveals NAD-linked RNA, Nature Chemical Biology 5, 879, 2009, DOI: 10.1038/nchembio.235.
[3] Cahová H. et al.: NAD captureSeq indicates NAD as a bacterial cap for a subset of regulatory RNAs, Nature 519, 374, 2014, DOI: 10.1038/nature14020.
[4] Hudeček O. et al.: Dinucleoside polyphosphates act as 5'-RNA caps in bacteria, Nature Communications 11, 1052, 2020, DOI: 10.1038/s41467-020-14896-8.
Ke stažení
 článek ve formátu pdf [457,52 kB]
článek ve formátu pdf [457,52 kB]