Střevní bakterie a imunitní systém: jezte vlákninu!
| 12. 6. 2014O tom, jak nesmírně důležitá je správná funkce slizničního imunitního systému, jsem zde nedávno psal (Vesmír 93, 164, 2014/3). Zopakujme si, že část imunitního systému asociovaná se slizničními povrchy (hlavně střeva a dýchacího traktu) představuje většinu celého našeho imunitního systému. Je tomu tak proto, že povrch sliznic je neustále vystavován působení spousty neškodných i potenciálně nebezpečných mikroorganismů, ale i pro organismus cizorodých potravních antigenů a mnoha dalších látek z vnějšího prostředí. Slizniční imunitní systém proto musí být na jedné straně schopen účinně se bránit nebezpečným bakteriím, virům a dalším parazitům, ale na druhé straně při této obraně nesmí používat takové zbraně, které by poškozovaly citlivé a životně důležité sliznice.
Pokud je vše v pořádku, používá slizniční imunitní systém jako hlavní ochranné prostředky protilátky typu IgA a vyhýbá se použití zánětlivých reakcí, které jsou na jiných místech organismu sice velmi účinné, ale jejich vedlejší účinky by sliznice poškozovaly. Rozvoji zánětlivých reakcí brání především regulační T-lymfocyty (Treg), které sídlí ve vrstvě tkáně zvané lamina propria těsně pod slizničním povrchem a tlumí aktivity svých příbuzných „prozánětlivých“ buněk zvaných Th1 a Th17. Pokud Treg nefungují tak, jak mají, může dojít ke vzniku závažných střevních autoimunitních chorob, jako je Crohnova nemoc či ulcerativní kolitida. Defekty funkce těchto buněk mohou také přispívat ke vzniku některých potravních alergií provázených úpornými průjmy.
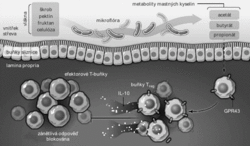 Otázkou ovšem je, co způsobuje, že ve slizniční části zdravého imunitního systému dominují protizánětlivé buňky Treg. Několik nedávných článků v prestižních časopisech [1–6] ukazuje na myších modelech, že v regulaci části imunitního systému spojené se sliznicí tlustého střeva hrají zásadní roli metabolické produkty střevních bakterií – krátké mastné kyseliny (hlavně kyselina propionová, ale také octová a máselná, resp. za fyziologického pH jejich disociované formy propionát, acetát a butyrát), které vznikají zpracováním polysacharidových složek potravy, tedy vlákniny.
Otázkou ovšem je, co způsobuje, že ve slizniční části zdravého imunitního systému dominují protizánětlivé buňky Treg. Několik nedávných článků v prestižních časopisech [1–6] ukazuje na myších modelech, že v regulaci části imunitního systému spojené se sliznicí tlustého střeva hrají zásadní roli metabolické produkty střevních bakterií – krátké mastné kyseliny (hlavně kyselina propionová, ale také octová a máselná, resp. za fyziologického pH jejich disociované formy propionát, acetát a butyrát), které vznikají zpracováním polysacharidových složek potravy, tedy vlákniny.
Koncentrace těchto látek byla velmi nízká ve střevech bezmikrobních myší nebo myší chovaných v polosterilních podmínkách. Přidání těchto jednoduchých sloučenin do potravy vedlo ke zvýšení počtu funkčních buněk Treg a také příznivě ovlivňovalo průběh modelového střevního autoimunitního zánětu (kolitidy). Mechanismus působení těchto molekul je částečně založen na tom, že se váží na receptor zvaný GPR43 (přítomný ve velkém množství na povrchu střevních Treg), resp. možná spíše na jemu podobný receptor GPR109a.
Signály zprostředkované těmito receptory vyvolají potlačení exprese jaderného enzymu histon deacetylázy. Ten se účastní regulace genové exprese – modifikuje acetylované bazické jaderné proteiny histony, což vede ke změnám exprese několika genů kódujících proteiny zodpovědné za tlumivé působení buněk Treg (např. transkripční faktor FoxP3 a cytokin IL-10) a k pomnožení těchto buněk. Krátké mastné kyseliny stejně působí i na střevní makrofágy, které pak (na rozdíl od makrofágů v jiných tkáních) nespouštějí po rozpoznání bakterií zánětlivé reakce, ale produkují protizánětlivé cytokiny. Kromě přímého účinku na buňky Treg a makrofágy mají ale krátké mastné kyseliny také důležitý nepřímý efekt – ve střevních epiteliálních buňkách vyvolávají tvorbu cytokinu TGF-beta, který podporuje množení a aktivaci Treg.
V nevábném obsahu střeva se nacházejí v obrovském počtu (cca 100 miliard na gram) stovky druhů bakterií. Nynější studie identifikovaly myší a lidské střevní bakterie zodpovědné za tvorbu oněch biologicky aktivních krátkých mastných kyselin. Ukázalo se, že jsou to především některé kmeny klostridií, resp. jejich specifické směsné kombinace. Osídlení střeva bezmikrobních myší takovými vhodnými kombinacemi několika druhů klostridií (a to i těch pocházejících z lidského střevního obsahu) vedlo k podstatnému snížení náchylnosti těchto zvířat k autoimunitním střevním zánětům. V souladu s těmito výsledky je i zjištění, že řada z oněch prospěšných kmenů klostridií je zastoupena abnormálně málo ve střevním obsahu pacientů trpících některými střevními záněty.
Tyto výsledky samozřejmě vedou k úvaze, že by některým pacientům trpícím střevními záněty mohla pomoci léčba založená na přenosu střevního obsahu ze zdravých jedinců. Takový postup, zvaný „fekální transplantace“ (fecal microbiota transplantation, FMT), se už skutečně několik let na empirickém základě s nadějnými výsledky experimentálně testuje. Současné výsledky dávají takovým postupům solidní mechanistické opodstatnění, a lze tedy očekávat, že se jejich použití bude rozšiřovat. Nebezpečím ovšem je, že použití nevhodných směsí bakterií může být nejen neúčinné, ale i přímo škodlivé – je totiž dobře známo, že některé druhy klostridií blízce příbuzné těm „hodným“ produkují nebezpečné toxiny.
Je prakticky jisté, že nynější objevy jsou jen pověstnou špičkou ledovce; mezi tisíci či spíše miliony různých metabolických produktů v našich útrobách je určitě mnoho dalších biologicky aktivních látek, které ovlivňují (pozitivně i negativně) nejen imunitní systém, ale i mnoho jiných dějů v našem těle. Jejich postupná identifikace může významně ovlivnit daleko racionálnější doporučení ke zdravé výživě, než jsou ta dosavadní.
V každém případě ovšem již dnes neprohloupíme, když budeme jíst stravu bohatou na vlákninu – o to ostatní se již postarají naši střevní bakteriální podnájemníci.
Literatura
[1] Smith et al.: Science 341, 569–573, 2013/6145.
[2] Atarashi et al.: Nature 500, 232–236, 2013/7461.
[3] Furusawa et al.: Nature 504, 446–450, 2013/7480.
[4] Arpaia et al.: Nature 504, 451–455, 2013/7480.
[5] Singh et al.: Immunity 40, 128–139, 2014.
[6] Chang et al.: Proc. Natl. Acad. Sci. USA 111, 2247–2252, 2014.
Ke stažení
 článek ve formátu pdf [302,84 kB]
článek ve formátu pdf [302,84 kB]
O autorovi
Václav Hořejší


























