Válku s nádorem mohou rozhodnout kolaboranti
| 13. 3. 2014Každým rokem je v České republice diagnostikováno přibližně 70 000 nových onkologických pacientů. Náhled na vznik, vývoj a léčbu nádorů se v průběhu času postupně mění vlivem intenzivního výzkumu a odhalování nových molekulárně-biologických mechanismů podílejících se na vzniku a rozvoji nádorů.
Nádory již nejsou charakterizovány pouze jako masa nekontrolovatelně se dělících buněk, ale jsou známy rovněž četné genetické a epigenetické změny,1) které za jejich vznikem stojí.
Role nádorových supresorů (genů, jejichž produkty dokážou držet na uzdě vznik a progresi nádorů) a onkogenů, jejichž aktivace může vznik nádorového onemocnění zapříčinit, byla diskutována v mnoha vědeckých publikacích. Kromě obecných postupů při léčbě nádorů, jako jsou chirurgické zásahy, radioterapie či chemoterapie, je postupně zaváděna specifická terapie pro jednotlivé subtypy léčených nádorů. Největší překážkou efektivnější léčby však stále zůstává schopnost nádorových buněk vytvářet si rezistenci k cytotoxické i cytostatické terapii. Pacienti zpočátku na léčbu reagují příznivě, dochází k ústupu onemocnění, který je však často následován opětovným růstem nádoru, a ten již na léčbu neodpovídá. Získaná rezistence je pak příčinou selhání léčby až u 90 % pacientů s metastatickou formou nádorů. Pochopení mechanismů, které zapříčiňují rezistenci, je tedy velmi důležitým krokem k dalšímu vývoji léčby.
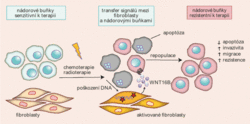 U nádorů skládajících se z geneticky různorodé populace buněk byl pozorován častý návrat onemocnění v relativně krátkém čase po ukončení léčby. Na vině je přežití takových nádorových buněk, které postupně nasbíraly genetické a epigenetické nastavení vedoucí k rezistenci, a jejich následné pomnožení. Protinádorová terapie je většinou zaměřena na nekontrolovaně se dělící buňky, jejichž proliferace převyšuje proliferaci nenádorových tkání. Principem účinku je vyvolat poškození DNA rychle se dělících buněk. Poškození DNA obvykle spouští mechanismy udržující integritu genomu a ideálním výsledkem je pak zástava buněčného cyklu popřípadě buněčná smrt svévolně se dělících buněk.
U nádorů skládajících se z geneticky různorodé populace buněk byl pozorován častý návrat onemocnění v relativně krátkém čase po ukončení léčby. Na vině je přežití takových nádorových buněk, které postupně nasbíraly genetické a epigenetické nastavení vedoucí k rezistenci, a jejich následné pomnožení. Protinádorová terapie je většinou zaměřena na nekontrolovaně se dělící buňky, jejichž proliferace převyšuje proliferaci nenádorových tkání. Principem účinku je vyvolat poškození DNA rychle se dělících buněk. Poškození DNA obvykle spouští mechanismy udržující integritu genomu a ideálním výsledkem je pak zástava buněčného cyklu popřípadě buněčná smrt svévolně se dělících buněk.
Nyní vidíte 16 % článku. Co dál:
O autorovi
Martina Raudenská
















