Rafty nejen na divoké vodě
Kdybychom si typickou buňku zvětšili do velikosti melounu, byla by na povrchu pokrytá polopropustnou blánou silnou jako papír – cytoplasmatickou membránou, složenou ze stovek typů lipidů a proteinů. Je to selektivní bariéra vybavená specifickými transportními a signalizačními mechanismy, která umožňuje přesné řízení výměny látek a informací mezi vnitřním prostředím buněk a jejich okolím. Důležitá je však také pro další buněčné funkce, jako je například migrace nebo adheze k mezibuněčné hmotě či jiným buňkám. Podobné membrány obklopují i vnitrobuněčné organely. V buněčných membránách jsou lipidy uspořádány do dvojvrstvy o tloušťce zhruba 7–9 nanometrů, v které jsou hydrofobní části lipidových molekul (zbytků mastných kyselin) orientovány k sobě navzájem a tvoří vnitřní část membrány, zatímco hydrofilní „hlavičky“ jsou v kontaktu s okolím. Vzniká tak plošný útvar, v jehož každé vrstvě se lipidy mohou více či méně volně pohybovat, avšak samovolně z jedné vrstvy do druhé přecházejí jen obtížně. To je důležité pro udržování asymetrie cytoplazmatické membrány. Složení jejího vnějšího a vnitřního listu se totiž významně liší. Vnější list cytoplazmatické membrány savčích buněk je poměrně bohatý na glykolipidy, sfingomyelin a fosfatidylcholin, které se ve vnitřním listu membrány vyskytují jen v malém množství. Pro cytoplazmatickou část membrány je naopak typický fosfatidylethanolamin a záporně nabitý fosfatidylserin. Asymetrie membrány je aktivně vytvářena a udržována specifickými proteinovými přenašeči.
Membránové proteiny
Kromě lipidů jsou druhou hlavní složkou buněčných membrán proteiny. V cytoplazmatické membráně plní spoustu nepostradatelných funkcí. Tvoří například selektivní membránové kanály a přenašeče důležité pro aktivní či pasivní přenos specifických molekul a iontů, zprostředkují mezibuněčnou adhezi a velice důležitou roli hrají též v přenosu informace přes cytoplazmatickou membránu, tedy v membránové signalizaci.
 Nejčastěji jde o transmembránové proteiny, jejichž molekuly procházející napříč cytoplazmatickou membránou, v níž jsou ukotveny pomocí sekvence asi 20 hydrofobních aminokyselin. O jejich velké důležitosti svědčí to, že až dvacet procent všech genů kóduje právě tento typ proteinů.
Nejčastěji jde o transmembránové proteiny, jejichž molekuly procházející napříč cytoplazmatickou membránou, v níž jsou ukotveny pomocí sekvence asi 20 hydrofobních aminokyselin. O jejich velké důležitosti svědčí to, že až dvacet procent všech genů kóduje právě tento typ proteinů.
Některé membránové proteiny však transmembránovou oblast nemají a s vnitřním nebo vnějším listem membrány jsou spojeny jinak – pomocí lipidové „kotvy“. Tuto funkci mohou zastávat např. kovalentně připojené zbytky kyseliny palmitové či myristové. Je zajímavé, že takové chemické modifikace (hlavně palmitylace) jsou nezbytné i pro stabilní spojení některých transmembránových proteinů s plazmatickou membránou. Ve vnějším listu membrány mohou být proteiny ukotveny prostřednictvím složitého glykolipidu glykosylfosfatidylinositolu (GPI) kovalentně připojeného k jejich koncové aminokyselině (Vesmír 74, 625, 1995/11).
Membránové mikrodomény – rafty
Struktura cytoplazmatické membrány jako polotekuté lipidové dvojvrstvy byla poprvé navržena S. J. Singerem s G. L. Nicholsonem před 40 lety. Podle jejich modelu „tekuté mozaiky” se lipidy a proteiny mohou v ploše membrány volně pohybovat – membrána je jakousi dvourozměrnou kapalinou. Později se však stále více ukazovalo, že takovýto pohled na cytoplazmatickou membránu (i ostatní buněčné membrány) je příliš zjednodušený a že ve skutečnosti membrána obsahuje oblasti (mikrodomény), které se svým složením a vlastnostmi navzájem výrazně liší. Mikrodomény se mohou spontánně tvořit jako dynamické útvary v důsledku vzájemných interakcí mezi membránovými lipidy a proteiny. Jejich existence a vlastnosti závisí na lipidovém i proteinovém složení dané membrány, na teplotě a na interakcích s dalšími molekulami vně i uvnitř buňky.
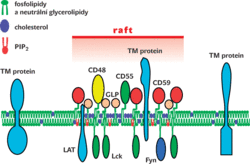
Dosud nejvíce byly studovány mikrodomény zvané „lipidové rafty“, které obsahují především lipidy a glykolipidy s dlouhými nasycenými mastnými kyselinami (např. kyselina palmitová) a cholesterol (obr. 1). Z experimentů s umělými modelovými membránami definovaného složení je známo, že některé lipidy a jejich směsi mají tendenci ke spontánní tvorbě tzv. „uspořádané kapalné fáze“. V ní jsou mastné kyseliny paralelně poskládány a uspořádány těsněji než v ostatních částech membrány. Některé vlastnosti těchto modelových lipidových mikrodomén jsou velmi podobné lipidovým raftům biologických membrán a zdá se, že i u nich je spontánní tvorba uspořádané kapalné fáze hlavním faktorem jejich vzniku. Lipidové rafty (na rozdíl od plně tekutých částí membrány) díky svému složení vzdorují rozpuštění pomocí některých neiontových detergentů. Lze je proto z buněčných lyzátů připravených pomocí takovýchto detergentů jednoduše izolovat centrifugačními nebo jinými jednoduchými fyzikálními metodami – jsou totiž poměrně velké a mají malou specifickou hustotu.1)
Raftové mikrodomény se formují během biosyntézy v Golgiho komplexu, odkud jsou pak dopravovány na plazmatickou membránu. Připisuje se jim řada důležitých funkcí v buněčné signalizaci (obr. 2). Uplatňují se však i při třídění proteinů a lipidů pro transport do různých oblastí plazmatické membrány (u plochých epiteliálních buněk je jejich „horní“ strana tvořena převážně rafty, zatímco „dolní“ strana rafty a pro ně typické proteiny neobsahuje). Raftové mikrodomény hrají důležité role také v procesech endocytózy a exocytózy. Často jsou též využívány různými patogeny (např. virem HIV) jako vstupní brány pro průnik do buňky či naopak k opuštění buňky.
Raftové kontroverze
O tom, jak raftové mikrodomény v buněčných membránách skutečně vypadají, se vedou spory. Základní potíž spočívá v tom, že tyto mikrodomény jsou příliš malé pro přímé mikroskopické pozorování. Byly proto zpočátku charakterizovány pouze biochemicky, jako části membrány nerozpustné v roztocích některých detergentů.2)
Struktury získané po rozpuštění membrán však nemusí pravdivě odrážet situaci in vivo, neboť působení detergentů v kombinaci s nízkou teplotou může zásadně pozměnit to, co v membráně existovalo za fyziologických podmínek (např. spojit mnoho miniaturních mikrodomén do větších celků, přidat či selektivně ubrat některé proteinové molekuly). Je proto důležité, že membránové mikrodomény byly prokázány pomocí biofyzikálních technik také na povrchu živých buněk a v některých případech je lze biochemicky izolovat i bez použití detergentů. Podařilo se najít velmi šetrné detergenty, v jejichž přítomnosti se zachovávají raftové mikrodomény i při rozpuštění za fyziologické teploty.
 Značné výhrady provázely pokusy o mikroskopickou detekci lipidových raftů. Zpočátku se k mikroskopické vizualizaci raftových mikrodomén používaly fluorescenčně označené protilátky rozpoznávající typické raftové proteiny – rafty se jevily jako malé dobře pozorovatelné „tečky“, popřípadě postupně splývající do větších skvrn. Ukázalo se ale, že tyto „tečky“ jsou artefakty vzniklé shluknutím molekul působením vícevazných protilátek. Tento problém částečně vyřešila nová fluorescenční barviva, která se po přidání k buňkám víceméně selektivně zabudovávají do raftových mikrodomén (charakterizovaných vyšší uspořádaností jejich lipidů a vyšším obsahem cholesterolu), zatímco jiná taková barviva mají naopak vyšší afinitu k neraftovým částem membrán.
Značné výhrady provázely pokusy o mikroskopickou detekci lipidových raftů. Zpočátku se k mikroskopické vizualizaci raftových mikrodomén používaly fluorescenčně označené protilátky rozpoznávající typické raftové proteiny – rafty se jevily jako malé dobře pozorovatelné „tečky“, popřípadě postupně splývající do větších skvrn. Ukázalo se ale, že tyto „tečky“ jsou artefakty vzniklé shluknutím molekul působením vícevazných protilátek. Tento problém částečně vyřešila nová fluorescenční barviva, která se po přidání k buňkám víceméně selektivně zabudovávají do raftových mikrodomén (charakterizovaných vyšší uspořádaností jejich lipidů a vyšším obsahem cholesterolu), zatímco jiná taková barviva mají naopak vyšší afinitu k neraftovým částem membrán.
Díky studiím využívajícím těchto barviv a nových biofyzikálních a optických metod převládá nyní názor, že raftové mikrodomény (a jim podobné ostatní typy mikrodomén) jsou za fyziologických podmínek většinou velmi malé (15–50 nm), velmi dynamické (rychle vznikají a rozpadají se) a mohou se snadno spojovat a stabilizovat do větších celků při přenosu signálu pomocí některých receptorů, interakcemi se složkami cytoskeletu, změnou teploty, navázáním protilátek apod. Nativní „elementární rafty“ tedy zřejmě obsahují jen několik desítek až stovek lipidových molekul a pouze jednu či několik málo proteinových molekul.
Biologický a praktický význam membránových mikrodomén
Existence membránových mikrodomén spolu s možnostmi jejich dynamického spojování jak mezi sebou, tak s ostatními složkami membrány poskytuje význačné možnosti pro regulaci buněčných dějů. Může to být jednoduchý a účinný mechanismus jak podpořit specifické interakce mezi určitými proteiny, nebo naopak potlačit interakce nežádoucí. Další eventualitou je vznik větších organizovaných mikrodomén, např. kolem aktivovaného receptoru. Protein pobývající za normálních okolností v méně organizované části membrány se může přemístit do raftové mikrodomény prostřednictvím interakce s jiným proteinem, residentem mikrodomén, nebo zvýšením afinity k uspořádanější fázi membrány (např. shluknutím receptorů, připojením kyseliny palmitové nebo konformační změnou).
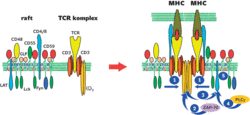
Již první experimenty, které vedly k objevu raftových mikrodomén, se zabývaly jejich schopností přenášet signál. Na počátku byl poněkud záhadný jev – vazba protilátek na proteiny ukotvené v plazmatické membráně pomocí glykolipidové struktury (GPI-proteiny) či na některé glykolipidy vedla např. v buňkách imunitního systému k silné aktivační odpovědi srovnatelné s přirozenou odpovědí vyvolanou stimulací imunoreceptorů. Přitom GPI-proteiny a glykolipidy jsou ukotvené jen ve vnějším listu membrány a nijak nezasahují do cytosolu. Zdánlivě tak nemají možnost ovlivňovat intracelulární proteiny přenášející signály nezbytné pro takovouto odpověď. Tento fenomén se podařilo vysvětlit právě existencí lipidových mikrodomén obohacených jak o GPI-proteiny a glykolipidy, tak o kritické vnitrobuněčné signalizační proteiny (některé proteinkinázy – enzymy fosforylující jiné proteiny a zahajující signalizační děje). Prokřížením a následným shluknutím celých mikrodomén pomocí protilátek dojde k nahloučení těchto enzymů a jejich proteinových substrátů na cytosolické straně membrány, což zahajuje kaskády navazujících signalizačních dějů, které kulminují např. buněčným dělením nebo sekrecí proteinů regulujících imunitní odpovědi.
Biologický význam raftových (a dalších jim podobných) mikrodomén (receptorová signalizace, organizace komplexů adhezivních molekul, vytváření optimálního prostředí pro funkci některých enzymů, brány vstupu patogenů) byl prokázán v mnoha typech buněk (imunitní systém, neurony, výstelka cév, slizniční buňky, mnoho typů nádorových buněk). Raftové mikrodomény mohou být tedy nadějným „místem zásahu“ v případech, kdy je potřeba např. potlačit nežádoucí aktivity v nich sídlících receptorových molekul. Zdá se, že účinky některých imunosupresivních látek lze alespoň zčásti vysvětlit tím, že narušují integritu raftů. Existují i první příklady potenciálních terapeutických inhibitorů specificky cílených do raftových mikrodomén, které účinně potlačují nežádoucí aktivitu enzymů zodpovědných za vznik neurodegenerativních chorob. Také fakt, že mnohé patogeny využívají raftové mikrodomény, má potenciální praktické důsledky.
Problematika membránových mikrodomén má tedy všechny aspekty důležitého biomedicínského výzkumu – kromě zajímavého biologického a biochemického problému základního výzkumu se rýsují i praktické aplikace. Není tedy divu, že v odborné literatuře existuje již několik tisíc publikací z tohoto oboru a že každý týden přibývá řada dalších.
Poznámky
1) Raftové mikrodomény postrádají většinu membránových proteinů, avšak jsou v nich koncentrovány výše zmíněné proteiny zakotvené pomocí glykolipidu GPI, acylované (palmitylované a myristylované) intracelulární proteiny tyrosinkinasy rodiny Src, některé G-proteiny (velmi důležité vnitrobuněčné signalizační proteiny vážící buď guanosintrifosfát (GTP), nebo guanosindifosfát (GDP) zakotvené opět pomocí kovalentně připojených lipidových „ocásků“), některé tzv. transmembránové adaptorové proteiny, kolem kterých se organizují komplexy signalizačních proteinů, ale také např. hlavní povrchový glykoprotein (hemaglutinin) chřipkového viru.
2) Používal se např. Triton X-100 nebo NP-40 při teplotě blízké 0 °C. Poté byly rafty izolovány zpravidla jednoduchou ultracentrifugací v hustotním gradientu. Další velmi hojně používanou biochemickou metodou sloužící jako test závislosti určitého děje na lipidových mikrodoménách bývá extrakce membránového cholesterolu pomocí methyl-b-cyklodextrinu. Tato metoda byla ovšem kritizována proto, že cholesterol je přítomen (i když v menším množství) i v neraftových částech membrán a jeho odstraňování může mít tedy vliv i na mnoho jiných membránových funkcí.
RAFTŮM PODOBNÉ MIKRODOMÉNY
Z mnoha publikací posledních let je zřejmé, že existuje i několik dalších typů raftům podobných mikrodomén. Všechny mají některé rysy společné s „klasickými“ rafty (charakteristické lipidové složení a relativní rezistence k rozpuštění detergenty), avšak jinými vlastnostmi se od nich odlišují. Významným typem jsou tzv. tetraspanové mikrodomény, jejichž základní složkou je rodina proteinů procházejících „hadovitě“ čtyřikrát membránou a sloužících jako jakési „molekulární lepidlo“ stabilizující povrchové komplexy adhezivních proteinů, které regulují mobilitu buněk a jejich interakce s jinými buňkami. Kromě toho tetraspanové mikrodomény regulují aktivitu a transport některých proteinů uplatňujících se v buněčné signalizaci a dalších klíčových procesech. Tyto útvary mají i zásadní význam pro metastatické chování některých nádorových buněk a slouží jako vstupní brány pro některé viry a mikroorganismy. Nedávno byl v naší laboratoři objeven další typ raftům podobných mikrodomén, které jsme nazvali „těžké rafty“. Jejich biologické role jsou zatím v podstatě neznámé, ale dá se předpokládat, že vzhledem k přítomnosti řady důležitých buněčných receptorů a signalizačních proteinů budou významné.
S lipidovými mikrodoménami jsou příbuzné tzv. kaveoly, 50–100 nm velké prohlubeniny plazmatické membrány dobře pozorovatelné v elektronovém mikroskopu. Tyto útvary stabilizuje protein kaveolin, který je zakotven ve vnitřním listu membrány bohatém na cholesterol a tvoří jakýsi plášť kaveol. Kaveoly mají podobné lipidové a proteinové složení jako lipidové rafty, které lze považovat za jakési ploché a relativně nestabilní kaveoly. Kaveoly se účastní transcytózy, tj. přenosu membránových váčků z jedné strany epiteliálních buněk na druhou, a potocytóz – internalizace důležitých molekul po jejich navázání na receptory v kaveolách.
HISTORICKÁ POZNÁMKA
Vzhledem k tomu, že článek je součástí série věnované 50. výročí založení Ústavu molekulární genetiky, mělo by se něco říci i o historii problematiky v tomto ústavu. Skupina vedená nejprve Ivanem Hilgertem a posléze mnou se danou tematikou začala zabývat v druhé polovině osmdesátých let. Byla to doba, kdy byly teprve objevovány povrchové molekuly buněk imunitního systému. Jako jeden ze základních nástrojů přitom sloužily tzv. monoklonální protilátky, jejichž přípravu tzv. hybridomovou technologií jsme tenkrát zvládli. Několik z námi objevených povrchových proteinů totiž patřilo mezi ony „nekonvenční“ membránové GPI-proteiny asociované s membránou pomocí glykolipidové „kotvy“. Byli jsme mezi prvními na světě, kterým se podařilo ukázat, že jsou součástí membránových útvarů později nazvaných rafty a že tyto útvary obsahují důležité signalizační molekuly. Podobnou problematikou se v ÚMG velmi úspěšně zabývala také skupina Petra Drábera. Později tyto dvě výzkumné skupiny v raftových mikrodoménách objevily několik nových a funkčně důležitých signalizačních proteinů (hlavně adaptorových proteinů částečně podobných proteinu LAT diskutovaném v tomto článku). Výsledky publikované v prestižních mezinárodních časopisech měly značný odborný ohlas – např. naše práce vzniklá ve spolupráci s vídeňskou skupinou Hannese Stockingera (Štefanová a spol., Science, 1991) byla citována téměř 800krát, což z ní činí skutečně „citační klasiku“.
Ke stažení
 článek ve formátu pdf [596,56 kB]
článek ve formátu pdf [596,56 kB]

























