Poněkud neobvyklé membránové proteiny
| 8. 11. 1995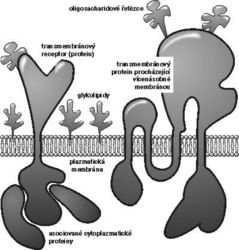 Povrch eukaryotických buněk je tvořen plazmatickou membránou – strukturou složenou z dvojné vrstvy lipidů, v níž jsou zanořeny molekuly proteinů a glykolipidů (obrázek). Plazmatická membrána je výrazně asymetrická, pouze na její vnější straně se nacházejí sacharidové části glykolipidů a glykosylované části proteinových molekul. Podle dnes všeobecně přijímaného názoru tvoří lipidy polotekuté prostředí, v němž plavou membránové proteiny. Volný pohyb proteinových molekul v membráně je však více nebo méně omezován tím, že jejich vnitrobuněčné (intracelulární) části mohou integrovat s různými proteiny uvnitř buňky, např. se složkami cytoskeletu. Membránové proteiny obstarávají takřka veškerou komunikaci buňky s vnějším prostředím. Některé z nich transportují dovnitř nebo ven z buňky ionty, různé živiny a produkty metabolizmu, jiné slouží jako receptory různých hormonů. Hlavní buňky imunitního systému (lymfocyty) mají zásadně důležité receptory rozeznávající cizorodé látky (antigeny), mnoho povrchových molekul má adhezivní funkce – vážou se na jiné molekuly na povrchu sousedních buněk nebo na složky tzv. mezibuněčné hmoty. Většina membránových proteinů se skládá ze tří částí: extracelulární, transmembránové a intracelulární. Pomocí extracelulární části, která je velmi často bohatě glykosylovaná, rozeznávají receptory specifické „ligandy“, tj. např. hormony, antigeny nebo adhezivní partnery. Transmembránová část je tvořena přibližně dvaceti hydrofobními aminokyselinami, které vytvářejí krátký úsek šroubovice procházející lipidovou membránou. V některých případech prochází protein membránou několikrát z jedné strany na druhou a obsahuje několik hydrofobních transmembránových úseků. Intracelulární část je zodpovědná za asociace se specifickými cytoplazmatickými proteiny a za přenos signálu vyvolávaného navázáním ligandu na extracelulární části receptoru. V některých případech má intracelulární část receptoru enzymovou, a to nejčastěji fosforylační (proteinkinázovou) aktivitu. 1) V mnoha jiných případech sice intracelulární část receptoru takovou enzymovou aktivitu nemá, ale je nekovalentně asociována s některou cytoplazmatickou kinázou. Předpokládá se, že signalizace je spuštěna tím, že navázáním ligandu na receptor se pozmění tvar molekuly receptoru i v jeho intracelulární části, která pak výrazně zvýší svoji vlastní kinázovou aktivitu nebo aktivitu kinázy asociované. Aktivovaná kináza pak fosforyluje další proteiny (a často také sebe sama), z nichž některé jsou další enzymy (kinázy, fosfatázy, fosfolipázy). Tato kaskáda nakonec vede ke konečnému výsledku, který se může výrazně lišit podle typu buňky a podle okolností, za kterých byl signál přijat: buňka se např. může začít dělit, vylučovat určité látky, adherovat se k jiným buňkám, nebo naopak může zastavit růst, nebo dokonce „spáchat sebevraždu“ (o apoptóze viz Vesmír 73, 552, 1994/10). Zdá se, že nejčastější „konformační změnou“, kterou navázání ligandu způsobí, je agregace dvou nebo i více receptorových molekul v membráně. Tím se dostanou do těsné blízkosti také intracelulární části receptorů, začnou se vzájemně fosforylovat a tak aktivovat s nimi spojené kinázy, čímž je zahájena signalizační kaskáda (viz obrázek). Přenos signálu povrchovými receptory lze experimentálně snadno navodit použitím protilátek rozeznávajících příslušný receptor. Protilátkové molekuly mají dvě (IgG) nebo až deset (IgM) vazebných míst a mohou tudíž v membráně účinně „prokřížit“ a agregovat rozeznávané povrchové molekuly. Ještě důkladnější agregace lze docílit následným použitím dvou protilátek (např. myší protilátka proti určitému povrchovému receptoru následovaná králičí protilátkou proti myšímu imunoglobulinu). Tímto způsobem se běžně testují potenciální receptorové a signalizační vlastnosti povrchových proteinů, u nichž jsou funkce a přirozené ligandy dosud neznámé. Způsobí-li jejich agregace protilátkami přenos signálu, lze pak ze způsobu odpovědi usuzovat na možnou přirozenou funkci a začít hledat případný přirozený ligand.
Povrch eukaryotických buněk je tvořen plazmatickou membránou – strukturou složenou z dvojné vrstvy lipidů, v níž jsou zanořeny molekuly proteinů a glykolipidů (obrázek). Plazmatická membrána je výrazně asymetrická, pouze na její vnější straně se nacházejí sacharidové části glykolipidů a glykosylované části proteinových molekul. Podle dnes všeobecně přijímaného názoru tvoří lipidy polotekuté prostředí, v němž plavou membránové proteiny. Volný pohyb proteinových molekul v membráně je však více nebo méně omezován tím, že jejich vnitrobuněčné (intracelulární) části mohou integrovat s různými proteiny uvnitř buňky, např. se složkami cytoskeletu. Membránové proteiny obstarávají takřka veškerou komunikaci buňky s vnějším prostředím. Některé z nich transportují dovnitř nebo ven z buňky ionty, různé živiny a produkty metabolizmu, jiné slouží jako receptory různých hormonů. Hlavní buňky imunitního systému (lymfocyty) mají zásadně důležité receptory rozeznávající cizorodé látky (antigeny), mnoho povrchových molekul má adhezivní funkce – vážou se na jiné molekuly na povrchu sousedních buněk nebo na složky tzv. mezibuněčné hmoty. Většina membránových proteinů se skládá ze tří částí: extracelulární, transmembránové a intracelulární. Pomocí extracelulární části, která je velmi často bohatě glykosylovaná, rozeznávají receptory specifické „ligandy“, tj. např. hormony, antigeny nebo adhezivní partnery. Transmembránová část je tvořena přibližně dvaceti hydrofobními aminokyselinami, které vytvářejí krátký úsek šroubovice procházející lipidovou membránou. V některých případech prochází protein membránou několikrát z jedné strany na druhou a obsahuje několik hydrofobních transmembránových úseků. Intracelulární část je zodpovědná za asociace se specifickými cytoplazmatickými proteiny a za přenos signálu vyvolávaného navázáním ligandu na extracelulární části receptoru. V některých případech má intracelulární část receptoru enzymovou, a to nejčastěji fosforylační (proteinkinázovou) aktivitu. 1) V mnoha jiných případech sice intracelulární část receptoru takovou enzymovou aktivitu nemá, ale je nekovalentně asociována s některou cytoplazmatickou kinázou. Předpokládá se, že signalizace je spuštěna tím, že navázáním ligandu na receptor se pozmění tvar molekuly receptoru i v jeho intracelulární části, která pak výrazně zvýší svoji vlastní kinázovou aktivitu nebo aktivitu kinázy asociované. Aktivovaná kináza pak fosforyluje další proteiny (a často také sebe sama), z nichž některé jsou další enzymy (kinázy, fosfatázy, fosfolipázy). Tato kaskáda nakonec vede ke konečnému výsledku, který se může výrazně lišit podle typu buňky a podle okolností, za kterých byl signál přijat: buňka se např. může začít dělit, vylučovat určité látky, adherovat se k jiným buňkám, nebo naopak může zastavit růst, nebo dokonce „spáchat sebevraždu“ (o apoptóze viz Vesmír 73, 552, 1994/10). Zdá se, že nejčastější „konformační změnou“, kterou navázání ligandu způsobí, je agregace dvou nebo i více receptorových molekul v membráně. Tím se dostanou do těsné blízkosti také intracelulární části receptorů, začnou se vzájemně fosforylovat a tak aktivovat s nimi spojené kinázy, čímž je zahájena signalizační kaskáda (viz obrázek). Přenos signálu povrchovými receptory lze experimentálně snadno navodit použitím protilátek rozeznávajících příslušný receptor. Protilátkové molekuly mají dvě (IgG) nebo až deset (IgM) vazebných míst a mohou tudíž v membráně účinně „prokřížit“ a agregovat rozeznávané povrchové molekuly. Ještě důkladnější agregace lze docílit následným použitím dvou protilátek (např. myší protilátka proti určitému povrchovému receptoru následovaná králičí protilátkou proti myšímu imunoglobulinu). Tímto způsobem se běžně testují potenciální receptorové a signalizační vlastnosti povrchových proteinů, u nichž jsou funkce a přirozené ligandy dosud neznámé. Způsobí-li jejich agregace protilátkami přenos signálu, lze pak ze způsobu odpovědi usuzovat na možnou přirozenou funkci a začít hledat případný přirozený ligand.
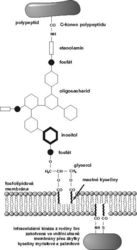
Existuje však zajímavá skupina membránových proteinů, u kterých byla schopnost přenášet signál dovnitř buňky donedávna záhadou. Tyto proteiny, objevené teprve před 15 lety, jsou zachyceny v membráně pomocí glykolipidové „kotvy“ připojené k jejich C-koncové aminokyselině (obrázek). Takový protein se tedy nachází celý na vnějším povrchu buňky a nemá žádnou transmembránovou a intracelulární část, pomocí které by mohl interagovat se známými signalizačními mechanizmy uvnitř buňky. Struktura glykolipidové kotvy je dobře známa – skládá se z etanolaminu, více nebo méně komplikovaného oligosacharidu, cyklického alkoholu inositolu a fosfolipidu (kyseliny fosfatidové). Celá tato struktura se nazývá glykosylfosfatidylinositol (GPI) a proteinům zakotveným tímto způsobem se říká „GPI-proteiny“. Základní struktura GPI-kotvy je, až na variace v oligosacharidové části, v podstatě stejná u prvoků (u kterých je tímto způsobem zakotvena dokonce většina membránových proteinů) jako u savců. GPI-proteiny se z buněčného povrchu dají snadno odštěpit pomocí specifických fosfolipáz (GPI-specifické fosfolipázy C; GPI-PLC). GPI-proteiny jsou tedy jakýmsi strukturním hybridem mezi proteiny a lipidy. Dá se předpokládat, že oproti obvyklým transmembránovým proteinům by se měly snáze pohybovat v lipidové membráně.
 Mezi nejznámější GPI-proteiny savců patří několik adhezivních receptorů bílých krvinek i jiných typů buněk, celá řada hydrolytických povrchových enzymů (ektoenzymů), receptor monocytů (druh bílých krvinek) pro bakteriální lipopolysacharid neboli endotoxin, zvaný CD14, a dvě velmi důležité molekuly, CD55 a CD59 2) , které ochraňují téměř všechny buňky organizmu před poškozením jedním z “nespecifických“ imunitních mechanizmů, tzv. komplementem. Pacienti, kterým na červených krvinkách tyto ochranné molekuly chybí, trpí chudokrevností způsobenou snadným poškozováním červených krvinek.
Mezi nejznámější GPI-proteiny savců patří několik adhezivních receptorů bílých krvinek i jiných typů buněk, celá řada hydrolytických povrchových enzymů (ektoenzymů), receptor monocytů (druh bílých krvinek) pro bakteriální lipopolysacharid neboli endotoxin, zvaný CD14, a dvě velmi důležité molekuly, CD55 a CD59 2) , které ochraňují téměř všechny buňky organizmu před poškozením jedním z “nespecifických“ imunitních mechanizmů, tzv. komplementem. Pacienti, kterým na červených krvinkách tyto ochranné molekuly chybí, trpí chudokrevností způsobenou snadným poškozováním červených krvinek.
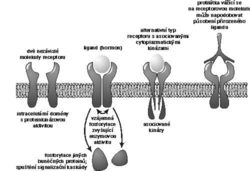
Dva GPI-proteiny, které byly objeveny jako první a u kterých vyvstal problém přenosu signálu nejdříve, byly povrchové antigeny myších T-lymfocytů zvané Thy-1 a Ly-6. Glykoprotein Thy-1 se vyskytuje ve velkém množství také na povrchu neuronů a slouží tam zřejmě jako adhezivní molekula (jeho role na T-lymfocytech není jasná). Funkce několika známých blízce příbuzných molekul ze skupiny Ly-6 také není známa. Nápadnou vlastností Thy-1 a Ly-6 však je, že jejich agregace na povrchu lymfocytů pomocí vhodných protilátek vyvolá aktivaci těchto buněk, která se projevuje podobně jako stimulace T-lymfocytů cizorodým antigenem: nejprve dojde k přechodnému zvýšení koncentrace Ca2+ iontů v cytoplazmě a k fosforylaci celé řady buněčných proteinů, za vhodných podmínek pak buňky vstoupí do buněčného cyklu a začnou se dělit. V nezralých T-lymfocytech (thymocytech) může tato stimulace naopak vést k navození buněčné sebevraždy (apoptózy). V každém případě je zřejmé, že Thy-1 a Ly-6 musí být schopny přenášet signály přes membránu a spouštět intracelulární mechanizmy. Brzy se ukázalo, že schopnost přenášet signály přes membránu je vlastní zřejmě všem GPI-proteinům, a že je to právě glykolipidová kotva těchto molekul, která je při tom nějak podstatně důležitá. Metodami molekulární genetiky byly totiž připraveny varianty GPI-proteinů, které měly místo glykolipidové kotvy „naroubovanou“ konvenční transmembránovou a intracelulární část z nějakého jiného proteinu. Tyto hybridní molekuly kupodivu nebyly po agregaci v membráně protilátkami schopny přenášet signál. Naopak, připojení glykolipidové kotvy na extracelulární část nějakého jiného, nesignalizujícího proteinu, způsobilo, že taková hybridní molekula opět získala signalizační schopnosti. Určitou dobu se zdálo, že signalizační vlastnosti GPI-proteinů lze vysvětlit tím, že po jejich interakci s přirozeným ligandem nebo s protilátkou jsou štěpeny specifickou fosfolipázou za vzniku diacylglycerolu, který je známým aktivátorem proteinkinázy C. Tento enzym je dávno známou součástí signalizačních kaskád spouštěných mnoha receptory. Tato hypotéza však nikdy nebyla experimentálně prokázána.
 Jiným zřejmým vysvětlením bylo, že GPI-proteiny jsou v membráně asociovány s nějakými „opravdovými“, transmembránovými receptory, které mají přímý kontakt s intracelulárními signalizačními enzymy. „Zataháme-li“ tedy pomocí protilátek za nějaký GPI-protein, jako Thy-1 nebo Ly-6, dojde současně k agregaci i oněch hypotetických asociovaných transmembránových proteinů a nastartování signalizace. Bylo by například možné, že takový hypotetický transmembránový receptor by vázal sacharidovou část glykolipidové kotvy. Tím by se dalo vysvětlit, že signalizovat lze zřejmě přes všechny GPI-proteiny.
Jiným zřejmým vysvětlením bylo, že GPI-proteiny jsou v membráně asociovány s nějakými „opravdovými“, transmembránovými receptory, které mají přímý kontakt s intracelulárními signalizačními enzymy. „Zataháme-li“ tedy pomocí protilátek za nějaký GPI-protein, jako Thy-1 nebo Ly-6, dojde současně k agregaci i oněch hypotetických asociovaných transmembránových proteinů a nastartování signalizace. Bylo by například možné, že takový hypotetický transmembránový receptor by vázal sacharidovou část glykolipidové kotvy. Tím by se dalo vysvětlit, že signalizovat lze zřejmě přes všechny GPI-proteiny.
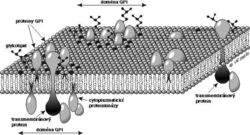
Výsledky získané v několika uplynulých letech v naší laboratoři i na několika dalších pracovištích však nabízejí ještě jiné vysvětlení. V naší laboratoři jsme koncem osmdesátých let připravili jedny z prvních monoklonálních protilátek proti několika GPI-proteinům lidských bílých krvinek – CD14, CD48, CD59 a CD55. Získali jsme také první částečné koncové sekvence CD14 (Bažil a spol., Eur. J. Immunol. 16, 1986, 1583) a CD59 (Štefanová a spol., Mol. Immunol. 26, 1989, 153) a klonovali geny kódující CD59 a CD48 (Kořínek a spol., Immunogenetics 33, 1991, 108). Během prací na biochemické charakterizaci proteinu CD59 si naše mladá kolegyně Irena Štefanová všimla, že v preparátech CD59 je přítomna proteinkinázová aktivita. Brzy se ukázalo, že tuto enzymovou aktivitu je možno za vhodných okolností izolovat i spolu s ostatními GPI-proteiny z nejrůznějších typů buněk; enzym asociovaný s GPI-proteiny T-lymfocytů byl identifikován jako kináza Lck ze skupiny Src, jejíž někteří členové jsou známými regulátory buněčného růstu (Štefanová a spol., Science 253, 1991, 1016). Toto zjištění poprvé ukázalo, jaký je pravděpodobně molekulární základ signalizace přes GPI-proteiny. Zůstávalo však nejasné, jakým způsobem jsou GPI-proteiny asociovány s proteinkinázami skupiny Src. Tyto enzymy jsou totiž strukturně tak trochu zrcadlovým obrazem GPI-proteinů: jsou to cytoplazmatické molekuly, které jsou zakotveny ve vnitřní straně membrány pomocí kovalentně připojených mastných kyselin (viz obrázek). Zpočátku nebylo jasné, jestli se každý GPI-protein zvlášť sdružuje s intracelulární kinázou a co drží tyto dvě molekuly vlastně pohromadě – je to přece jenom nějaký transmembránový protein, nebo hrají hlavní roli nějaké lipidy? Brzy se ukázalo, že několik různých GPI-proteinů je spolu s některými lipidy a glykolipidy a intracelulárními kinázami přítomno společně ve velmi velkých komplexech, ve kterých je jen velmi málo (zpočátku se zdálo, že žádné) transmembránových proteinů (Cinek a spol., J. Imunol. 149, 1992, 2262, Bohuslav a spol., Eur. J. Immunol. 23, 1993, 825). K podobným závěrům dospělo téměř současně s námi několik dalších skupin. Model, který z těchto prací vznikl, lze tedy zjednodušeně formulovat takto (viz obrázek): v povrchové membráně se nacházejí zvláštní „ostrůvky“ (mikrodomény), které se od většiny zbývající plochy membrány liší svým složením – jsou v nich nahromaděny některé lipidy, glykolipidy a GPI-proteiny a naopak je z nich vyloučena většina transmembránových proteinů. Z vnitřní strany jsou k těmto ostrůvkům připojeny některé cytoplazmatické proteiny včetně proteinkináz skupiny Src. Zdá se, že „lepidlem“, které drží tyto útvary pohromadě, jsou právě specifické lipidy a glykolipidy v určitém molárním poměru, které se spolu vážou silněji než ostatní lipidy a vytvářejí v membráně relativně stabilní „domény“. Zvláštní význam pro jejich stabilitu, alespoň v některých buňkách, má asi interakce mezi cholesterolem a kyselými glykolipidy, gangliosidy. Tyto „GPI-domény“ jsou odolnější než většina membrány vůči některým detergentům (syntetickým protředkům používaným pro rozpouštění membrán pro biochemické studie) a to je umožňuje izolovat. Tyto membránové ostrůvky zřejmě obsahují desítky až stovky molekul jednotlivých druhů GPI-proteinů, glykolipidů a ostatních molekul. Mají průměr okolo 100 nm a poměr jejich velikosti k rozměrům celé buňky je tedy asi takový jako velikost ostrovů Sicílie nebo Cejlonu k velikosti zeměkoule. Přenos signálu vyvolaného působením protilátek proti GPI-proteinům (ale i proti glykolipidům přítomným v ostrůvcích) si nyní lze snadno představit: agregací těchto ostrůvků se k sobě přiblíží též asociované kinázy, začnou se vzájemně fosforylovat a tím aktivovat. Aktivované kinázy pak fosforylují další členy kaskády a signalizační děj je spuštěn. Je také možné, že agregace GPI-proteinů uvnitř jedné domény způsobená přidanými protilátkami vyvolá přeskupení a vzájemné přiblížení kinázových molekul ve vnitřní straně této domény.
Tento model se zdá jednoduchý, ale řada otázek v něm zůstává nejasná. Jaký význam mají malá množství některých transmembránových proteinů, které se v “GPI-doménách“ nacházejí? Nejsou přece jen právě ony zásadně důležité pro nepřímé propojení GPI-proteinů a glykolipidů s cytoplazmatickými kinázami? Jak věrně odrážejí výsledky získané biochemickými metodami po rozpuštění membrán detergenty skutečnou situaci na povrchu buňky za fyziologických podmínek? Neztrácíme při solubilizaci některé složky „GPI-domén“? Zásadní otázka ovšem je: nevznikají ony veliké komplexy arteficiálně při rozpouštění membrán kombinovaným působením nízké teploty a detergentu? Zdá se téměř jisté, že tomu tak není: i přímými mikroskopickými technikami lze často pozorovat malé shluky GPI-proteinů na povrchu fixovaných buněk. Je ale velmi pravděpodobné, že za fyziologických podmínek jsou „GPI-domény“ dynamickými útvary, které se rozpadají na poměrně malé shluky molekul a ty se pak opět mohou sdružovat do nových větších domén. Kai Simons z Evropské laboratoře molekulární biologie v Heidelbergu tyto útvary poeticky přirovnává k “vorům“ a “kládám“.
 Další otázka je: Existuje na určitém typu buněk pouze jeden typ relativně homogenních „GPI-domén“? Zdá se, že asi nikoli, a že alespoň v některých typech buněk existuje více druhů těchto membránových útvarů lišících se složením.
Další otázka je: Existuje na určitém typu buněk pouze jeden typ relativně homogenních „GPI-domén“? Zdá se, že asi nikoli, a že alespoň v některých typech buněk existuje více druhů těchto membránových útvarů lišících se složením.
Jakým způsobem vznikají „GPI-domény“? Existují dosti pádné důkazy, že vznikají biosynteticky – do některých měchýřků Golgiho aparátu jsou zřejmě tříděny právě složky budoucích „GPI-domén“, je dokončována jejich glykosylace a posléze jsou tyto měchýřky transportovány k povrchu buňky, fúzují s membránou a alespoň po omezenou dobu se nerozplývají a zůstávají zvláštními „ostrůvky“, které drží pohromadě hlavně hydrofobní vazby mezi jejich specifickými lipidovými složkami.
Biologický význam „GPI-domén“ by mohl spočívat v tom, že umožňují úsporným způsobem přenos signálu prostřednictvím různých receptorů zakotvených přes GPI i prostřednictvím glykolipidů. Celá řada těchto molekul totiž v rámci jednoho ostrůvku sdílí společné intracelulární signalizační zařízení.
Objev „GPI-domén“ navozuje obecnější otázku – neskládá se snad plazmatická membrána z mnoha typů obdobných mikrodomén, z nichž každá sdružuje několik povrchových receptorů, které sdílejí společné signalizační mechanizmy a jejichž blízkost umožňuje vzájemnou funkční spolupráci? Takový obraz plazmatické membrány je určitě poněkud odlišný od dnes běžně přijímaného modelu tekuté lipidové membrány, v níž víceméně nezávisle plavou jednotlivé membránové proteiny. Naše současné výsledky ukazují, že v povrchových membránách bílých krvinek skutečně existuje několik dalších typů membránových domén, které lze izolovat po rozpuštění membrán v roztocích velmi mírných detergentů. Jsme přesvědčeni, že důkladné poznání strukturních principů výstavby povrchových membrán je důležité pro lepší pochopení funkce různých druhů receptorů na buňkách imunitního systému, ale i na jiných druzích buněk. ¨
Poznámky
Smysl základního výzkumu
Je druh základního výzkumu naznačený v tomto článku opravdu důležitý? Není to jen trochu samoúčelné hraní, které sice uspokojuje naši zvídavost a naši ctižádost, ale má jen zanedbatelný praktický význam? Neměli bychom se raději věnovat výzkumu příčin nebo léčby nějakého konkrétního onemocnění? Tento druh pochybností je samozřejmě obecnější a vede k otázce po smyslu základního výzkumu vůbec. A zde je odpověď asi docela jasná: tento typ výzkumu je nejen přijatelný, ale dokonce zcela nezbytný. Teprve na něm lze stavět solidní základy orientovaného a aplikovaného výzkumu. Je přece docela rozumné předpokládat, že důkladné poznání struktury povrchu bílých krvinek a způsobů přenosu signálů přes membránu se v budoucnu třeba i zcela nečekaným způsobem prakticky zhodnotí. Podobných příkladů je spousta – tak třeba řada povrchových molekul bílých krvinek byla původně popsána a prostudována, aniž se vědělo, jaká je jejich funkce. A během několika let se ukázalo, že molekula zvaná CD3 je nepostradatelnou součástí receptoru T-lymfocytů pro antigen a protilátky proti ní se dají velmi úspěšně použít při transplantaci ledvin. Jiná molekula, CD4, se ukázala být receptorem pro virus HIV. Z řady těchto původně jakoby prakticky nevýznamných molekul, které byly po několik let dobré jen k tomu, že si s nimi vědci hráli, se po čase vyklubaly adhezivní molekuly životně důležité pro normální funkci imunitního systému, nebo naopak zodpovědné za metastatické šíření nádorů. Stovky vědců se nyní snaží tyto poznatky využít pro diagnostické a léčebné účely a řadě farmaceutických firem z nich plynou značné příjmy.
O autorovi
Václav Hořejší
















