Jak priony zabíjejí?
Priony jsou bezesporu hitem posledních 30 let, jak o tom ostatně svědčí i četné příspěvky s touto tematikou přímo na stránkách Vesmíru. Možnost, že by za nějakou infekční chorobou nestála žádná nukleová kyselina, ale přímo zvrhlý protein, se musela v osmdesátých letech jevit velice exotická. Možná právě díky tomu si získala takovou popularitu. Dnes je víra v priony vědeckým mainstreamem, v prionové teorii však stále existují bílá místa, jež je potřeba dodatečně zmapovat.
 Zopakujme stručně, že zdravé nervové buňky standardně vyrábějí prionovou bílkovinu v neškodné monomerní formě PrPC (C pro common – běžná, resp. cellular – buněčná). Za určitých okolností se tato neškodná bílkovina přemění na nebezpečnou polymerizující PrPSc (Sc tentokrát zkracuje slovo scrapie, což je označení prionové choroby ovcí). PrPSc (a to je na ní tak šokující) podporuje zvrhnutí dalších molekul PrPC. Brzy je tak neuron zaplněn neodbouratelnými amyloidními vlákny PrPSc. U nešťastného organismu se rozvíjí rychle postupující demence končící smrtí.
Zopakujme stručně, že zdravé nervové buňky standardně vyrábějí prionovou bílkovinu v neškodné monomerní formě PrPC (C pro common – běžná, resp. cellular – buněčná). Za určitých okolností se tato neškodná bílkovina přemění na nebezpečnou polymerizující PrPSc (Sc tentokrát zkracuje slovo scrapie, což je označení prionové choroby ovcí). PrPSc (a to je na ní tak šokující) podporuje zvrhnutí dalších molekul PrPC. Brzy je tak neuron zaplněn neodbouratelnými amyloidními vlákny PrPSc. U nešťastného organismu se rozvíjí rychle postupující demence končící smrtí.
Nezadržitelný vývoj tedy začíná v okamžiku, kdy se objeví první PrPSc. K tomuto záhadnému úkazu může dojít infekční cestou. K obzvláště rizikovému chování přitom v tomto ohledu patří kanibalismus (ať už rituální jako u papuánských domorodců s nemocí kuru, nebo nucený jako u skotu krmeného masokostní moučkou a nakaženého tak „nemocí šílených krav“). Ani lidé, kteří se kanibalismu důsledně vyhýbají, nejsou před prionovými chorobami zcela bezpeční. Zatoulaná molekula PrPSc se může objevit při přenosu rohovkového štěpu nebo dalších produktů získaných z infikovaného dárce. (Ačkoliv mezidruhové přenosy prionů nebyly prokázány, u části populace vyvolalo stav blízký hysterii i masové propuknutí zmíněné „nemoci šílených krav“.)
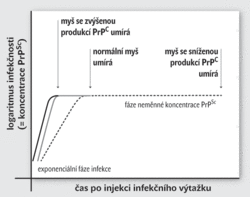
Zdálo by se, že příčinou úmrtí je při prionové infekci nahromadění amyloidů. Tuto hypotézu však vyvrací současná práce skupiny Johna Collingea uveřejněná v časopise Nature. Základem výzkumu zde bylo jednoduché srovnání délky života myší s různou rychlostí syntézy PrPC. K dispozici bylo několik skupin geneticky modifikovaných zvířat – některé syntetizovali PrPC výrazně rychleji, jiné pomaleji a část myší dokonce vůbec. Všem těmto zvířátkům byl do těla vpraven výtažek z mozku nemocné myši obsahující PrPSc. Jaký vývoj bychom očekávali? PrPSc transformuje PrPC v buňkách zvířete do infekční formy. Čím vyšší exprese PrPC, tím rychlejší průběh nemoci.
A skutečně – zatímco skupina bez produkce PrPC se se smrtící injekcí celkem bez problémů vyrovnala, ostatní zvířata po čase zemřela. Zcela v souladu s naším očekáváním uhynuly nejdříve (už po 60 dnech) myšky se zvýšenou expresí PrPC, jejich šťastnější kolegyně s nízkou produkcí PrPC se dožily skoro tři čtvrtě roku.
Až sem by bylo všechno v pořádku. Překvapení ale přineslo měření hladiny amyloidních shluků PrPSc v průběhu nemoci. Dosud jsme měli za to, že nahromadění určitého kritického množství prionových vláken ochromí buňku a způsobí v důsledku smrt celého organismu. Vysoce přesná (a dříve prakticky nedostupná) průběžná měření obsahu amyloidních prionů v neuronech myší odhalila, že nákaza má dvě fáze: První je charakteristická očekávaným exponenciálním růstem koncentrace PrPSc. Po dosažení kritické hladiny však myši neumírají (resp. umírají jen ty s nejvyšší expresí PrPC). Místo toho u nich nastupuje předsmrtná fáze, kdy už se hladina sledovaných prionů nemění. Právě délka této periody pak nepřímo koreluje s expresí PrPC.
Ukazuje se tedy, že infekčnost (exponenciální růst koncentrace PrPC) nemusí souviset s toxicitou a letalitou. Smrt přichází se zpožděním a patrně nemá co dělat s nějakou kritickou hladinou PrPSc. Sami autoři studie předpokládají existenci nějaké hypotetické třetí formy prionu označované PrPL (L jako „lethal“), která se objevuje s určitým časovým odstupem a jejíž výskyt má být skutečnou příčinou smrti.
Reed B. Wickner nabízí ve svém komentáři v tomtéž vydání časopisu další postřehy o vztazích mezi infekčností a toxicitou: Pokud se škodlivé PrPSc hromadí pomaleji, může se na ně organismus adaptovat a potom déle přežívat i po dosažení maximální koncentrace. Jak by taková adaptace mohla vypadat? Amyloidní vlákno patrně narůstá jen na svých koncích, ale škodit může celý jeho povrch. Dlouhá vlákna PrPSc se tak hromadí pomaleji než ta krátká, ale mohou být nebezpečnější (nízká infekčnost a vysoká toxicita). Myš s nízkou expresí PrPC stíhá teoreticky snižovat toxicitu hromadících se vláken jejich štípáním, tím je však potom rychlejší jejich růst z nově vzniklých konců. Zvíře syntetizující PrPC rychleji pak ve svých buňkách hromadí spíše toxická dlouhá vlákna. Existence záhadného PrPL by tak pro vysvětlení Collingeova pozorování nemusela být nutná. Ať se nakonec existence nové, letální formy PrP prokáže nebo ne, stávající výzkum ukazuje, jak málo toho ještě víme o prionech (a vlastně i dalších amyloidních onemocněních, mezi které patří i parkinsonismus nebo Alzheimerova choroba). Překvapivého zjištění o nezávislosti toxicity a infekčnosti prionů patrně využijí i odpůrci prionové teorie.
Ačkoliv jsou priony, jak už bylo řečeno, u většiny vědců velmi oblíbené, najde se stále dost těch, kteří nevěří, že představují tak výjimečnou entitu. Podle těchto výzkumníků není původcem „prionových“ nemocí tajemný protein, ale prachobyčejný (byť trochu pomalý) virus či něco podobně všedního.
Literatura
Sandberg M. K., Al‑Doujaily H., Sharps B., Clarke A. R., Collinge J.: Nature 470, 540, 2011
Wickner R. B.: Nature 470, 470, 2011
Ke stažení
 článek ve formátu pdf [474,82 kB]
článek ve formátu pdf [474,82 kB]
O autorovi
Petr Zouhar
















