Náhrada funkce lidských jater – realita, nebo přání?
| 13. 1. 2011Játra jsou „chemickou továrnou“ našeho organismu. Hrají ústřední roli nejen v detoxifikaci, ale i v syntéze a zajišťují více než 500 různých metabolických pochodů. Při zabezpečené funkci ostatních životně důležitých orgánů (srdce, plic, mozku, ledvin) můžeme žít bez jater pouze několik dní.
 Při akutním selhání jater (ASJ) umírá 30 až 40 % postižených – jak v USA, tak i v Evropě – a to nehledě na včasné poskytnutí intenzivní péče na současné úrovni. Příčinou ASJ je v USA ve 46 % předávkování acetaminofenem/ paracetamolem (resp. v Evropě ve 20 % – u nás preparátem Paralen), ve 12 % dalšími hepatotoxickými léky (resp. v 29 %). V 10 % se v Evropě ASJ rozvíjí následkem virového onemocnění jater (resp. v 31 % v USA). Příčina ASJ zůstává neznámá v 15 %, resp. v 17 %.
Při akutním selhání jater (ASJ) umírá 30 až 40 % postižených – jak v USA, tak i v Evropě – a to nehledě na včasné poskytnutí intenzivní péče na současné úrovni. Příčinou ASJ je v USA ve 46 % předávkování acetaminofenem/ paracetamolem (resp. v Evropě ve 20 % – u nás preparátem Paralen), ve 12 % dalšími hepatotoxickými léky (resp. v 29 %). V 10 % se v Evropě ASJ rozvíjí následkem virového onemocnění jater (resp. v 31 % v USA). Příčina ASJ zůstává neznámá v 15 %, resp. v 17 %.
Pokud hovoříme o urgentně provedené transplantaci jater jako o jediné kauzální léčbě těchto nemocných, která výrazně zvyšuje šanci pacienta na přežití, je třeba zdůraznit, že část nemocných se vzhledem k omezenému počtu vhodných dárců transplantace vůbec nedočká. A navíc – v závislosti na příčině a průběhu onemocnění můžeme spontánní zhojení jater očekávat u 10 až 60 % nemocných. U této skupiny pacientů je provedení akutní transplantace také život zachraňující léčbou, ale v podstatě ji můžeme chápat jako vynucený a velmi nákladný „overtreatment“ s nutností celoživotního užívání imunosupresivních léků. A to se všemi vyplývajícími riziky pro pacienta, jako jsou život ohrožující infekce či výrazně vyšší výskyt zhoubných onemocnění.
 Vysoká úmrtnost nemocných s ASJ je důvodem hledání efektivní možnosti tzv. „bridging therapy“, tj. „převedení“ nemocného přes život ohrožující fázi ASJ k úspěšné transplantaci nebo ke spontánní regeneraci jater.
Vysoká úmrtnost nemocných s ASJ je důvodem hledání efektivní možnosti tzv. „bridging therapy“, tj. „převedení“ nemocného přes život ohrožující fázi ASJ k úspěšné transplantaci nebo ke spontánní regeneraci jater.
Metody schopné zvrátit průběh ASJ musejí tedy efektivně odstranit toxiny cirkulující v organismu, nahradit syntetickou funkci jater a zároveň zabránit rozvoji infekce. Na rozdíl od dočasných náhrad srdečních, plicních či ledvinových funkcí, které jsou v současnosti technicky dostupné, nepodařilo se komplexní funkci jater doposud uměle plně nahradit.
I. Biologické metody
Myšlenka „umělých jater“ (BAL – bioartifitial liver) vznikla zhruba před padesáti lety, kdy F. Sorrentino prokázal, že čerstvá jaterní tkáň syntetizuje ureu z chloridu amonného a metabolizuje ketony. Nicméně trvalo dalších 20 let, než dostala bioartificiální játra podobu zařízení s mimotělním oběhem, do kterého byla zapojena kapsle s živými izolovanými jaterními buňkami (hepatocyty). Vzhledem k možnosti kultivace a odolnosti se jednalo o buňky jaterního nádoru.
V následujících třiceti letech se zabývala touto problematikou řada center a byly vyvinuty různé způsoby bioeliminace: od prosté mimotělní perfuze jater přes transplantaci jaterních buněk až k propracovaným systémům BAL. Zdůrazňované potenciální výhody biologické metody jsou postaveny na předpokladu, že živé hepatocyty budou nejen detoxikovat pacienta, ale budou také současně zástupně syntetizovat pro jeho organismus životně důležité proteiny.
Transplantace hepatocytů
Metoda transplantace hepatocytů se začala experimentálně používat v polovině sedmdesátých let a byla vyzkoušena i v klinickém experimentu. Existuje více způsobů, jak hepatocyty do organismu vpravit. Provádí se takzvaná hepatizace sleziny, buňky je možné aplikovat do poškozených jater nebo je zabalené v polymeru vložit přímo do břišní dutiny. Mohou být použity buňky čerstvé, buňky po rozmražení či enkapsulované. Výsledky těchto postupů však nejsou příliš přesvědčivé a přínosné byly jen u některých vrozených metabolických poruch.
BAL
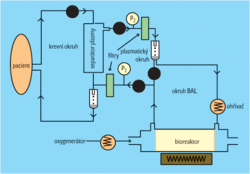
 Princip „umělých jater“ je postaven na vytvoření mimotělního krevního oběhu, ze kterého je separována plazma a ta je perfundována přes dutá vlákna osazená jaterními buňkami. Tato vlákna jsou uložena v bioreaktoru. V soustavě je zapojen většinou oxygenátor, pořípadě aktivní uhlí či pryskyřice, která pomáhá v procesu detoxikace. Samotné jaterní buňky kromě detoxikace (nahrazují selhávající cytochrom P450) plní ještě funkci syntetickou (proteosyntéza, glukoneogeneze, ureogeneze) – viz obr. 1.
Princip „umělých jater“ je postaven na vytvoření mimotělního krevního oběhu, ze kterého je separována plazma a ta je perfundována přes dutá vlákna osazená jaterními buňkami. Tato vlákna jsou uložena v bioreaktoru. V soustavě je zapojen většinou oxygenátor, pořípadě aktivní uhlí či pryskyřice, která pomáhá v procesu detoxikace. Samotné jaterní buňky kromě detoxikace (nahrazují selhávající cytochrom P450) plní ještě funkci syntetickou (proteosyntéza, glukoneogeneze, ureogeneze) – viz obr. 1.
V dnešní době je nejpoužívanějším systémem ELAD (Extracorporeal Liver Assist Device), HepatAssist® a MELS (Modular Extracorporeal Liver System). Tato zařízení se osvědčila jak v experimentu na zvířatech, tak i ojediněle v klinickém experimentu v humánní medicíně (obr. 2).
 Jejich vliv na snížení hodnot tzv. markerů ASJ – intrakraniálního tlaku (ICP), sérových hladin bilirubinu, amoniaku a transamináz – byl experimentálně prokázán. Největší klinická multicentrická studie provedená týmem profesora Demetriona systémem HepatAssist® na skupině 171 pacienta s ASJ (85 léčených a 86 v kontrolní skupině bez této léčby) při použití prasečích hepatocytů však očekávání nesplnila. Snížit úmrtnost před provedením transplantace jater u pacientů s otravou hepatotoxickým jedem a u pacientů s fulminantním průběhem ASJ se podařilo statisticky nevýznamně. Nebylo prokázáno ani patrné zlepšení třicetidenního přežití u těchto nemocných (Demetriou A. A. a kol., 2001, 2004).
Jejich vliv na snížení hodnot tzv. markerů ASJ – intrakraniálního tlaku (ICP), sérových hladin bilirubinu, amoniaku a transamináz – byl experimentálně prokázán. Největší klinická multicentrická studie provedená týmem profesora Demetriona systémem HepatAssist® na skupině 171 pacienta s ASJ (85 léčených a 86 v kontrolní skupině bez této léčby) při použití prasečích hepatocytů však očekávání nesplnila. Snížit úmrtnost před provedením transplantace jater u pacientů s otravou hepatotoxickým jedem a u pacientů s fulminantním průběhem ASJ se podařilo statisticky nevýznamně. Nebylo prokázáno ani patrné zlepšení třicetidenního přežití u těchto nemocných (Demetriou A. A. a kol., 2001, 2004).
Navíc postupně vyvstaly některé problémy s klinickým využitím BAL. I když se nebezpečí přenosu prasečích retrovirů (PERV–porcine endogenous retrovirus) neprokázalo, obavy spojené s použitím prasečích hepatocytů mnohdy přetrvávají. Obtížně řešitelná je také dostupnost požadovaného poměrně velkého množství živých hepatocytů. Kryoprezervace hepatocytů, která by umožnila jejich pozdější rychlé použití, vede k výraznému snížení životaschopnosti, a tím i účinnosti bioeliminace.
Na straně druhé jsou některé problémy s BAL v budoucnosti patrně řešitelné. Slibným zdrojem buněk by mohly být pluripotentní zárodečné buňky. Pro možnou diferenciaci v hepatocyty je možné použít několik buněčných populací. Jde o hematopoetické, mezenchymální zárodečné buňky a dále o tzv. oválné buňky (HLSC – human liverderived stem cells) získané přímo z jaterní tkáně. Jejich přítomností je někdy vysvětlována obrovská regenerační schopnost jater například po rozsáhlém resekčním operačním výkonu nebo těžkém poranění jater.
Z výše uvedeného plyne, že široké klinické použití bioeliminačních metod nelze v krátké době očekávat. Podmínkou je vyřešení zásadních problémů spojených se získáváním dostatečného množství zdravých a funkčních hepatocytů, se zkrácením a zjednodušením jejich přípravy, prodloužením doby jejich použitelnosti a se zvýšením kapacity bioreaktorů.
Naše výsledky v experimentu na velkém laboratorním zvířeti – praseti – tyto obavy potvrdily. Navíc jsme neprokázali jednoznačnou efektivitu bioeliminace na snížení intrakraniálního tlaku jako jednoho ze zásadních identifikačních znaků akutního selhání jater (Ryska M. a kol., 2006). Metoda, pokud by byla za současného stavu poznání použita v klinické praxi, přináší výrazné zatížení ošetřujícího týmu zdravotníků a složitou logistiku léčby (obr. 3).
II. Nebiologické metody
Principem nebiologických eliminačních metod je odstranění toxinů způsobujících nezvratné poškození mozku pacienta. Tato myšlenka vznikla na počátku padesátých let minulého století a vycházela z předpokladu, že jde o malé molekuly, které je možné odstranit hemodialýzou, hemofiltrací či různými absorbéry. Dnes však víme, že škála látek ovlivňujících průběh ASJ je daleko širší. Vedle nízkomolekulárních látek, jako jsou amoniak, fenoly a volné žlučové kyseliny, to jsou i prozánětlivé mediátory (cytokiny, anafylatoxiny), vazoaktivní látky a inhibitory buněčného růstu (TGF1 – transforming growth factor). Rozptyl molekulární hmotnosti těchto látek je obrovský, od 500 Da až do 100 kDa. Řada z nich je navíc vázána na plazmatické bílkoviny.
Z tohoto pohledu není překvapením, že původně využívané metody neovlivnily přežití pacientů a byly záhy vystřídány terapeutickou náhradou plazmy či celé krve. Tyto postupy sice zaručují snížení hladiny uvedených látek v oběhu, avšak nesou s sebou celou řadu nevýhod v podobě posttransfuzních reakcí: vznik hypokalcémie, hypotermie, metabolické acidózy a plicního edému. Dále vedou k úbytku koagulačních faktorů a k omezení růstového faktoru hepatocytů (HGF – hepatocyte growth factor), jehož nedostatek přispívá zpětně k progresi ASJ. Další nevýhodou jsou i vysoké náklady. Všechna tato negativa zapříčinila odklon od těchto metod směrem k léčbě založené na principu adsorpce.
MARS®
Prvním dokonalejším adsorbčním zařízením je systém MARS® minulého století (Stange J. a kol., 1993). Principem (Molecular Adsorbent Recycling System), který byl poprvé experimentálně použit počátkem devadesátých let tohoto zařízení je okruh s cirkulujícím roztokem albuminu, který přes semipermeabilní, pro albumin nepropustnou membránu přejímá difuzí z krve pacienta toxiny vázané na albumin. Vzhledem k tomu, že 60 až 80 % bilirubinu je vázáno právě na albumin, snižuje MARS® u nemocných s ASJ významně hladinu bilirubinu. Tato metoda byla použita k léčbě ASJ u tisíců pacientů, avšak namátková kontrolní studie prokazující efektivitu této léčby doposud chybí. Hlavním důvodem jsou obtíže s přípravou designu průkazné klinické studie.
Bez ohledu na tuto skutečnost se MARS® vyžaduje značné množství albuminu, je spojena osvědčil při léčbě některých komplikací ASJ nebo stavů, které k ASJ vedou. Vzhledem k tomu, že léčba pomocí přístroje MARS® s poměrně vysokými náklady.
Prometheus®
Na podobném principu byl koncem minulého desetiletí sestrojen i eliminační systém Prometheus® (FPSA – Fractionated plasma separation and adsorption), který kombinuje albuminovou dialýzu s hemodialýzou. Z krve pacienta očištěné hemodialýzou je separována plazma, která prochází dvěma adsorbéry (Prometh 01, Prometh 02). Prometh 01 propouští molekuly do velikosti 250 kD, a tím umožňuje adsorpci žlučových kyselin, aromatických aminokyselin, fenolických substancí a toxinů. Prometh 02, se styren-divinylbenzen kopolymerem prostorovou sítí, vychytává negativně nabité ligandy (např. nekonjugovaný bilirubin). Nosičem toxinů je zde albumin pacienta, a tudíž ho není nutné do systému dodávat.
Ze srovnání obou nebiologických systémů vychází lépe Prometheus®, a to v resorpci látek jak rozpustných ve vodě, tak i vázaných na albumin (Laleman W. a kol., 2006).
Naše výsledky eliminační terapie přístrojem Prometheus u experimentálně navozeného ASJ u prasete (obr. 4) prokázaly statisticky významné snížení ICP a bilirubinu ve srovnání s kontrolní skupinou (Ryska M. a kol., 2009) s tím, že přitom u zvířete nedošlo
k významným hemodynamickým změnám (Lasziková E. a kol., 2010).
Prometheus® určil trend nebiologické eliminace směrem k výraznému zjednodušení.
SEPET®
Systém SEPET® (Selective plasma filtration therapy) je založen na dutých vláknech tvořených z membrány, částečně propustné pro albumin. Princip vychází z nových poznatků o významu některých již zmiňovaných látek (HGF, TGF1, Il-6 a jiných prozánětlivých interleukinů) v patofyziologii ASJ. Většina těchto látek má molekulovou hmotnost menší než 100 kDa. Membrána selektivního filtru je koncipována tak, aby byla volně propustná pro tyto nízkomolekulární látky, stejně jako pro další endotoxiny (lipid A) a anafylatoxiny (C3a). Nepropustná je naopak pro některé imunoglobuliny (IgG, IgM) a v limitovaném množství propouští albumin a koagulační faktory.
Výsledkem experimentální studie s použitím této eliminační metody je významné snížení amoniaku, aromatických aminokyselin, prozánětlivých cytokinů (IL-6, IL-18, IL1, TNF) a TGF-1. Naopak propustnost pro albumin a většinu koagulačních faktorů a HGF je menší než 30 %. Během šestihodinové léčby tímto přístrojem se vyprodukuje přibližně 2500 ml ultrafiltrátu, což odpovídá 1,6 až 2 litrům plazmy, kterou je možné při klinickém použití snadno nahradit. Tento systém, na rozdíl od přístroje MARS®, nepočítá s filtrací bilirubinu, jehož cytotoxický efekt je v poslední době považován za sporný.
Systém SEPET® tak představuje jednoduchou, efektivní a ne příliš nákladnou podpůrnou metodu v léčbě ASJ. V současné době probíhá namátková studie, která by měla prokázat účinnost tohoto systému. Sami s ní doposud zkušenosti nemáme.
Závěr
Efektivní eliminační metodu, srovnatelnou s dialýzou u nemocných se selháváním ledvin a jednoznačně zlepšující přežití pacientů s akutním selháním jater, se doposud nepodařilo vyvinout. Při srovnání současných možností podpory funkcí selhávajících jater lze konstatovat, že biologické eliminační metody zatím do klinické praxe nepřinesly očekávané výsledky. Užití nebiologických metod se v současné době jeví jako perspektivní a jejich přínos je prokázán na prospektivních studiích.
K jejich zhodnocení je však třeba provést namátkové studie. Vlastní experimentální zkušenosti kolektivu autora tento trend potvrzují. U akutního selhání jater jsme v experimentu prokázali, že léčba nebiologickým podpůrným systémem Prometheus® významně snižuje jak hladiny bilirubinu, tak i hodnoty intrakraniálního tlaku a může mít proto potenciál efektivní „bridging therapy“ v humánní medicíně.
Přínos této léčby u akutní jaterní dysfunkce nebo jaterního selhání jako následků velké jaterní resekce (například u nemocných s rozsáhlými jaterními nádory) či ztrátového poranění jater doposud prokázán nebyl.
Každý z uvedených léčebných eliminačních přístupů, biologický či nebiologický, však přináší svá pro i proti. Nabízí se myšlenka tyto systémy spojit. Vznikají tak tzv. hybridní systémy, jejichž někteří zástupci (MELS, HepatAssist-2) jsou již v experimentálním testování. Otázkou je, zda složitost takového systému nebude limitovat jeho klinické využití. Umožnit takové využití je úkolem jak pro vývojáře, tak i pro experimentátory pro další léta.
Poznámka: Na experimentálních aplikacích tzv. umělých jater pracuje v ČR skupina doktorandů autora tohoto článku: chirurgové T. Pantoflíček, O. Ryska, E. Koblihová a L. Bieberová, anesteziologové E. Lászikováa J. Pražák.
Projekt široce zaměřeného výzkumu „umělých jater“ je podporován z prostředků rezortního výzkumu S8120 MO, IGA Ministerstva zdravotnictví NT1143 a výzkumným centrem LN00A065.
Ke stažení
 článek ve formátu pdf [451,16 kB]
článek ve formátu pdf [451,16 kB]















