Poodhalené tajemství kmenových buněk
Pověst o Prométheovi, k němuž znovu a znovu přilétá orel Ethon a pokaždé mu z těla vyrve kus jater, která mu přes noc opět dorostou, je možná nejstarší zmínkou o existenci a funkci kmenových buněk v historii. Citlivější představu o kmenových buňkách lze vytušit v klasickém konceptu omnis cellula e cellula (každá buňka z buňky), který formuloval německý patolog Rudolf Virchow r. 1858. Od tohoto konceptu byl již jen krok k odvážné hypotéze o existenci univerzálních krvetvorných buněk (1917), k potvrzení hypotézy objevem, že nepatrná populace buněk skrytá v kostní dřeni má schopnost množit se v podmínkách in vitro, k izolaci prvních linií myších embryonálních karcinomových buněk, které mají vlastnosti velmi podobné vlastnostem kmenových buněk (1970), k první úspěšné izolaci embryonálních kmenových buněk z myších embryí (1981) a konečně k získání embryonálních kmenových buněk z lidských blastocyst připravených v rámci programu asistované reprodukce a darovaných pro výzkumné účely (1998).
 Kromě těchto klíčových objevů bylo v posledních deseti letech nalezeno a popsáno mnoho dalších typů kmenových buněk z různých tkání a orgánů zárodků nebo dospělých jedinců. Která mimořádná vlastnost tedy nejlépe charakterizuje kmenové buňky, z nichž mohou vzniknout celé tkáně a orgány? Co stojí za jejich schopností regenerovat složité buněčné systémy, například játra? Donedávna byla kmenovost velkou neznámou. Obecně ji lze vyjádřit jako schopnost buněk množit se v nediferencované podobě a zároveň si podržet schopnost vytvořit diferencované, funkčně specializované buňky. Vše nasvědčuje tomu, že kmenovost je dána především vnitřními mechanizmy buňky, a je tedy na okolním prostředí víceméně nezávislá.
Kromě těchto klíčových objevů bylo v posledních deseti letech nalezeno a popsáno mnoho dalších typů kmenových buněk z různých tkání a orgánů zárodků nebo dospělých jedinců. Která mimořádná vlastnost tedy nejlépe charakterizuje kmenové buňky, z nichž mohou vzniknout celé tkáně a orgány? Co stojí za jejich schopností regenerovat složité buněčné systémy, například játra? Donedávna byla kmenovost velkou neznámou. Obecně ji lze vyjádřit jako schopnost buněk množit se v nediferencované podobě a zároveň si podržet schopnost vytvořit diferencované, funkčně specializované buňky. Vše nasvědčuje tomu, že kmenovost je dána především vnitřními mechanizmy buňky, a je tedy na okolním prostředí víceméně nezávislá.
Tento složitý mechanizmus bychom rádi znali a uměli do něj zasáhnout hned z několika důvodů. Jedním z nich je vize buněčných terapií pomocí lidských embryonálních kmenových buněk. Pro účinnou léčbu bude většinou třeba velké množství buněk, jež se předem přemění na požadovaný buněčný typ, který v živém organizmu nahradí buňky poškozené, popřípadě doplní buňky chybějící. K tomu je třeba vědět, jaké mechanizmy jsou odpovědné za kmenovost, co embryonální kmenové buňky potřebují, aby se v podmínkách in vitro množily, a nebyly přitom narušeny jejich genetické vlastnosti, čím lze buňky přinutit, aby se vzdaly kmenovosti a účinně se diferencovaly požadovaným směrem. Stále totiž hrozí nebezpečí, že si nepatrná část buněk skrytá někde mezi diferencovanými buňkami udrží svou kmenovost a po transplantaci do živého organizmu se začne přetvářet v buňky nádorové.
Opakovaně totiž prokazujeme existenci nádorových kmenových buněk, které bezesporu vznikly přeměnou genetických vlastností normálních kmenových buněk a jejichž významnou charakteristikou, tentokrát zcela nežádoucí, je opět kmenovost. Je tedy pravděpodobné, že intenzivním studiem společných a lišících se mechanizmů, které řídí kmenovost normálních a nádorových kmenových buněk, je možné získat klíč k pochopení nádorové transformace buněk, a tím možná i k léčbě nádorových onemocnění.
Lidské embryonální kmenové buňky jako model
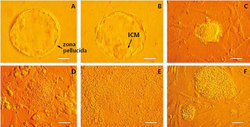
V hierarchii kmenových buněk mají výjimečné postavení embryonální kmenové buňky izolované z lidských embryí. Představují model, z něhož se lze poučit o mechanizmu kmenovosti ve vztahu k člověku. Vývoj člověka vyžaduje postupnou specifikaci více než 200 buněčných typů z jednobuněčného embrya, a embryonální kmenové buňky mají diferenciační kapacitu obdobnou nebo jen nepatrně sníženou. Představují nejuniverzálnější známý typ lidských kmenových buněk a zároveň jsou již zvládnuty techniky jejich získávání (obrázek 1), dlouhodobého udržování i množení v podmínkách in vitro. Lze se domnívat, že mechanizmy podílející se na kmenovosti embryonálních buněk budou podobné u mnoha dalších typů kmenových buněk, včetně nádorových. Popíšu tři cesty, které pravděpodobně vedou k odhalení tajemství kmenovosti lidských embryonálních buněk.Signální dráhy růstových faktorů
Růstové faktory jsou malé molekuly bílkovin. Vytvářejí je různé buněčné typy v různých vývojových stadiích. Evolučně jsou růstové faktory konzervativní (mezidruhově se příliš neliší) a biologicky neuvěřitelně aktivní. Spouštějí složité signální dráhy uvnitř buněk a regulují většinu důležitých buněčných funkcí. Mají velkou účinnost i při nepatrných koncentracích. Ve vztahu ke kmenovosti se signální aktivity růstových faktorů liší u embryonálních kmenových buněk myší a člověka, přestože mají oba buněčné typy obdobný původ a mnoho společných vlastností, včetně schopnosti neomezeného množení in vitro a diferenciace. Myším embryonálním kmenovým buňkám však stačí pro neomezené množení leukemický inhibiční faktor. 1) Když se tato bílkovina přidá do kultivačního média, množí se myší embryonální kmenové buňky mnoho let, aniž diferencují. Naproti tomu buňky lidského původu na tuto bílkovinu nereagují a ochotně diferencují i v médiích s vysokými koncentracemi leukemického inhibičního faktoru.Jinak u myší než u lidí se chová také kostní morfogenetický faktor 4. 2) U myších embryonálních kmenových buněk blokuje přirozenou diferenciaci do nezralé populace nervových buněk, a posléze do zralých neuronů (obrázek 2). U lidských embryonálních kmenových buněk spouští diferenciaci jiného typu buněk, který je v normálním vývoji embrya součástí placenty a žloutkového váčku. Jediným dosud nalezeným růstovým faktorem, který má podobný účinek u myších i lidských embryonálních kmenových buněk, je savčí forma růstového faktoru WNT (objeveného dříve u mušky Drosophila melanogaster). Když se signální dráha tohoto faktoru aktivuje syntetickou molekulou, pomáhá udržet kmenovost myších i lidských buněk. Sama o sobě ji ale neudrží, vyžaduje náročné kultivační podmínky a pravděpodobně i kooperaci jiných signálních drah. Několik studií uveřejněných v posledních měsících naznačuje, že nejvýznamnějšími kandidáty na spouštění kooperujících drah mohou být fibroblastové růstové faktory a některé bílkoviny z rodiny transformujících růstových faktorů, které pocházejí přímo z lidských embryonálních kmenových buněk. Uměle zvýšená tvorba jednoho z transformujících růstových faktorů – nodalu – zablokuje diferenciaci a přispěje k udržení „kmenovosti“ buněk. Vně buněk se tento faktor specificky váže na komplex membránových receptorů, který je společný pro jinou příbuznou signální bílkovinu z rodiny transformujících růstových faktorů – aktivin – a uvnitř buněk stimuluje společnou signální dráhu. Příbuznost zmíněných růstových faktorů, a zejména společné receptory a signální dráhy naznačují, že se aktivin na udržování kmenovosti lidských embryonálních kmenových buněk podílí také, ovšem pouze částečně. A skutečně – když byla funkce nodalu zablokována jinými bílkovinami, k očekávané diferenciaci nedošlo. Zato při použití syntetického blokátoru, který brzdí aktivaci nejen receptorů nodalu a aktivinu, ale i transformujícího růstového faktoru beta 1, začaly buňky rychle diferencovat. Navíc se zdá, že společná aktivita tří růstových faktorů je přímo řízena působením fibroblastového růstového faktoru. Zablokování aktivity právě jen tohoto růstového faktoru totiž vede k mimořádně rychlé diferenciaci buněk.
Ze všech signálních dráh, které by se mohly podílet na udržení kmenovosti a byly by klíčové zejména pro přípravu dostatečného množství embryonálních kmenových buněk pro buněčné terapie, známe zatím čtyři, možná pět růstových faktorů a jejich receptorů, z nichž žádný nefunguje tak jednoznačně jako leukemický inhibiční faktor u myších embryonálních kmenových buněk. Navíc se zdá, že signální dráhy, které jsou pro udržení kmenovosti lidských embryonálních kmenových buněk důležité, se mohou navzájem doplňovat, nebo dokonce zastupovat. Zůstává otázkou, zda je to dáno větší složitostí lidských embryonálních kmenových buněk, nebo pouze nedokonalou znalostí jejich biologie.
Uzavřený kruh transkripčních faktorů
Transkripční faktory uvnitř buněk představují velkou skupinu bílkovin, jejichž aktivita (vazba na DNA) reguluje chování genů. Zvláštní skupina transkripčních faktorů obsahujících homeodoménu představuje rodinu, jejíž členové jsou vesměs evolučně konzervativní. Tato rodina zřejmě hraje důležitou roli v diferenciaci mnoha buněčných typů.Dva takové transkripční faktory (OCT4 a nanog) jsou aktivní v časném vývoji savců a oběma je připisována důležitá úloha v embryonálních kmenových buňkách, i když v nich má každý jinou biologickou úlohu. Zdá se, že působí v souvisejících signálních procesech, a tím přispívají k udržení kmenovosti.
Když je zablokována funkce prvního z nich, buňky rychle diferencují v buňky nervové. Když je zablokována funkce druhého, buňky diferencují do mimoembryonálního entodermu. Téhož výsledku jako po vyblokování genu kódujícího druhý transkripční faktor lze docílit, když se naopak uměle zvýší funkce genu pro první transkripční faktor. Je tedy zřejmé, že znalost co největšího počtu genů, jejichž aktivita je regulována uvedenými transkripčními faktory, může přinést zásadní poznatky o mechanizmech, jimiž je definována kmenovost.
Transkripční faktor OCT4 je typický svými interakcemi s dalšími transkripčními faktory, například s bílkovinou SOX2, která se podílí na vývoji nervových buněk a patří do úplně jiné rodiny transkripčních faktorů. Podle všeobecně přijímané hypotézy jsou právě interakce transkripčních faktorů z obou odlišných rodin jedním ze základních mechanizmů regulací genů v časném vývoji. Zdálo se tedy téměř jisté, že zmíněné tři transkripční faktory a jejich vzájemné vztahy jsou významné i pro regulace kmenovosti lidských embryonálních kmenových buněk.
Členové týmu soustředěného okolo Rudolfa Jaenische, 3) Douglase Meltona 4) a Richarda Younga 5) se pokusili pomocí specifických protilátek namířených proti jednotlivým transkripčním faktorům identifikovat vše, co je s těmito transkripčními faktory v nějaké vazbě, a potom analýzou DNA na formátu mikročipů hledali geny, které jsou uvedenými transkripčními faktory v lidských embryonálních kmenových buňkách regulovány.
Jejich objev elektrizoval veřejnost. Objevili totiž, že bílkoviny zmíněných tří transkripčních faktorů ve vzájemné souvislosti nasedají na regulační sekvence více než 300 genů, z nichž nezanedbatelná část kóduje právě vývojově významné transkripční faktory pro různé směry diferenciace buněk. Ještě významnějším poznáním bylo, že tyto tři faktory vytvářejí uzavřený regulační kruh. Výsledkem je mechanizmus, jímž si embryonální kmenové buňky udržují schopnost kmenovosti a zároveň dokážou správně reagovat na diferenciační signály, jak přicházejí z vnějšího prostředí a postupně se objevují ve vývoji. Jakékoliv nepatrné změny ve vztazích těchto tří klíčových transkripčních faktorů mohou narušit vyvážený systém regulačního kruhu, což může mít vliv na funkce mnoha genů, a tím i na osudy buněk.
Objev nového mechanizmu, jímž je regulován program zapínání a vypínání genů v lidských embryonálních kmenových buňkách, bezesporu představuje jednu z možných odpovědí na otázku, čím je určován osud buněk ve vývoji člověka od embrya po dospělého jedince.
Bílkoviny v rodině Polycomb
Vědci z téhož týmu pak udělali další krok k odhalení tajemství kmenovosti. Zjistili, že komplex bílkovin ze skupiny Polycomb potlačuje v myších i lidských embryonálních kmenových buňkách funkce většiny regulačních genů, jejichž bílkovinové produkty (transkripční faktory) zapínají jiné geny, které jsou klíčové pro diferenciaci buněk. Tento kontrolní systém pomáhá udržet embryonální kmenové buňky v nediferencovaném stavu, jinými slovy přispívá k jejich kmenovosti.Již dříve byly bílkoviny skupiny Polycomb popsány jako molekuly výběrově potlačující funkce genů během vývoje nejrůznějších organizmů od mušky Drosophila melanogaster po laboratorní myš. Nález jejich mohutné aktivity v nejčasnějších stadiích vývoje člověka, který je bezesporu reprezentován lidskými embryonálními kmenovými buňkami, je opravdovým objevem na poli vývojové biologie.
Rudolf Jaenisch dokonce tvrdí, že „bílkoviny Polycomb jsou základní substancí vývoje“, a Richard Young dodává, že „jejich objev znamená obrovský pokrok v úsilí pochopit regulační mechanizmy lidských embryonálních kmenových buněk, které představují klíč k pochopení vývoje člověka“.
Jak to na poli špičkové vědy bývá, jednoduchý, ale dokonale fungující mechanizmus byl objeven díky technicky velice náročnému zmapování všech genů (resp. jejich regulačních částí) obsažených v lidském genomu, na které se váže společná součást bílkovin Polycomb. Zároveň byl obdobný přístup použit pro zjištění cílových genů RNA polymerázy II, což je enzym, který svou vazbou naopak spouští funkci genů. Popis jeho struktury byl letos oceněn Nobelovou cenou za fyziologii a medicínu (viz Vesmír 86, 18, 2007/1). Výsledky měly velkou výpovědní hodnotu. U lidských embryonálních kmenových buněk se RNA polymeráza II váže na třetinu genů, které tak mohou být normálně přepisovány. Naproti tomu se bílkovina Polycomb váže na zbylé dvě třetiny genů, jejichž aktivita je tímto způsobem potlačena. Mimořádně zajímavým zjištěním je, že RNA polymeráza II nasedá na geny spojené s množením buněk, zatímco bílkovina Polycomb se převážně váže na geny spouštějící diferenciaci buněk. Přesně vyvážený mechanizmus aktivace nebo potlačování genů funguje i v případě genů kódujících signální dráhy růstových faktorů. „Mostem“ mezi mechanizmem regulačního kruhu transkripčních faktorů a mechanizmem potlačení exprese genů bílkovinami rodiny Polycomb bylo zjištění, že každý ze tří zmiňovaných „nadřazených“ transkripčních faktorů nasedá přibližně na třetinu genů kódujících transkripční faktory spojené s diferenciací, které jsou přechodně vyblokované bílkovinou Polycomb. Stejné transkripční faktory se dělí i o další geny, které jsou naopak u embryonálních kmenových buněk spojené s RNA polymerázou II, a jsou tedy aktivní.
Příroda o krok před námi
Jak by pokračoval příběh o Prométheovi, kdyby Herakles nakonec nezabil orla Athona a neukončil tím zázračnou regeneraci odsouzencových jater? Proč vlastně existuje něco jako regenerační limit kmenových buněk, když popsané mechanizmy fungují v uzavřeném kruhu jako perpetuum mobile, a jestliže není kruh protržen, měly by se buňky množit neustále? To vše jsou otázky z jiného soudku a na mnohé odpovědi si ještě počkáme. Dokonce by bylo s podivem, kdyby zde popsané mechanizmy znamenaly definitivní odhalení tajemství kmenových buněk. Moudrá příroda je totiž stále o krok před námi a vždy si nechává další tajemství, kterým stimuluje naši touhu po poznání, podobně jako růstové faktory stimulují své cílové receptory. Jisté však je, že pokrok v objasnění mechanizmů účinku růstových faktorů, transkripčních faktorů a bílkovin rodiny Polycomb na kmenovost lidských embryonálních kmenových buněk posouvá hranici lidského poznání o kus dopředu.Je zřejmé, že to budou pravděpodobně tyto tři mechanizmy, jejichž znalost přispěje k poznání zákonitostí vývoje člověka na molekulární úrovni. Navíc budou zásadní pro netrpělivě očekávané použití lidských embryonálních kmenových buněk v buněčných terapiích i pro vyloučení rizik, například tvorby nádorů. Z tohoto pohledu je bádání v zmíněné oblasti jednou z priorit biomedicínských věd.
Aktuální poznámka na závěr
Neuvěřitelné rychlý vědecký pokrok přinesl v těchto dnech další objev. Ten pravděpodobně vysvětluje zmíněné překvapivé rozdíly v aktivitách různých růstových faktorů u myších a lidských embryonálních kmenových buněk, což diskriminovalo myší buňky jako model pro buněčné terapie. Nedávno ale tým okolo Richarda Gardnera z Oxfordu a Ronalda McKaye z Bethesdy objevil, že embryonální kmenové buňky získané z pozdějšího stadia myších embryí (z tzv. epiblastu, který se vyvíjí z vnitřní buněčné masy blastocyst až po jejich zachycení v děložní stěně) mají ve vztahu k růstovým faktorům velmi podobný vztah jako lidské embryonální kmenové buňky. Tímto objevem, publikovaným v časopise Nature (doi: 10.1038/nature05972), se myší embryonální kmenové buňky stávají po několikaleté přestávce znovu ideálním modelem budoucího použití lidských embryonálních kmenových buněk v klinické medicíně.Poznámky
Ke stažení
 článek ve formátu pdf [346,59 kB]
článek ve formátu pdf [346,59 kB]

























