Rezistence na antibiotika trochu jinak
Rezistence na antibiotika, proč ale jinak? Prostě proto, že v tomto článku nepůjde o názor lékařského mikrobiologa, ale o pohled mikrobiologa obecného, se sklonem k molekulární biologii.
Zpočátku byla antibiotika pokládána za zázračné látky, zdálo se, že jsou neporazitelná. Později jsme k nim ztratili úctu. Mnozí z nás nevědomky přispěli k nadměrnému používání antibiotik, aniž při tom mysleli na nedozírné důsledky, vedoucí k rezistenci bakterií vůči antibiotikům. Čím více antibiotik se užívá, tím více bakterií je k nim rezistentních (viz Vesmír 78, 27, 1999/1). Není nutné přestat je užívat úplně, ale měla by se předepisovat pouze tehdy, když je to nezbytné.
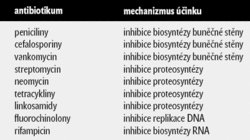
Co jsou antibiotika? Látky, které buď zastavují růst bakterií, nebo je zabíjejí. Známe i jiné látky zabíjející bakterie (rtuť, arzen), ty však zabíjejí i člověka. Antibiotika jsou skvělá tím, že většinou působí jen na mikroorganizmy a ne na jejich hostitele, ať už jsou to rostliny nebo živočichové. Antibiotika dnes můžeme dělit podle mechanizmů účinku (viz tab. I) na látky, které:
- potlačují biosyntézu buněčné stěny bakterií (peniciliny, cefalosporiny a vankomycin, antibiotikum „poslední volby“),
- potlačují bakteriální proteosyntézu (streptomycin, neomycin, tetracyklin, klindamycin a další),
- vzájemně se „perou“ s replikací DNA (fluorochinolony),
- potlačují biosyntézu RNA (rifampicin),
- potlačují produkci esenciálního vitaminu tetrahydrolistové kyseliny tím, že jsou chemickou strukturou podobné meziproduktům metabolické dráhy kyseliny tetrahydrolistové (sulfonamidy, trimethoprim) .
Během mnohaletého používání antibiotik jako léčiv infekcí vyvinuly bakterie různé typy rezistence:
Primární rezistence je dána druhem bakterie a jeho vlastnostmi. Gramnegativní bakterie jsou obvykle podstatně méně citlivé na penicilin a další ß-laktamy než bakterie grampozitivní. Jako příklad příležitostného patogenu může sloužit Pseudomonas aeruginosa. Většina kmenů této bakterie byla vůči antibiotikům rezistentní dříve, než se antibiotika začala používat masově.
Získaná rezistence může být jednoduchá nebo vícenásobná. Vzniká jako důsledek mutací či různých genetických přenosů. Bakterie, která byla původně citlivá, přestane na antibiotikum (popř. více antibiotik) reagovat. Získaná rezistence představuje z hlediska léčby infekčních nemocí závažný problém.
Základní mechanizmy rezistence vůči antibiotikům je možno charakterizovat takto:
- Mění se průchodnost buněčných obalů bakterie, takže antibiotikum do bakteriální buňky neproniká.
- Specifické bakteriální enzymy rozkládají nebo obměňují chemickou strukturu antibiotika buď před vstupem, nebo uvnitř bakteriální buňky.
- Antibiotikum je aktivně vypuzováno z buňky specifickými transportními systémy.
- Zásahové místo pro antibiotikum v buňce se mění a antibiotikum se již k němu neváže.
Je rezistence na antibiotika překvapivá?
Rychlost, s jakou bakterie získaly rezistenci vůči antibiotikům, by nás neměla příliš překvapovat. Přizpůsobivost bakterií je totiž obrovská, jejich růst je velmi rychlý a populace bakterií obsahují obrovská množství jedinců (běžně 109 v 1 ml bakteriální kultury, popř. více), což poskytuje znamenité možnosti pro vznik rezistence na základě mutací. Navíc bakterie byly jednou z prvních forem života na Zemi a vládly na ní více než 3 miliardy let před objevením rostlin a živočichů. Během tohoto období osídlily bakterie každou část planety Země včetně nejhlubších moří a nejvyšších hor. Nacházíme je pod ledem Arktidy a Antarktidy, v horkých pramenech, v jaderných odpadech a hluboko v půdě. Přečkaly vulkanické období v časné historii Země a všechny výkyvy teplot od doby ledové po skleníkovou atmosféru. Antibiotika jsou na vývojové cestě bakterií pouze drobnou překážkou, krátkou epizodou, se kterou se dokážou snadno vyrovnat. Jaképak tedy překvapení!Mikroorganizmy a lidé
 Při sčítání všech buněk v našem těle bychom zjistili, že většina z nich jsou buňky mikrobní (je jich asi desetkrát více než lidských). Nacházíme je všude, na očích, v ústech, v nose a uších i na celém povrchu kůže. Odhaduje se, že v jednom gramu obsahu lidského střeva je 1012 bakterií (viz Vesmír 84, 710, 2005/12) a celkem se v našich střevech nachází více než 100 bilionů (1014) různých mikroorganizmů. Ve skutečnosti jsme chodící sbírkou mikrobních druhů. Co tedy vlastně znamená být člověkem? Některé chemické sloučeniny v našem těle určitě nemůžeme nazývat lidskými. Naše DNA je sice „lidská“, ale máme mnoho genů identických s jinými živočichy. Jestliže počítáme mikroorganizmy, můžeme se oprávněně domnívat, že většina genetické informace, kterou nosíme, je jiná než naše vlastní.
Při sčítání všech buněk v našem těle bychom zjistili, že většina z nich jsou buňky mikrobní (je jich asi desetkrát více než lidských). Nacházíme je všude, na očích, v ústech, v nose a uších i na celém povrchu kůže. Odhaduje se, že v jednom gramu obsahu lidského střeva je 1012 bakterií (viz Vesmír 84, 710, 2005/12) a celkem se v našich střevech nachází více než 100 bilionů (1014) různých mikroorganizmů. Ve skutečnosti jsme chodící sbírkou mikrobních druhů. Co tedy vlastně znamená být člověkem? Některé chemické sloučeniny v našem těle určitě nemůžeme nazývat lidskými. Naše DNA je sice „lidská“, ale máme mnoho genů identických s jinými živočichy. Jestliže počítáme mikroorganizmy, můžeme se oprávněně domnívat, že většina genetické informace, kterou nosíme, je jiná než naše vlastní.
Většinu mikrobů, kteří nás osídlují, neznáme. Často jsme totiž nepřišli na to, jak bychom je mohli kultivovat. Pomocí polymerázové řetězové reakce však dokážeme namnožit úseky DNA a na základě jejich analýzy můžeme dojít k závěru, že každý z nás je hostitelem 500–1000 druhů mikroorganizmů s více než 8000 poddruhy. Toto osídlení se však liší od člověka k člověku a může sloužit v jistém smyslu podobně jako lidské otisky prstů.
Jsou bakterie nepřítelem člověka?
Představa, že se zbavíme všech bakterií a tím odstraníme infekci, je nejen naivní, ale i sebevražedná. Bakterie a mikroorganizmy jsou na Zemi všudypřítomné. Nacházíme je ve vzduchu, ve vodě, v půdě, na zvířatech či rostlinách a také na povrchu dalších mikroorganizmů. Počty mikroorganizmů, které na Zemi existují zcela zřetelně, dalece převyšují počty zvířat a rostlin. Jeden gram zahradní půdy obsahuje zhruba mezi 10 a 20 miliony bakterií, 1 milion hub, 50 000 řas a 30 000 prvoků (viz Vesmír 85, 212, 2006/4 a 85, 284, 2006/5). Mezi mikroorganizmy představují jen samotné bakterie asi polovinu živé hmoty na Zemi. Některé mikroorganizmy způsobují nebezpečná onemocnění (člověka, domácích zvířat, zemědělských plodin), jiné jsou nesmírně prospěšné a používají se v nejrůznějších tradičních i moderních průmyslových výrobách. Půdní a vodní mikroorganizmy jsou významnými účastníky přírodních cyklů, ve kterých rozkládají organické materiály na živiny využitelné jinými organizmy. Stručně řečeno, bez mikroorganizmů by život na Zemi nebyl možný.Kdo může za to, že si bakterie na antibiotika zvyknou?
 Není pochyb o tom, že za rezistenci bakterií a dalších mikroorganizmů vůči antibiotikům může do jisté míry člověk sám. Někdy bývá příčinou nesprávná diagnóza – předepsané antibiotikum neúčinkuje prostě proto, že původce nemoci není na toto antibiotikum citlivý. Neníli infekce způsobena bakterií, ale virem nebo houbou, antibiotikum nejspíše účinné nebude. Mám ale na mysli spíše případy, kdy je zaměněn původce choroby. Například většina infekcí močového traktu je způsobena bakteriemi, některé jsou však způsobeny kvasinkou Candida albicans (vyskytují se u pacientů s katétry v močových cestách nebo u pacientů se sníženou imunitní reakcí). Podobně infekce plic nebo genitálního traktu bývají obvykle způsobeny bakteriemi, ale někdy také houbami či prvoky, proti nimž předepsaná antibiotika zpravidla nepomáhají. K nerozvážnému použití antibiotika mohou vést rovněž neúplné znalosti – například některá antibiotika neprocházejí membránami, které pokrývají mozek a míchu a oddělují míšní tekutinu od krve, a nemohou tedy pomoci pacientovi s meningitidou, který má bakterie v mozkomíšním moku. Někdy přispívají k vzniku rezistence sami pacienti tím, že nedodržují léčebný režim. Často přestanou antibiotikum užívat ihned, jakmile se jejich zdravotní stav zlepší. Bakterie (dosud živé) se vzpamatují a obnoví svou aktivitu. To platí zejména pro pacienty s tuberkulózou, kteří musí pravidelně užívat několik léků. Pokud nedodržují léčebný režim, v jejich plicích mohou přežívat aktivní bakterie, a navíc snížená hladina antibiotik může v plicích selektovat bakterie rezistentní.
Není pochyb o tom, že za rezistenci bakterií a dalších mikroorganizmů vůči antibiotikům může do jisté míry člověk sám. Někdy bývá příčinou nesprávná diagnóza – předepsané antibiotikum neúčinkuje prostě proto, že původce nemoci není na toto antibiotikum citlivý. Neníli infekce způsobena bakterií, ale virem nebo houbou, antibiotikum nejspíše účinné nebude. Mám ale na mysli spíše případy, kdy je zaměněn původce choroby. Například většina infekcí močového traktu je způsobena bakteriemi, některé jsou však způsobeny kvasinkou Candida albicans (vyskytují se u pacientů s katétry v močových cestách nebo u pacientů se sníženou imunitní reakcí). Podobně infekce plic nebo genitálního traktu bývají obvykle způsobeny bakteriemi, ale někdy také houbami či prvoky, proti nimž předepsaná antibiotika zpravidla nepomáhají. K nerozvážnému použití antibiotika mohou vést rovněž neúplné znalosti – například některá antibiotika neprocházejí membránami, které pokrývají mozek a míchu a oddělují míšní tekutinu od krve, a nemohou tedy pomoci pacientovi s meningitidou, který má bakterie v mozkomíšním moku. Někdy přispívají k vzniku rezistence sami pacienti tím, že nedodržují léčebný režim. Často přestanou antibiotikum užívat ihned, jakmile se jejich zdravotní stav zlepší. Bakterie (dosud živé) se vzpamatují a obnoví svou aktivitu. To platí zejména pro pacienty s tuberkulózou, kteří musí pravidelně užívat několik léků. Pokud nedodržují léčebný režim, v jejich plicích mohou přežívat aktivní bakterie, a navíc snížená hladina antibiotik může v plicích selektovat bakterie rezistentní.
Antibiotika v zemědělství
Dlouho se antibiotika používala – a někdy ještě používají – v živočišné výrobě při léčení nemocných zvířat, při předcházení infekčním onemocněním a k povzbuzení růstu. Růstové účinky však nebyly plně vysvětleny. Dosahované zvýšení váhy zemědělských zvířat se obvykle pohybovalo v rozmezí 4–5 %, což se může zdát málo, ale v zemědělství to představuje významný rozdíl. K předcházení nemocem se v zemědělství dlouho používala běžná antibiotika (aminoglykosidy, ß-laktamy, makrolidy, fluorochinolony, sulfonamidy a tetracykliny), z nichž některá fungují také jako růstové stimulátory. Všechny tyto látky se používají i v humánní medicíně. Navíc jsou některá zemědělská antibiotika odpovědná za křížovou rezistenci s preparáty užívanými v humánní medicíně (např. avoparcin s vankomycinem, tylosin s erytromycinem, viz obrázek). Hlavní problém je však možno vidět v tom, že rezistentní bakterie selektované u živočichů mohou přecházet s potravou do lidského těla. Je třeba mít na paměti, že lidem, kteří mají v gastrointestinálním traktu bakteriální populaci s vysokou koncentrací bakterií rezistentních na antibiotika, hrozí podstatně vyšší riziko pooperačních infekcí, které se obtížně léčí. Rozsah tohoto rizika není úplně jasný, protože si nikdo nedovolí kolonizovat značnou část lidské populace rezistentními bakteriemi, aby si ověřil, jak situace skutečně vypadá. Pokusy tohoto typu se však provádějí na zvířecích modelech. Letos začátkem roku vstoupil v platnost zákaz Evropské unie užívat antibiotika k povzbuzení růstu zemědělských zvířat. Jde o poslední antibiotika, která se jako růstové stimulátory používala či používají, jmenovitě monensin u hovězího dobytka, salinomycin u prasat a selat, avilamycin u selat, prasat, kuřat a krocanů nebo flavofosfolipol (flavomycin) u králíků, nosnic, kuřat, krocanů, prasat, telat a hovězího dobytka.Antibiotika všudypřítomná
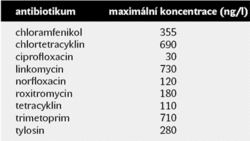
 Existují práce, ve kterých byly stanovovány kontaminující látky v čistírnách odpadních vod a v povrchových vodách obecně (viz tab. II). Obvykle se v těchto studiích používá vysokoúčinná kapalinová chromatografie, po níž následuje hmotová spektrometrie a nukleární magnetická rezonance. Kromě řady jiných léčiv včetně hormonů, analgetik či ß-blokátorů byla prokázána antibiotika chloramfenikol, chlortetracyklin, ciprofloxacin, linkomycin, norfloxacin, oxytetracyklin, tetracyklin, tylosin, avermektin aj. Většina antibiotik je poměrně stabilní a v přírodě se rozkládají pomalu a neochotně. Je třeba se smířit se skutečností, že antibiotika mohou vycházet v nezměněné podobě z čistíren odpadních vod či jiného odpadního materiálu a dostávat se do zdrojů pitné vody. Zatím nevíme, jaké důsledky může mít přeměna pitné vody nebo zdrojové čisté vody na zředěný roztok různých chemikálií včetně antibiotik. V každém případě je třeba se tím zabývat.
Existují práce, ve kterých byly stanovovány kontaminující látky v čistírnách odpadních vod a v povrchových vodách obecně (viz tab. II). Obvykle se v těchto studiích používá vysokoúčinná kapalinová chromatografie, po níž následuje hmotová spektrometrie a nukleární magnetická rezonance. Kromě řady jiných léčiv včetně hormonů, analgetik či ß-blokátorů byla prokázána antibiotika chloramfenikol, chlortetracyklin, ciprofloxacin, linkomycin, norfloxacin, oxytetracyklin, tetracyklin, tylosin, avermektin aj. Většina antibiotik je poměrně stabilní a v přírodě se rozkládají pomalu a neochotně. Je třeba se smířit se skutečností, že antibiotika mohou vycházet v nezměněné podobě z čistíren odpadních vod či jiného odpadního materiálu a dostávat se do zdrojů pitné vody. Zatím nevíme, jaké důsledky může mít přeměna pitné vody nebo zdrojové čisté vody na zředěný roztok různých chemikálií včetně antibiotik. V každém případě je třeba se tím zabývat.
Kde se vzaly geny kódující rezistenci vůči antibiotikům?
Geny kódující rezistenci se obvykle blízce podobají esenciálním, životně důležitým bakteriálním genům, které kódují základní biosyntetické funkce, jako jsou biosyntéza bakteriální buněčné stěny nebo proteosyntéza. Zdá se, že rezistenční geny vznikly mutací těchto genů a brání bakterie před antibiotiky, jejichž zásahovým místem jsou produkty takových esenciálních genů. Nejpřekvapivější je, že alespoň některé geny rezistence na antibiotika byly v bakteriích přítomny dávno předtím, než lidstvo antibiotika objevilo. (Podařilo se to prokázat u sbírkových kmenů z období mezi první a druhou světovou válkou.) To je důležité – většinou se totiž pokládalo za prokázané, že až používání antibiotik vedlo k vývoji rezistentních kmenů bakterií. Jsme tedy za vznik rezistence odpovědní pouze částečně. I když je zřejmé, že nadměrné používání antibiotik k výskytu rezistentních kmenů bakterií přispívá, nevíme, jaké další selekční tlaky tu působí. Kdysi se to vykládalo tak, že rezistenční geny bakterií existující před použitím antibiotik měly význam jako bojová výbava mikrobů. Předpokládalo se, že bakterie a houby užívají antibiotika, aby si vyčistily své okolí od jiných mikroorganizmů, a tím umožnily producentům antibiotik využívat živiny v prostředí. Ve skutečnosti zatím nikdo spolehlivě nestanovil antibiotika v půdě, kde jejich producenti obvykle žijí, nejspíš proto, že koncentrace antibiotik jsou velmi nízké. Většinu producentů antibiotik je třeba nejdřív vystavit mutagenezi, pak teprve produkují antibiotika v zjistitelné koncentraci. Kdyby antibiotika skutečně sloužila jako válečná zbraň, museli by jejich producenti ve svém okolí potlačit své konkurenty a být na takových místech sami samojediní. Tak tomu ale většinou není. Nebo bychom mohli předpokládat, že bakterie produkující antibiotika nesou rezistenční geny proti vlastním antibiotikům. Houby produkující antibiotika takovou ochranu nepotřebují, protože eukaryotické organizmy bývají většinou vůči antibiotikům necitlivé. Navíc některé bakterie, které antibiotika neprodukují, nesou rezistenční geny. Docela pravděpodobná se zdá být hypotéza, že produkce antibiotik představuje mechanizmus, jímž se mikroorganizmy zbavují toxických látek hromadících se na konci růstové fáze a na začátku fáze stacionární. Mezi takové látky patří organické kyseliny (např. octová), které slouží jako prekurzory při biosyntéze antibiotik. Uvažuje se také o možnosti, že antibiotika jsou vlastně signální molekuly. Pro tuto hypotézu ale není dost experimentálních dokladů. Znovu se musíme ptát, zda užívání antibiotik funguje jako jediný selekční tlak vedoucí k rezistenci vůči nim.Rezistence producentů vůči vlastním antibiotikům
Už dlouho je známo, že producenti antibiotik jsou vůči vlastním produktům rezistentní. Vykazují mnoho různých typů rezistence, převládá však rezistence sekreční. V. M. D’Costová a její spolupracovníci v laboratoři Gerryho Wrighta publikovali nedávno výsledky svých pokusů, ve kterých izolovali 480 morfologicky odlišných sporulujících mikroorganizmů z půdy a testovali u nich nikoli antibiotickou aktivitu (jak se to obvykle dělá), ale rezistenci vůči existujícím antibiotikům. Zjistili, že každý z těchto izolovaných mikroorganizmů byl rezistentní nejméně k šesti až osmi antibakteriálním látkám a mnohé z nich až k dvanácti. Soubor testovaných antibiotik zahrnoval jak dobře zavedené, tak nedávno vyvinuté látky, přírodní sloučeniny, semisyntetické i zcela syntetické látky. Mikroorganizmy izolované D’Costovou patří všechny do rodu Streptomyces, produkujícího více než polovinu známých antibiotik. Studovaných 480 izolátů nejen nejspíše zahrnuje producenty antibiotik, ale hlavně má rezistenční mechanizmy, které je brání před sebevraždou. Práce ukázala vysoký rezistenční potenciál půdních mikroorganizmů. Není to zase tak překvapivé, protože velká většina producentů antibiotik byla izolována z půdy, a musí tedy rezistenční mechanizmy mít. Výskyt vysoké rezistence vůči běžným a dosud velmi účinným antibiotikům stejně jako vůči látkám schváleným teprve nedávno je však podivuhodný. Za pozornost stojí, že nebyla ušetřena žádná skupina antibiotik s různorodými zásahovými místy. I když v práci nebyl prokázán přímý přenos rezistenčních genů z půdního „rezistomu“ na patogenní bakterie, ukazuje se, že v půdě je výskyt rezistence neočekávaně vysoký. Bude však patrně ještě vyšší, než bylo prokázáno, a to proto, že v této práci byly studovány pouze sporulující bakterie, což je jen zlomek bakterií, které půdu obývají. Navíc se v půdě nepochybně vyskytují ještě bakterie, které není možné kultivovat, ale jejichž existence byla prokázána molekulárněbiologickými metodami. Stálo by za to zjistit, zda také studované izoláty mikroorganizmů produkují antibiotika, popř. směsi antibiotik, a jestli tedy k rezistenci vůči takovým antibiotikům nejsou předurčeny, aby byly chráněny před sebevraždou.Přenos rezistence
Antibiotika se vážou a zbavují aktivity důležitá zásahová místa, kde jsou např. enzymy katalyzující biosyntézu bakteriální buněčné stěny nebo ribozomy, na kterých se syntetizují proteiny. Tím, že se zásahové místo mění mutací, stává se bakterie k danému antibiotiku rezistentní. Taková mutační strategie však může být pro bakteriální buňku nebezpečná. Výše popsané změny důležitých buněčných procesů mohou vést k tomu, že bakteriální buňka umírá nebo je vážně poškozena. Co je tedy z hlediska perspektivy bakteriální buňky rozumné? Získat rezistenční úseky DNA od jiné bakterie, kde se po velkém úsilí již vyvinuly za cenu smrti velkého množství bakteriálních buněk v populaci. Bakterie mohou jedna od druhé takovou DNA získávat konjugací (přenosem DNA založeným na přímém kontaktu dvou buněk), transformací (přímým příjmem DNA z prostředí) a transdukcí (přenosem DNA pomocí bakteriofága). Konjugace je zřejmě hlavní proces, který odpovídá za přenos rezistenčních genů u bakterií, zejména za přenos mezi různými druhy a rody. Nově získaný úsek DNA zřídkakdy představuje pro příjemcovu buňku skutečnou hrozbu. I když to na začátku může pro buňku být energeticky náročné, je téměř vyloučeno, že by takový proces byl pro buňku smrtící. V nejhorším případě se získaný gen na začátku nepřepisuje, a tak vlastně nepřináší žádný užitek. To může bakterie napravit tím, že získá mutace v promotorové oblasti takového genu, které pak „kontrolují“, zda se vytvoří kopie informační RNA (mRNA), která se překládá do struktury rezistenčního proteinu. Takové mutace v cizím genu mohou těžko ovlivnit životaschopnost bakterie, protože ovlivňují expresi potenciálně prospěšného genu.Máme se vrátit do období, kdy ještě antibiotika neexistovala?
Určitě ne. Mohli bychom se potom ptát, zda máme vůbec používat chemoterapeutika, a navíc i antiseptické a dezinfekční látky. I když už existují kmeny bakterií, jež jsou rezistentní ke kterémukoli antibiotiku, zatím jsou v naprosté menšině. Většina bakterií (Streptococcus pyogenes, Chlamydia trachomatis, Treponema pallidum aj.) je dosud citlivá na většinu antibiotik a rezistenci vyvíjejí jen výjimečně. Stálo by za to studovat důvody, proč právě tyto bakterie zůstávají vůči antibiotikům citlivé. I když jsou některé druhy bakterií rezistentní, existují stále jejich kmeny, které jsou citlivé. Výzkumu a vývoji nových antimikrobiálních látek je třeba neustále věnovat pozornost. Kdybychom se bývali rozhodli již (dejme tomu) v šedesátých letech minulého století, že takové látky nebudeme vyvíjet a vystačíme s první generací penicilinů a tetracyklinů, byli bychom měli závažné potíže s mikrobiálními infekcemi mnohem dříve. Přitom je třeba mít na paměti, že infekční nemoci jsou mezi příčinami úmrtí v bohatém světě na třetím místě a ve světě rozvojovém na druhém (s tendencí získat neblahé prvenství).Může se stát, že antibiotika, která používáme dnes, přestanou působit a že se výzkum antibiotik dostane opět do popředí výzkumných institucí i farmaceutického průmyslu. Bude totiž nejen společensky nezbytný, ale pro farmaceutický průmysl znovu i ekonomicky prospěšný. Jinak by mohla nastat situace, že si nebudeme vědět rady s novými, ale ani se známými infekcemi, které se začínají projevovat s novou vehemencí v důsledku toho, že jsou jejich původci rezistentní na antibiotika.
Literatura
D’Costa V. M., McGrann K. M., Hughes D. W., Wright G. D.: Sampling the Antibiotic Resistome, Science 311, 374–377, 2006Hořejší V.: Střevní bakterie a imunitní systém. Od vyprávění o jogurtu k molekulární podstatě, Vesmír 12, 710, 2005
Ke stažení
 článek v souboru pdf [359,75 kB]
článek v souboru pdf [359,75 kB]

























