Spořivé geny a diabetes 2. typu
Jídlo je tak obecná a rozšířená činnost, že zapomínáme na jeho význam. Prvotní hnací síla všech živočichů je nutnost opatřit si vhodnou potravu v dostatečném množství. Ch. Elton, 1935
 Počet lidí, u nichž byl zjištěn diabetes (cukrovka) 2. typu, během posledních dvou desetiletí ve světě nebývale vzrostl. Tímto onemocněním trpí celkem přes 100 milionů lidí, v roce 2010 jich má být 220 milionů a v roce 2025 až 300 milionů. 1) Zhoršené využívání glukózy, jímž tato nemoc sužuje pacienta, je součástí širšího spektra metabolických poruch – tzv. metabolického syndromu. Skutečnost, že se rizikové faktory onemocnění často vyskytují souběžně, je sice známa už od r. 1923, ale termín metabolický syndrom zavedl až v roce 1988 Gerald Reaven. Kromě poruch ve využívání glukózy může tento syndrom zahrnovat zvýšenou koncentraci inzulinu v krvi, poruchu ve složení krevních tuků, vysoký krevní tlak, obezitu a jiné poruchy (viz rámeček 1 ). Metabolický syndrom bývá přirovnáván k plovoucímu ledovci, z nějž je vidět pouze vrchol (vysokou hladinu glukózy v krvi), zatímco jeho větší část (další rizikové faktory onemocnění srdce a cév) zůstává pod vodou (obrázek). Lidé s metabolickým syndromem jsou vzhledem k několika rizikovým faktorům vystaveni většímu riziku rozvoje nejen diabetu 2. typu, ale i aterosklerózy a komplikací, které jsou s ní spojeny.
Počet lidí, u nichž byl zjištěn diabetes (cukrovka) 2. typu, během posledních dvou desetiletí ve světě nebývale vzrostl. Tímto onemocněním trpí celkem přes 100 milionů lidí, v roce 2010 jich má být 220 milionů a v roce 2025 až 300 milionů. 1) Zhoršené využívání glukózy, jímž tato nemoc sužuje pacienta, je součástí širšího spektra metabolických poruch – tzv. metabolického syndromu. Skutečnost, že se rizikové faktory onemocnění často vyskytují souběžně, je sice známa už od r. 1923, ale termín metabolický syndrom zavedl až v roce 1988 Gerald Reaven. Kromě poruch ve využívání glukózy může tento syndrom zahrnovat zvýšenou koncentraci inzulinu v krvi, poruchu ve složení krevních tuků, vysoký krevní tlak, obezitu a jiné poruchy (viz rámeček 1 ). Metabolický syndrom bývá přirovnáván k plovoucímu ledovci, z nějž je vidět pouze vrchol (vysokou hladinu glukózy v krvi), zatímco jeho větší část (další rizikové faktory onemocnění srdce a cév) zůstává pod vodou (obrázek). Lidé s metabolickým syndromem jsou vzhledem k několika rizikovým faktorům vystaveni většímu riziku rozvoje nejen diabetu 2. typu, ale i aterosklerózy a komplikací, které jsou s ní spojeny.
Epidemiologické studie a analýzy zvířecích modelů prokázaly, že souběžný výskyt více rizikových faktorů pro vznik diabetu 2. typu podmiňují významným způsobem genetické faktory. Dědičnost metabolického syndromu nebyla dosud stanovena, avšak je již znám podíl genetických faktorů, které podmiňují jednotlivé metabolické a hemodynamické znaky. Značný je například podíl genetických faktorů podmiňujících obezitu, využívání glukózy, koncentraci inzulinu v krvi, výšku krevního tlaku apod. Na první pohled se může zdát, že snad ani není možné, aby byl vzrůstající výskyt metabolického syndromu do značné míry podmíněn geneticky. Jak to vysvětlíme? Logicky bychom přece očekávali, že v důsledku selekce bude výskyt takových nevýhodných genů klesat.
Vysvětlit tento paradox se před více než 40 lety pokusil James V. Neel, tvůrce hypotézy spořivého genotypu (obrázek): Po mnoho tisíc let byli naši předkové závislí na lovu zvěře a sběru plodin. Za potravu sice na rozdíl od nás nemuseli platit penězi, ale její přísun byl nejistý, zvláště v nepříznivém ročním období. Bylo proto výhodné mít energii nastřádanou v tukových zásobách. Podle Neelovy hypotézy přežili naši předkové časté hladovění jen díky tomu, že uměli účelně využívat potravu. Jakmile jim po jídle stoupla hladina glukózy v krvi, začala jejich slinivka břišní rychle produkovat inzulin, který pomáhal ukládání přijatých živin v tukové tkáni, a tak efektivně hromadili energii. Taková schopnost byla obrovskou výhodou umožňující přežít období nedostatku potravy a geny, které ji podmiňovaly, se proto v populaci šířily. Naproti tomu v moderních civilizacích, kde většina lidí přijímá nadbytek potravy a vyvíjí malou fyzickou aktivitu, vede šetření energií (spořivý genotyp) k obezitě, k poruchám využití glukózy ve tkáních, a posléze k poškození beta-buněk v Langerhansových ostrůvcích slinivky břišní. Poškozené beta-buňky pak už inzulin nemohou produkovat v dostatečné míře.
Hypotézu spořivého genotypu obměnil Gerald Reaven, podle nějž nebylo pro naše předky nejdůležitější ukládat energii ve formě tuku, ale spíš si zachovat i přes období půstu co nejvíc svalové tkáně, která jim byla užitečná při lovu. Podle Reavenovy hypotézy není prvotní příčinou diabetu 2. typu zvýšená koncentrace inzulinu v krvi, ale nízká citlivost svalové tkáně k účinku inzulinu. Vrozená necitlivost k inzulinu ve svalech totiž snižuje využití glukózy svalovou tkání, takže glukóza pro centrální nervový systém nemusí být produkována přeměnou bílkovin svalové tkáně. Primární, geneticky podmíněná necitlivost svalové tkáně k inzulinu, která našim předkům pomáhala přežít období půstu, je však v moderních civilizacích nevýhodná. S věkem, obezitou a nedostatkem tělesné aktivity inzulinová rezistence vzrůstá, což nakonec vede k poškození beta-buněk ve slinivce břišní a končí diabetem 2. typu.
Spořivý genotyp je podmíněn spořivými geny. Patří k nim geny, které ovlivňují tělesnou hmotnost, rozmístění tukové tkáně, ukládání a uvolňování mastných kyselin, metabolizmus glukózy nebo citlivost tkání na účinky inzulinu. Mezi nejdůležitější dosud odhalené geny sloužící k úspoře energie patří Ppar-gama a Srebp1c kódující transkripční faktory nebo gen kódující hormon resistin.
reguluje tvorbu tukových buněk
Mezi nejvýznamnější objevy při léčbě diabetu 2. typu patří bezesporu odhalení nové skupiny orálně užívaných léků, tzv. thiazolidindionů, které zvyšují citlivost tkání k účinkům inzulinu. 2) Molekulární mechanizmy antidiabetických účinků objasnili r. 1995 Jürgen M. Lehman a jeho kolegové, kteří prokázali, že tyto léky aktivují jaderný hormonální receptor Ppar-gama (peroxisome proliferator activated receptor γ). Aktivovaný receptor utvoří komplex s receptorem vázajícím retinoidy (látky příbuzné vitaminu A), a pak se váže se specifickými sekvencemi DNA v regulačních oblastech cílových genů. Aktivita komplexu je regulována vazbou s thiazolidindionovými ligandy. Přirozené ligandy Ppar-gama (tedy látky, které jsou schopny vazby na jeho receptor) nebyly dosud plně odhaleny, ale pravděpodobně jde o deriváty mastných kyselin.Specifické sekvence pro vazbu Ppar-gama byly nalezeny v promotorech řady genů důležitých pro diferenciaci tukových buněk, tvorbu tukových zásob a metabolizmus tuků. Ppar-gama tak má ústřední postavení v regulaci tvorby nových tukových buněk, a je tedy jedním z hlavních spořivých genů. Mohlo by se zdát nelogické, že jsou léčebné účinky thiazolidindionů zprostředkovány aktivací Ppar-gama, a tím zvýšenou tvorbou tuku, protože obezita bývá spojována s nízkou citlivostí tkání k inzulinu a patří k hlavním rizikovým faktorům pro vznik diabetu 2. typu.
Jak tento paradox vysvětlíme? Po léčbě thiazolidindiony se tvoří nové tukové buňky – zvyšuje se počet malých, metabolicky aktivních tukových buněk a klesá počet velkých, metabolicky neaktivních. Tuková tkáň se „stěhuje“, vzrůstá podíl podkožního tuku na úkor tuku vnitřního (viscerálního). Taková tuková tkáň je metabolicky aktivnější a citlivější k účinkům inzulinu. V těchto buňkách inzulin účinněji potlačuje uvolňování matných kyselin do krve. Pokles koncentrace mastných kyselin by mohl být podmíněn i tím, že nové tukové buňky mají větší kapacitu pro transport mastných kyselin do tukových buněk v období příjmu potravy. Metabolicky aktivní tuková tkáň tak plní úlohu jakéhosi tlumiče, který zabraňuje nepříznivým účinkům vysokých koncentrací mastných kyselin například na svalovou tkáň. Přestože Ppar-gama patří mezi nejlépe charakterizované jaderné receptory, zůstává stále ještě mnoho nezodpovězených otázek. Především přesně neznáme jeho funkci ve zdravém organizmu. Navíc byla při léčbě diabetu 2. typu thiazolidindiony zjištěna řada nežádoucích vedlejších účinků, například zhoršení obezity.
ovlivňuje citlivost k inzulinu
Jaderný transkripční faktor Srebp1 (sterol regulatory element binding protein 1) reguluje metabolizmus cholesterolu, mastných kyselin a glukózy v játrech. Regulační oblasti cílových genů obsahují specifické sekvence dlouhé 10 párů bází, na které se protein Srebp1 váže. Gen Srebp1 má dva promotory (viz slovníček 2 ), které umožňují vznik dvou různých variant: Srebp1a s dlouhou transkripční doménou a Srebp1c s doménou kratší. Ve většině tkání převažuje forma Srebp1c a nedávno bylo prokázáno, že právě varianta Srebp1c má významnou úlohu při genetickém zprostředkování citlivosti k inzulinu. Funguje to tak, že inzulin zvýší expresi genu Srebp1c, který pak přivodí přepis (transkripci) řady genů důležitých pro metabolizmus glukózy a lipidů. Inzulin tedy reguluje tyto geny nepřímo, prostřednictvím Srebp1c. Vazebná místa pro Srebp1c byla nalezena v promotorech řady genů kódujících enzymy důležité pro štěpení glukózy a tvorbu tuků. Srebp1c signalizuje játrům dostatek sacharidů tím, že aktivuje enzym glukózkinázu, a umožňuje tak doplnit zásoby glykogenu v játrech. Navíc aktivuje geny pro tvorbu tuků, a tím nastartuje přeměnu glukózy na mastné kyseliny, které se pak ukládají do zásoby v tukové tkáni. Srebp1c tak funguje jako jeden z genů spořivého genomu. Izoforma Srebp1a hraje rovněž důležitou úlohu v regulaci metabolizmu tuků, například zvýšená transgenní exprese lidského Srebp1a v játrech potkana vyvolala zvýšenou produkci a ukládání tuků v jaterní tkáni, zatímco množství tukové tkáně bylo naopak sníženo.Resistin – pojítko mezi obezitou a diabetem 2. typu
Dalším z genů pro úsporný režim by mohl být gen kódující hormon sekretovaný tukovou tkání, který nedávno objevili Claire Steppanová a její kolegové. Dali mu název resistin, tj. podmiňující rezistenci k inzulinu. Koncentrace resistinu v séru byla významně vyšší u obézních diabetických myší a krom toho se zjistilo, že po intraperitoneální injekci resistinu do neobézních myší se rovněž zhorší využití glukózy a sníží citlivost tukové tkáně k účinkům inzulinu. Na základě těchto experimentů C. Steppanová a její kolegové přišli s myšlenkou, že právě resistin by mohl být pojítkem mezi obezitou a diabetem 2. typu. Obézní lidé mají v těle vyšší podíl tukové tkáně, a tedy vyšší koncentraci cirkulujícího resistinu. Resistin pak snižuje účinek inzulinu ve tkáních, a tím se v organizmu zhoršuje využití glukózy, což nakonec vyvolává diabetes 2. typu. Resistin tedy možná představuje chybějící článek mezi obezitou, neschopností přiměřeně reagovat na inzulin a diabetem 2. typu. V souladu s touto hypotézou jsme pozorovali, že zvýšená exprese myšího resistinu specificky v tukové tkáni vyvolala u transgenních potkanů diabetes 2. typu.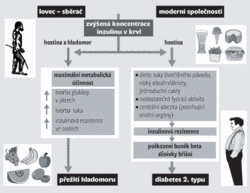 Mnoho otázek ale zůstává nezodpodvězeno. Co je receptorem pro resistin? Jakými mechanizmy resistin blokuje účinky inzulinu? A jaké má resistin fyziologické funkce? Naše pokusy prokázaly důležitou úlohu resistinu v regulaci metabolizmu glukózy ve svalech. Zdá se tedy, že resistin hlavně snižuje citlivost svalové tkáně k působení inzulinu. Je možné předpokládat, že mezi funkce resistinu v zdravém organizmu patří zachovat svalovou tkáň v období půstu (v souladu s Reavenovou modifikovanou hypotézou spořivého genotypu). Ppar-gama a Srebp1 by pak působily spíše jako geny pro efektivní akumulaci energie v tukové tkáni.
Mnoho otázek ale zůstává nezodpodvězeno. Co je receptorem pro resistin? Jakými mechanizmy resistin blokuje účinky inzulinu? A jaké má resistin fyziologické funkce? Naše pokusy prokázaly důležitou úlohu resistinu v regulaci metabolizmu glukózy ve svalech. Zdá se tedy, že resistin hlavně snižuje citlivost svalové tkáně k působení inzulinu. Je možné předpokládat, že mezi funkce resistinu v zdravém organizmu patří zachovat svalovou tkáň v období půstu (v souladu s Reavenovou modifikovanou hypotézou spořivého genotypu). Ppar-gama a Srebp1 by pak působily spíše jako geny pro efektivní akumulaci energie v tukové tkáni.
Který ze spořivých genů odpovídá za vznik metabolického syndromu?
Metabolický syndrom představuje propletenec vzájemných vztahů mezi mnoha genetickými faktory a faktory prostředí. Proto je obtížné zjistit, který z genů odpovědných za jednotlivé faktory může být spojován s dědičností metabolického syndromu.Jestliže transkripční faktor Ppar-gama, aktivovaný thiazolidindiony, zvyšuje citlivost tkání k inzulinu, neznamená to ještě, že nese odpovědnost za celý metabolický syndrom. Zatím je slibným kandidátem, ale jeho podíl na epidemii metabolického syndromu je třeba potvrdit genetickými analýzami. Popsáno již bylo několik jeho mutací: Vzácně se vyskytuje mutace Pro115Gln spojovaná se zvýšenou aktivitou Ppar-gama, s porušenou regulací diferenciace tukových buněk a s extrémní obezitou. Častější je mutace Pro12Ala související s vyšší tělesnou hmotností a sníženou citlivostí k inzulinu.
Srebp1c patří k nejdůležitějším genům při regulaci metabolizmu tuků a glukózy v játrech. Navíc zprostředkuje genomické účinky inzulinu, a proto jeho molekulární varianty, ovlivňující jeho funkci či expresi, skutečně mohou hrát důležitou úlohu v patogenezi metabolického syndromu. U lidí byly zjištěny asociace mezi genem Srebp1 a aterosklerózou i obezitou.
Úlohu resistinu při vzniku metabolického syndromu u lidí zatím nelze posoudit, neboť výsledky dosavadních studií jsou kontroverzní.
Metabolický syndrom v budoucnu
Praktičtí lékaři se často setkávají s pacienty trpícími nadváhou, vysokým krevním tlakem, poruchami metabolizmu tuků apod. Co mohou pacientům nabídnout? Doporučují jim cvičení a redukční diety, protože ideální tělesná hmotnost podporuje citlivost tkání k účinkům inzulinu. Pacient ale většinou nedokáže změnit životní styl. I když zhubne, sníženou hmotnost si neudrží. Je to ještě horší – střídání redukčních diet s návratem k hojnému jídlu aktivuje mechanizmy, jejichž cílem je obnovit tukové rezervy. Povzbuzuje úsporné geny k tvorbě nových tukových buněk. Podobně neúspěšné bývají diety, jejichž cílem je snížit koncentraci krevních lipidů. Lékařům nezbývá než usměrňovat jednotlivé metabolické poruchy specifickými léky. Dnes se dává přednost prevenci, k níž kromě omezování kouření patří léčba aspirinem, léky snižujícími vysoký tlak a hladinu lipidů v krvi. Do budoucna je ale třeba pro prevenci udělat mnohem víc – ovlivňovat dietu ve spolupráci s potravinářským průmyslem a systematicky zvyšovat fyzickou aktivitu například ve školách či na pracovištích.Poznámky
NEBOLI ÚPLAVICE CUKROVÁ (CUKROVKA)
Lat. diabetes vzniklo z ř. diabates – průchodný, od diabaino – procházím (dia- – skrze, baino – jdu). Choroba totiž způsobuje silný průtok moči. Lat. mellitus znamená medový, sladký. Diabetes je způsoben buď naprostým nedostatkem inzulinu, nebo jeho malou účinností. Podle toho se dělí na dva typy:Diabetes 1. typu je závislý na inzulinu (inzulin-dependentní), pacienti jsou zcela odkázáni na inzulinové injekce. Je pro něj charakteristický úplný nedostatek inzulinu v důsledku autoimunního poškození beta-buněk slinivky břišní. Vzniká častěji v mládí.
Diabetes 2. typu je na inzulinu nezávislý (non-inzulin-dependentní), pacientům nemusí být dodáván inzulin, ale musí jim být dietou nebo léky (antidiabetiky) upravovány zvýšené koncentrace glukózy v krvi. Pro tento typ diabetu je charakteristická inzulinová rezistence. Onemocnění se projevuje v dospělosti, obvykle po dosažení 40 let života. Při tomto onemocnění není inzulin schopen zajistit odpovídající využití glukózy ve tkáních, zejména ve svalech, játrech nebo tukové tkáni (odborně se tato porucha nazývá inzulinová rezistence). Glukóza se dostává do buněk v nedostatečné míře (buňky pak trpí nedostatkem energie), hromadí se v krvi a také se objevuje v moči. Strhává s sebou vodu, proto mívá nemocný neustále žízeň. Hladina glukózy v krvi stoupne nad normál (odborně se mluví o zhoršené toleranci ke glukóze) a slinivka břišní (pankreas) začne produkovat nadměrné množství inzulinu.
Metabolický syndrom lze definovat jako soubor metabolických poruch provázejících inzulinovou rezistenci, které významně zvyšují riziko rozvoje kardiovaskulárních chorob. Patří k nim vysoké hladiny sérového inzulinu a triglyceridů, pokles HDL cholesterolu, centrální obezita, diabetes 2. typu a vylučování albuminu močí (mikroalbuminurie). Podle Světové zdravotnické organizace je metabolický syndrom definován jako souběžný výskyt diabetu 2. typu či zhoršené tolerance ke glukóze, popř. inzulinové rezistence s alespoň dvěma z dalších rizikových faktorů, jako jsou hypertenze, obezita nebo poruchy lipidového metabolizmu, charakterizované vysokými koncentracemi triglyceridů a nízkým HDL cholesterolem v plazmě či mikroalbuminurií.
SLOVNÍČEK
exprese – označení aktivity genu a vyjádření informace, která je v něm obsaženafenotyp – pozorovatelný vzhled či vlastnosti jedince, které jsou výsledkem jeho dědičných vloh (genotypu) a působení prostředí
HDL – lipoprotein s vysokou hustotou; přenáší krví tuky, zejména cholesterol; podílí se na odstraňování cholesterolu z tkání
LDL – lipoprotein s nízkou hustotou; je spojen s vysokou koncentrací cholesterolu; urychluje aterosklerózu
ligand – látka (molekula, atom), která je schopna se vázat na buněčný receptor (na jinou molekulu)
mikroalbuminurie – přítomnost malého množství albuminu v moči, která u pacientů s cukrovkou může signalizovat počínající poškození ledvin
rezistence – (v tomto článku) necitlivost organizmu na určité látky, konkrétně na inzulin
transkripce – přepis dědičné informace z genu (z DNA) do komplementárního řetězce RNA
promotor – startovní sekvence nukleotidů v DNA při transkripci
Ke stažení
 článek ve formátu pdf [539,65 kB]
článek ve formátu pdf [539,65 kB]















