Terapie aidsu po dvaceti letech
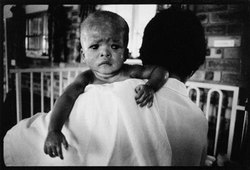
 V červnu 1981 bylo Centru pro kontrolu nemocí v Atlantě hlášeno 5 případů pneumocystové pneumonie u lidí, kteří byli do té doby zdrávi. Tak začala pandemie infekce HIV, která za dvacet let postihla bezmála 35 milionů lidí, více než polovinu z nich usmrtila, přes 13 milionů dětí připravila o rodiče a rozšířila se téměř do všech zemí světa. V České republice byl první případ infekce HIV zjištěn r. 1985 a do konce r. 2000 bylo diagnostikováno celkem 476 případů. U 148 osob se rozvinul aids a 89 nakažených zemřelo.
V červnu 1981 bylo Centru pro kontrolu nemocí v Atlantě hlášeno 5 případů pneumocystové pneumonie u lidí, kteří byli do té doby zdrávi. Tak začala pandemie infekce HIV, která za dvacet let postihla bezmála 35 milionů lidí, více než polovinu z nich usmrtila, přes 13 milionů dětí připravila o rodiče a rozšířila se téměř do všech zemí světa. V České republice byl první případ infekce HIV zjištěn r. 1985 a do konce r. 2000 bylo diagnostikováno celkem 476 případů. U 148 osob se rozvinul aids a 89 nakažených zemřelo.
Historie objevu této choroby a mechanizmu jejího šíření je z mnoha důvodů velmi zajímavá – dokumentuje ohromnou moc a efektivitu moderní vědy, její prorůstání s ekonomikou a politikou, ale současně i její slabost a nedokonalost. Příběh aidsu navíc fascinuje tím, že se týká snad největších hybatelů lidských dějin vůbec: sexu a smrti.
Už dva roky po ohlášení nové choroby byl identifikován její původce, nový lidský retrovirus HIV. Objevili ho nezávisle na sobě Luc Montagnier z Pasteurova ústavu v Paříži a Robert Gallo z Národního ústavu zdraví v Bethesdě. Spory o prvenství se táhly mnoho let a odrazily se i v nomenklatuře. Američané se inspirovali příbuzností s viry lidské leukemie dospělých (HTLV I a II) a nazvali smrtící virus HTLV III, francouzská skupina prosazovala název LAV (lymphadenopathy virus). Hořká bitva se neobešla bez patentových sporů, soudních procesů a osočování z krádeže vzorků. Vedle světové slávy šlo samozřejmě o patentová práva na diagnostické testy, které by bez izolace viru nebylo možno vyvinout. Po řadě obvinění a vyšetřování byl jediným postiženým slovenský postdoktorand Roberta Galla Mikuláš Popovič, první autor klíčových publikací americké skupiny v časopisu Science (1983). Po obvinění, že upravoval experimentální výsledky, musel z Bethesdy odejít. (Několik let pak strávil na slavném Karolinska Institutet ve Stock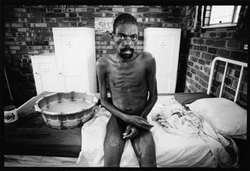 holmu a dnes již zas pracuje v Gallově týmu v USA.) Definitivní tečku za mnohaletými spory učinili až Jacques Chirac a Ronald Reagan, jejichž zásluhou byl r. 1987 objev prohlášen za společný a poplatky z příslušných patentů naplnily nově vytvořený fond pro výzkum a léčbu aidsu (viz rovněž Vesmír 65, 58, 1986/1 a Vesmír 67, 184, 1988/4).
holmu a dnes již zas pracuje v Gallově týmu v USA.) Definitivní tečku za mnohaletými spory učinili až Jacques Chirac a Ronald Reagan, jejichž zásluhou byl r. 1987 objev prohlášen za společný a poplatky z příslušných patentů naplnily nově vytvořený fond pro výzkum a léčbu aidsu (viz rovněž Vesmír 65, 58, 1986/1 a Vesmír 67, 184, 1988/4).
Životní cyklus viru HIV
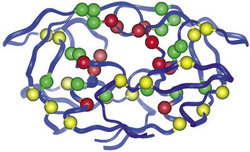
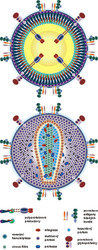
K vytvoření funkčního viru stačí patnáct proteinů a RNA. Sám virus (viz obrázek) patří mezi retroviry, jeho genetická informace je tedy zapsána do molekuly RNA (na rozdíl od všech ostatních organizmů od bakterie po macešku, které mají genetickou informaci zapsanou do DNA v souladu s centrálním dogmatem molekulární biologie).1)Pochopení životního cyklu viru je klíčem k návrhu možných léčiv, a tak se jeho detailní průběh stal jedním z nejstudovanějších dějů biologie v posledních dvaceti letech (viz tabulka). Virus rozezná specifické receptory na povrchu napadené buňky a vstoupí do ní. Pomocí reverzní transkriptázy přepíše svou genetickou informaci do dvoušroubovice DNA, která pak spolu s dalšími virovými proteiny odputuje do buněčného jádra, kde další virový enzym, integráza, nastřihne chromozomální DNA a vloží do ní nově vzniklou virovou DNA. Virus se tak v latentní podobě ukryje v genomu napadené buňky. Je nerozeznatelný od ostatní genetické informace hostitele a čeká na vhodný podnět k „probuzení“ (aktivaci). Mechanizmus aktivace není dosud přesně znám. Může jít o antigenní podnět, drobnou infekci, kterou nositel ani nezaznamená, která však spustí přepis virových genů. Při tomto procesu virus zcela spoléhá na aparát hostitelské buňky. Přesně podle učebnicových pouček se z integrované virové DNA přepisuje informační mRNA, a z ní pak na ribozomech vznikají příslušné virové proteiny.
 Retroviry (podobně jako řada dalších virů) mají tu zvláštní strategii, že své strukturní proteiny i replikační enzymy syntetizují ve formě dlouhých prekurzorů – virových polyproteinů. Ty mají ve svých molekulách „adresy“, které určují, kam bude nově připravená molekula dopravena. Virové polyproteiny, vzniklé přepisem genů HIV a translací na ribozomu, jsou adresovány plazmatické membráně, kde spolu s příslušnou RNA skládají novou virovou částici. Procesem přiléhavě nazvaným pučení se nově vzniklá částice z buňky uvolní. Je však nezralá a neinfekční, dokud nejsou dlouhé virové polyproteiny sestřihány do své konečné, funkční podoby (viz tabulka). Za tento krok odpovídá virový enzym proteáza (viz dále).
Retroviry (podobně jako řada dalších virů) mají tu zvláštní strategii, že své strukturní proteiny i replikační enzymy syntetizují ve formě dlouhých prekurzorů – virových polyproteinů. Ty mají ve svých molekulách „adresy“, které určují, kam bude nově připravená molekula dopravena. Virové polyproteiny, vzniklé přepisem genů HIV a translací na ribozomu, jsou adresovány plazmatické membráně, kde spolu s příslušnou RNA skládají novou virovou částici. Procesem přiléhavě nazvaným pučení se nově vzniklá částice z buňky uvolní. Je však nezralá a neinfekční, dokud nejsou dlouhé virové polyproteiny sestřihány do své konečné, funkční podoby (viz tabulka). Za tento krok odpovídá virový enzym proteáza (viz dále).
Hledání Achillovy paty viru
Léčení virových onemocnění je na rozdíl od většiny infekcí bakteriálního původu, které lze poměrně dobře léčit antibiotiky, dosti problematické. Téměř všechny látky, které jsou schopny blokovat replikaci viru, zároveň významně zasahují do metabolizmu hostitelské buňky. Jsou proto obvykle toxické a mohou buňky poškodit více než vlastní virová infekce. Rozdíly mezi toxickými a terapeutickými hladinami těchto látek jsou obvykle malé nebo žádné, jejich toxické účinky mohou být silnější než terapeutický přínos, a proto nemohou být využity v léčbě. Některé jiné látky, které jsou účinné na viry in vitro, nelze využít in vivo, protože jsou v organizmu nestabilní nebo špatně prostupují biologickými membránami. Z těchto důvodů bylo do praxe zatím zavedeno jen několik málo preparátů s antivirovým účinkem.Při terapii infekce HIV se lze teoreticky zaměřit na kterýkoli z kroků životního cyklu viru (viz tabulka): navázání viru k receptoru, fúzi s hostitelskou buňkou, reverzní transkripci (přepis genetické informace z virové RNA do DNA), transport DNA do jádra a její integraci do chromozomu prostřednictvím virové integrázy, replikaci virové DNA, transkripci a translaci, skládání virionu, jeho pučení a maturaci. V léčebné praxi pacientů s infekcí HIV se zatím používají hlavně inhibitory reverzní transkriptázy (blokující přepis virové RNA na DNA schopnou integrace do genomu) a inhibitory virové proteázy.
Inhibitory reverzní transkriptázy
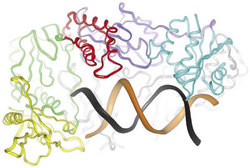
Tyto inhibitory jsou nejstarší, ale dosud základní skupinou antiretrovirových chemoterapeutik. Reverzní transkriptáza (obrázek) je velmi atraktivním cílem terapeutického zásahu: Ke kopírování celého virového genomu o 10 000 bázích RNA je zapotřebí přibližně 20 000 jednotlivých kroků, které musí být provedeny správně a v přesném pořadí. Zablokování jediného z nich replikaci viru zastaví. Principem účinku inhibitorů nukleosidového typu je to, že místo přirozených nukleosidů jsou reverzní transkriptáze nabídnuty báze „falešné“ – léky, které se sice do vznikajícího řetězce DNA včlení, ale zastaví prodlužování řetězce, a tím zablokují vznik funkční molekuly DNA. Prvním z této skupiny a stále základním antiretrovirovým preparátem je thymidinový analog zidovudin (viz Vesmír 74, 553, 1995/10), zavedený do praxe r. 1987. Byl syntetizován již r. 1964 a považoval se za nadějný protinádorový lék (inhibuje totiž DNA-polymerázu savčích buněk a tím likviduje rychle se dělící rakovinné buňky). V této indikaci se ale neosvědčil. Pro nemocné aidsem sice znamenal první zlepšení osudu, bylo to však zlepšení krátkodobé, léčba téměř neprodlužovala život. Pacienti trpěli množstvím závažných nežádoucích účinků – především útlumem krvetvorby, ale i postižením jater a ledvin. Na nátlak nemocných byl totiž zidovudin uvolněn pro praxi již v průběhu druhé fáze klinických studií, kdy se ukázaly první nadějné výsledky. Nebyly však ještě dost prozkoumány vlastnosti léku, a ten byl proto podáván v příliš vysokých dávkách. Trvalo potom ještě několik let, než se s ním lékaři naučili pracovat.
Prvním z této skupiny a stále základním antiretrovirovým preparátem je thymidinový analog zidovudin (viz Vesmír 74, 553, 1995/10), zavedený do praxe r. 1987. Byl syntetizován již r. 1964 a považoval se za nadějný protinádorový lék (inhibuje totiž DNA-polymerázu savčích buněk a tím likviduje rychle se dělící rakovinné buňky). V této indikaci se ale neosvědčil. Pro nemocné aidsem sice znamenal první zlepšení osudu, bylo to však zlepšení krátkodobé, léčba téměř neprodlužovala život. Pacienti trpěli množstvím závažných nežádoucích účinků – především útlumem krvetvorby, ale i postižením jater a ledvin. Na nátlak nemocných byl totiž zidovudin uvolněn pro praxi již v průběhu druhé fáze klinických studií, kdy se ukázaly první nadějné výsledky. Nebyly však ještě dost prozkoumány vlastnosti léku, a ten byl proto podáván v příliš vysokých dávkách. Trvalo potom ještě několik let, než se s ním lékaři naučili pracovat.
Dalším problémem antiretrovirové terapie byl poměrně rychlý vznik virové rezistence (viz rámeček). Brzy bylo zřejmé, že je potřeba podávat více preparátů, mezi nimiž nebude zkřížená rezistence a které budou mít odlišné spektrum nežádoucích účinků. Tato očekávání alespoň částečně splnily další léky této skupiny, které byly v prvé polovině devadesátých let rychle po sobě uvedeny do praxe – r. 1992 dideoxycytidin, r. 1993 dideoxyinosin, r. 1994 stavudin a r. 1995 lamivudin. Společné podávání těchto preparátů umožňovalo snížit jejich dávky, a tím také snížit výskyt nežádoucích účinků. Jestliže se tyto účinky přece jen dostaví, je možno přejít k jinému preparátu. Častý výskyt rezistence se ovšem ani kombinovaným podáváním odstranit nepodařilo – mezi preparáty téže skupiny je bohužel výskyt zkřížené rezistence příliš častý.
 V druhé polovině devadesátých let byly do praxe zavedeny některé další preparáty této skupiny – především abacavir a adefovir, který byl syntetizován v týmu A. Holého z Ústavu organické chemie a biochemie AV ČR. Z dílny tohoto vynikajícího chemika pochází i řada dalších virostatik, která jsou dnes v různých stadiích klinického testování.
V druhé polovině devadesátých let byly do praxe zavedeny některé další preparáty této skupiny – především abacavir a adefovir, který byl syntetizován v týmu A. Holého z Ústavu organické chemie a biochemie AV ČR. Z dílny tohoto vynikajícího chemika pochází i řada dalších virostatik, která jsou dnes v různých stadiích klinického testování.
 Dalším typem inhibitorů reverzní transkriptázy jsou látky nenukleosidového typu, které blokují reverzní transkriptázu tím, že se vážou mimo vazebné místo pro nukleosidy. Tento jiný způsob účinku umožňuje při podávání společně s předchozí skupinou snížit pravděpodobnost výskytu rezistence, což se také v klinické praxi potvrdilo. Nevýhodou je výskyt závažných nežádoucích účinků (kožních alergických reakcí nebo silného celkového útlumu), které často způsobí, že musí být léčba ukončena předčasně.
Dalším typem inhibitorů reverzní transkriptázy jsou látky nenukleosidového typu, které blokují reverzní transkriptázu tím, že se vážou mimo vazebné místo pro nukleosidy. Tento jiný způsob účinku umožňuje při podávání společně s předchozí skupinou snížit pravděpodobnost výskytu rezistence, což se také v klinické praxi potvrdilo. Nevýhodou je výskyt závažných nežádoucích účinků (kožních alergických reakcí nebo silného celkového útlumu), které často způsobí, že musí být léčba ukončena předčasně.
Inhibitory HIV-proteázy
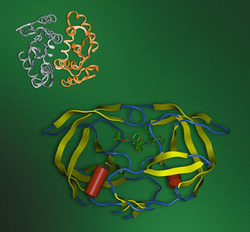
Jsou zatím poslední skupinou antiretrovirotik, která byla uvedena do praxe. Jak jsme již popsali, nově vzniklé polyproteiny viru HIV se shromažďují na plazmatické membráně hostitelské buňky, kde vytvářejí novou virovou částici. Při pučení těchto částic ven z buňky se uvnitř polyproteinů aktivuje virová proteáza, která štěpí zbytek polyproteinu na devíti přesně daných místech za vzniku všech strukturních proteinů a replikačních enzymů viru (včetně reverzní transkriptázy, integrázy a samotné proteázy). Teprve po proteolytickém štěpení získává jádro viru svůj charakteristický tvar a virus je plně infekční (obrázek).HIV-proteáza patří mezi aspartátové proteázy, což jsou enzymy schopné štěpit peptidovou vazbu bílkovin. Některé nejsou příliš vybíravé a štěpí proteiny víceméně náhodně uvnitř polypeptidového řetězce. Takové proteázy se uplatňují například při trávení bílkovin (žaludeční enzym pepsin). Jiné jsou naopak při výběru svého substrátu přísné, štěpí jich jen málo. Ty přísné pak mívají často regulační úlohu: např. lidský renin, který se uplatňuje při regulaci krevního tlaku. K těm vybíravým patří i proteáza HIV (obrázek a obrázek). Ta je zvláštní tím, že je součástí dlouhého virového polyproteinu, který má relativní molekulovou hmotnost 160 000 a skládá se z více než 1400 aminokyselin. Tento polypeptidový řetězec proteáza rozštěpí na devíti přesně definovaných místech v přesně daném pořadí. Jednotlivá místa štěpení se přitom od sebe dost liší v pořadí aminokyselin, mezi nimiž k štěpení dochází. O výběru štěpicího místa zřejmě rozhoduje struktura polypeptidového řetězce uvnitř sbaleného virionu a dostupnost jednotlivých částí řetězce pro molekulu enzymu. 2)
- Vývoj inhibitorů HIV-proteázy. Považují se (jen zčásti právem) za dosud nejpřesvědčivější důkaz úspěšnosti racionálního návrhu léčiv. Většina skutečně účinných farmak používaných v medicíně byla totiž izolována z přírodních léčiv, nalezena náhodným testováním různých chemických sloučenin nebo intuitivně odvozena chemickou derivací ze známých účinných látek. Představa, že chemik usedne k obrazovce počítače a na základě strukturních dat navrhne sloučeninu, která se stane skutečně účinným léčivem, se až dosud vyskytovala výhradně na stránkách sobotních příloh denního tisku. Příběh návrhu inhibitorů HIV-proteázy se tomuto literárnímu schématu trochu podobá.
 Od konce 80. let, kdy byla HIV-proteáza identifikována jako vhodný cíl terapeutického zásahu, se vývoj inhibitorů ubíral několika cestami. Především se jako strukturní základ využívaly známé inhibitory lidského reninu, vyvinuté během osmdesátých let. Dále se vycházelo ze známé struktury substrátů: navrhovaly a navrhují se takové chemické látky, které strukturně připomínají sekvence aminokyselin ve štěpených místech na virovém polyproteinu, které však nejsou proteázou enzymaticky hydrolyzovatelné. I v tomto případě se samozřejmě používalo testování knihoven nejrůznějších sloučenin, které jsou významným a žárlivě střeženým bohatstvím jednotlivých farmaceutických firem. Konečně se při návrhu inhibitorů začal využívat racionální design. První studie trojrozměrné struktury HIV-proteázy se objevily už r. 1989 (obrázek a obrázek) a od té doby bylo takových struktur změřeno téměř dvě stě. 3) S využitím tohoto obrovského poznatkového bohatství se podařilo, že už dva roky po identifikaci proteázy jako výhodného terapeutického cíle byl publikován inhibitor saquinavir, který byl pro klinické užívání uvolněn r. 1995. Krátce poté se na trh dostaly další – ritonavir, indinavir, nelfinavir, amprenavir a poslední z nich – lopinavir, který byl zaveden koncem r. 2000.
Od konce 80. let, kdy byla HIV-proteáza identifikována jako vhodný cíl terapeutického zásahu, se vývoj inhibitorů ubíral několika cestami. Především se jako strukturní základ využívaly známé inhibitory lidského reninu, vyvinuté během osmdesátých let. Dále se vycházelo ze známé struktury substrátů: navrhovaly a navrhují se takové chemické látky, které strukturně připomínají sekvence aminokyselin ve štěpených místech na virovém polyproteinu, které však nejsou proteázou enzymaticky hydrolyzovatelné. I v tomto případě se samozřejmě používalo testování knihoven nejrůznějších sloučenin, které jsou významným a žárlivě střeženým bohatstvím jednotlivých farmaceutických firem. Konečně se při návrhu inhibitorů začal využívat racionální design. První studie trojrozměrné struktury HIV-proteázy se objevily už r. 1989 (obrázek a obrázek) a od té doby bylo takových struktur změřeno téměř dvě stě. 3) S využitím tohoto obrovského poznatkového bohatství se podařilo, že už dva roky po identifikaci proteázy jako výhodného terapeutického cíle byl publikován inhibitor saquinavir, který byl pro klinické užívání uvolněn r. 1995. Krátce poté se na trh dostaly další – ritonavir, indinavir, nelfinavir, amprenavir a poslední z nich – lopinavir, který byl zaveden koncem r. 2000.
Dobré zprávy
Zavedení inhibitorů HIV-proteázy představovalo až dosud největší přínos v léčbě infekce HIV. Je třeba připomenout, že aids je choroba s dlouhou, až desetiletou inkubační dobou a samotný průběh choroby je dosti vleklý; je tedy obtížné vyhodnocovat úspěšnost antivirové léčby pouhých několik let po jejím masovém rozšíření. První výsledky byly přesto velmi dobré a v polovině devadesátých let vyvolaly všeobecný optimizmus.- Úmrtnost na aids výrazně poklesla, doba přežití se prodloužila a subjektivní stav pacientů se po nasazení nových virostatik výrazně zlepšuje. Časopis Time dokonce r. 1996 zvolil jako Muže roku Davida Hoa z Aaron Diamond Research Center v New Yorku, který se podílel na některých klinických studiích proteázových inhibitorů a jehož velká fotografie doprovázela článek o inhibitorech virové proteázy v Time Magazine (sám však žádný inhibitor neobjevil a dezorientovaní čtenáři ho Mužem roku zvolili zřejmě omylem). Optimizmus vrcholil. Nejlepších účinků při léčbě virostatiky bylo docíleno při používání směsí („koktejlů“) různých virostatik.
- Terapie HAART má vysokou účinnost (ostatně to má již v názvu: highly active antiretroviral therapy). Tato terapie se dnes používá nejčastěji. Dlouhodobě se kombinují alespoň tři preparáty dvou různých skupin. Hlavním cílem léčby je zvrátit nebo alespoň zastavit progresi onemocnění do poslední fáze infekce – aidsu. To je možné pouze tehdy, jestliže byla léčba zahájena v nepříliš pokročilé fázi onemocnění, kdy ještě nenastala nevratná destrukce imunitního systému. Jestliže se má destrukci zabránit, je třeba maximálně potlačit replikaci zhoubného viru. 4)
Základem léčby je kombinace dvou nukleosidových inhibitorů reverzní transkriptázy s jedním inhibitorem proteázy. Při léčbě je nezbytné sledovat kromě imunologických parametrů a virové nálože také krevní obraz, hodnoty jaterních enzymů a řadu dalších parametrů.
- Daří se oddálit vznik aidsu. V ideálním případě se daří dlouhodobě udržovat maximální supresi HIV a imunologickou stabilizaci. U pacientů s méně pokročilým onemocněním se mnohdy progrese do aidsu může oddálit o řadu let. Ani u pacientů s pokročilou infekcí HIV nejsou výsledky terapie zanedbatelné. Na počátku pandemie HIV většina pacientů ve stadiu aidsu nepřežívala déle nežli 8–12 měsíců, v současné době žijí běžně řadu let. Na prodloužení života pacientů s aidsem se však nepodílí jen antiretrovirová léčba, ale také stále lepší možnosti léčby oportunních infekcí či nádorů provázejících aids.
- Lze zabránit přenosu viru z matky na plod. Nejlepších výsledků se daří dosáhnout při podávání antiretrovirových léků HIV-pozitivním těhotným ženám. Jestliže se pravděpodobnost přenosu infekce virem HIV z matky na dítě v těhotenství a během porodu pohybuje bez těchto léků kolem 25 %, pak při podávání inhibitoru reverzní transkriptázy (zidovudinu) od 14. týdne těhotenství klesá riziko pod 5 %. Bohužel většina HIV-pozitivních těhotných žen žije v nejchudších rozvojových zemích a cena této léčby je příliš vysoká. 5)
Špatné zprávy
- Nežádoucí účinky léků. Zatím mají nežádoucí účinky všechna antiretrovirotika. O inhibitorech reverzní transkriptázy jsme se už zmínili. Dlouhodobé užívání inhibitorů virové proteázy vede u některých pacientů ke vzniku cukrovky a u většiny pacientů k poruchám metabolizmu tuků, které se projevují jednak značně zvýšenými hladinami krevních tuků (cholesterolu a triglyceridů), jednak výraznou změnou distribuce tělesného tuku, která způsobuje výrazné kosmeticky nepříznivé změny postavy. Tuk mizí z obličeje a končetin, ale hromadí se na břiše a na zádech, kde může dokonce vytvářet hrb. Nevýhodný je také způsob užívání proteázových inhibitorů. Některé musí být užívány přísně na lačno a mnoha pacientům způsobují silnou žaludeční nevolnost. Některé vyžadují vysoký denní příjem tekutin, jinak hrozí tvorba ledvinových kamenů. Jestliže pacient bere proteázové inhibitory, nelze mu podávat řadu jiných léků (v důsledku jejich výrazně zpomaleného odbourávání by mu hrozilo nebezpečí předávkování hypnotiky, antibiotiky nebo některými farmaky na léčbu srdečních arytmií, migrény apod.).
- Vysoké nároky na psychiku. Jak na pacienta, tak na terapeuta klade vysoké nároky zejména léčba HAART. Pacient musí být připraven užívat pravidelně i několik desítek tablet denně (kromě antiretrovirotik např. léky kontrolující oportunní infekce, vitaminy, podpůrné látky ad.), které často odporně chutnají, způsobují mu nevolnost nebo jiné problémy. Řádné užívání léků, z nichž některé musí být navíc skladovány v lednici, pohlcuje mnohdy značnou část pacientovy denní aktivity (viz obrázek a obrázek). Léčbu často zahajujeme u pacientů v počátečních stadiích onemocnění, kdy jsou subjektivní potíže poměrně slabé. Po nastoupení radikální antiretrovirové terapie se vlivem nežádoucích účinků virostatik může stav pacientů výrazně zhoršit. Úkolem lékaře je maximálně negativní účinky mírnit a tam, kde se jim nelze zcela vyhnout, vysvětlit pacientovi, že za tuto cenu je dosaženo žádoucí virové suprese. Psychicky traumatizující je pro pacienty pocit trvalé závislosti na léčbě bez naděje na vyléčení. Navíc musí být pacient připraven na možnost selhání jednoho léčebného režimu a nutnost přechodu k jinému.
- Rezistence vůči proteázovým inhibitorům. Vznik této rezistence se neočekával. Domnívali jsme se, že enzym skládající se z pouhých 99 aminokyselin, a přitom s velmi přísnou substrátovou specifitou nemůže mutovat tak, aby ztratil schopnost vázat inhibitor, a přitom neztratil schopnost štěpit svůj přirozený substrát. Mýlili jsme se. Ukazuje se, že za vzniku varianty rezistentní vůči některému inhibitoru může mutovat 45 ze všech 99 aminokyselin HIV-proteázy (obrázek).
Dynamika vzniku a vývoje rezistence vůči inhibitorům virové proteázy je náplní společného projektu mezi pracovišti autorů (Fakultní nemocnicí Bulovka a Ústavem organické chemie a biochemie AV ČR). Na Bulovce již pět let sledujeme evoluci rezistentních mutantů u více než 100 pacientů léčených inhibitory HIV-proteázy. Ukazuje se, že nejprve vznikají mutace primární, zeslabující vazbu inhibitoru na enzym a zároveň snižující aktivitu proteázy. Pod trvalým selekčním tlakem se pak hromadí další, sekundární mutace, které už neovlivňují vazbu inhibitoru, ale zlepšují katalytickou účinnost enzymu. Některé sekundární mutace se dokonce vůbec netýkají proteázy; vedou ke změnám aminokyselin ve štěpených místech virového polyproteinu, tj. v místě zásahu proteázy, a tím rovněž nepřímo zvyšují katalytickou účinnost mutovaného enzymu. Mutuje tedy nejen proteáza, ale i její substrát.
- Vysoká cena antiretrovirové terapie: Cena základní trojkombinace se pohybuje kolem 35 000 Kč za měsíc (tj. cena bez dalších nezbytných výdajů na biochemická vyšetření, práci specializovaných lékařů a sester, popřípadě za nemocniční ošetřování).
Je pochopitelné, že takto finančně náročná léčba není řešením pro země subsaharské Afriky, kde je epidemie aidsu skutečnou tragédií. Léčbu vhodnou pro tyto nejpostiženější země bude teprve třeba objevit. 6) Snad se jí může stát nová vakcína proti HIV.
Budoucnost antiretrovirové terapie
Jestliže vakcínu zatím ponecháme stranou, 7) zbývají jako léky virostatika. Pro další zlepšení osudu pacientů je třeba na antiretrovirové terapii ještě mnoho zlepšit. Ideální antiretrovirové chemoterapeutikum by mělo být maximálně odolné proti vzniku virové rezistence a způsobovat minimální nežádoucí účinky. Mělo by se podávat v jediné denní dávce a v co nejmenším počtu tablet. Mělo by mít ideální průnik do všech tkání, ve kterých se HIV vyskytuje – současné preparáty pronikají např. do centrálního nervového systému či do pohlavních žláz jen omezeně a virus v těchto orgánech může uniknout vlivu léku. Bude nutné mít k dispozici další preparáty, které budou schopny působit na virus na dalších místech replikace, což při kombinaci s jinými typy preparátů sníží pravděpodobnost vzniku rezistentních mutantů.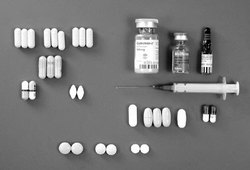 O současných terapeutických možnostech aidsu se dá tedy ohlásit jedna špatná a jedna dobrá zpráva. Nejprve ta špatná: Ani po dvaceti letech od popsání choroby neumíme aids vyléčit. Zatímco jste si četli tento článek, bylo na celém světě nově nakaženo asi 300 lidí. A nyní ta dobrá: Infekce HIV se stala jedním z chronických onemocnění, které vyléčit sice neumíme, léčit však ano. Dokážeme již stav pacientů dlouhodobě stabilizovat, a tím výrazně zlepšit jejich osud. 8)
O současných terapeutických možnostech aidsu se dá tedy ohlásit jedna špatná a jedna dobrá zpráva. Nejprve ta špatná: Ani po dvaceti letech od popsání choroby neumíme aids vyléčit. Zatímco jste si četli tento článek, bylo na celém světě nově nakaženo asi 300 lidí. A nyní ta dobrá: Infekce HIV se stala jedním z chronických onemocnění, které vyléčit sice neumíme, léčit však ano. Dokážeme již stav pacientů dlouhodobě stabilizovat, a tím výrazně zlepšit jejich osud. 8)
Poznámky
VZNIK virové REZISTENCE
Důležitou součástí evoluční a obranné strategie viru je skutečnost, že při své replikaci dělá chyby. Reverzní transkriptáza je enzym, který je schopen syntetizovat vlákno DNA podle předlohy RNA, tj. opačně než ostatní DNA-polymerázy. Nemá však schopnost opravy bází zabudovaných do rostoucího řetězce DNA. Tak se stává, že každá asi desetitisící báze je zabudována chybně. Vzhledem k tomu, že virus HIV má zhruba 10 000 párů bází, lze předpokládat, že každá průměrná nově vzniklá RNA dceřiného viru má jednu chybu. Vezmeme-li v úvahu velmi rychlou replikaci viru HIV v nakaženém jedinci, vychází podle matematických modelů, že HIV má milionkrát vyšší evoluční rychlost než hostitelský organizmus. Uvnitř jednoho pacienta jsou až miliony různých variant viru HIV. Řada z těchto mutantů je defektních a není schopna replikace, velká většina mutací je pro virus nevýhodná. Vytváří se tak však obrovská zásobárna mutantů viru, jejíž význam se projeví až pod selekčním tlakem určitého virostatika. Jeho působením se totiž z této „zásobárny“ vybere taková varianta viru, která je ještě schopna replikace, ale přitom už není blokována příslušným lékem.
U inhibitorů reverzní transkriptázy vzniká rezistence poměrně snadno, může totiž dojít k záměnám řady aminokyselin v polypeptidovém řetězci. Ty pak způsobí pokles inhibiční schopnosti inhibitoru k příslušnému mutantu až o pět řádů (100 000krát), přičemž mutovaná reverzní transkriptáza zůstane enzymaticky plně aktivní.
Vyšetřování na HIV
Vyšetřování na HIV je v České republice regulováno Metodickým návodem k řešení problematiky infekce vyvolané virem HIV, který vydalo Ministerstvo zdravotnictví ČR. Vyšetřování je dobrovolné a lze jej provést pouze se souhlasem vyšetřované osoby. Výjimkami je vyšetřování u dárců krve, orgánů a spermatu, kdy je písemný souhlas dárce s vyšetřením na HIV předpokladem darování, dále vyšetření těhotných žen, vyšetřování osob v bezvědomí, u nichž je vyšetření na HIV důležité pro stanovení přesné diagnózy, a také vyšetření osob obviněných z trestného činu ohrožování pohlavními nemocemi či u osob nuceně léčených pro pohlavní choroby.
Vyšetřování se provádí buď pod jménem, nebo anonymně. O vyšetření lze požádat ošetřujícího (rodinného) lékaře, lékaře epidemiologického oddělení hygienické stanice, lékaře AIDS centra při krajské infekční klinice, pracovníka AIDS poradny či dermatovenerologa. Lékař odešle vzorek krve vyšetřované osoby do příslušné laboratoře, která má oprávnění provádět vyšetření na přítomnost protilátek proti HIV. V této laboratoři je provedeno vyhledávací vyšetření testem ELISA, který je vhodný právě pro vyhledávací testování. Je vysoce citlivý, což znamená, že vyšetření nemá téměř žádnou falešnou negativitu, ale mohou být zachyceny falešně pozitivní případy. Jestliže vzorek ve vyhledávacím testu reaguje pozitivně, odešle jej laboratoř k ověření do Národní referenční laboratoře pro AIDS ve Státním zdravotním ústavu v Praze. Tam jsou provedena další dvě serologická vyšetření – ještě jednou test ELISA a test Western blot, který je vysoce specifický a spolehlivě odliší případné falešně pozitivní výsledky z vyhledávacího testu od výsledků skutečně pozitivních. Teprve při souhlasném pozitivním výsledku všech tří testů je vyšetřovaná osoba hlášena jako anti-HIV pozitivní. Jestliže lékař, který poslal vzorek na vyšetření, obdrží pozitivní výsledek, doporučí pacientovi návštěvu příslušného AIDS centra.
Ke stažení
 DATA A SOUVISLOSTI - AIDS [1,85 MB]
DATA A SOUVISLOSTI - AIDS [1,85 MB] Článek ve formátu PDF [1,77 MB]
Článek ve formátu PDF [1,77 MB]