Tři zdroje a tři součásti oplození
Už v základní škole nám více nebo méně obratně vyložilli tajemství splynutí dvou pohlavních buněk, vajíčka a spermie. Povšechnou představu nám později zpřesnily a potvrdily klasické učebnice genetiky, a tak snad každý něco ví o splývání dvou genomů a prosazování se dvou genových alel.
Oplozené vajíčko – zygota – je však výsledkem interakce ne dvou, ale tří struktur: kromě obou jader obsahujících mj. genetický materiál – jednoho původem z vaječné buňky, druhého ze spermie – se součástí zygoty stává i tělo původní vaječné buňky – oocytu. Tělo spermie do vajíčka nevniká, spermie do vajíčka injikuje jen své jádro a zaniká (v této souvislosti upozorňuji, že text se týká situace u obratlovců). Bezprostředně po oplození dochází k rozsáhlé přestavbě struktury obou jader – vzniknou z nich tzv. prvojádra (pronuklei). Samčí a samičí prvojádra posléze splynou v jediné diploidní jádro zygoty a vzniká nový jedinečný tvor.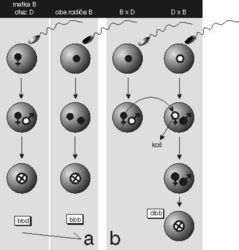
Při normálním oplození dodává tedy matka budoucí zygotě dvě složky – jádro s genetickým materiálem a strukturu vaječné buňky. Že posledně jmenovaná struktura není jakýmsi pasivním „přehrávačem“ toho, co se jí dodá formou genetického zápisu, se ví už dávno; připomenu zde jen dva příklady:
W. Reik a jeho spolupracovníci se už několik let zajímají o roli všech tří složek při oplození u myší (Reik a spol. 1993; Roemer a spol. 1997). Volili metodu transplantace prvojader mezi oplozenými vajíčky dvou geneticky odlišných kmenů myší, nazvěme je pro jednoduchost D a B. Jestliže vajíčko myši kmene B (buňka b, jádro b) oplodní spermie od samečka typu B (jádro b), zygotu bude možno charakterizovat formulkou bbb, analogicky pro rodiče z kmene D je zygota ddd. Křížíme-li matku D s otcem B, dostaneme zygotu ddb, a ovšem B×D dá bbd (obr. 1a). Co se však stane, odstraníme-li ve stadiu prvojader mateřské prvojádro a nahradíme ho prvojádrem pocházejícím z jiného kmene (obr. 1b)? Vyrobíme zvláštní typ křížence, kterého autoři pojmenovali nukleocytoplazmatický (NC), křížence charakterizovaného, podle rodičů a dárců, některou z formulek bdb, bdd, dbd nebo dbb (obr. 1b).
Autoři odebrali zralé myší pohlavní buňky a provedli oplození in vitro (B×D nebo D×B). Část oplozených zygot nechali na pokoji (zygoty bbd nebo ddb), u druhé skupiny provedli transplantace samičích prvojader mezi dvěma druhy zygot (z B×D do D×B a obráceně); vznikly tak nepřirozené kombinace bdd nebo dbb. Autoři pochopitelně nezapoměli ani na tzv. pozitivní kontroly, kdy sice vyjmuli samičí prvojádro, ale nahradili ho prvojádrem téhož typu, jen z jiného vajíčka. Tak rekonstruovali přirozenou kombinaci, ovšem provedli mikrochirurgický zákrok a testovali tak možnost vlivu samotné operace na další vývoj. Jak je vidět, šlo o manipulace čistě mechanické, epigenetické, genová výbava jader nebyla nijak pozměněna a mendelovská dědičnost by neměla být narušena.
Všechny tři typy zárodků pak experimentátoři vložili do dělohy myší, které byly ve správném stadiu cyklu, takže zárodky se zahnízdily a za 3 týdny se narodila mláďata, hlavní předmět zájmu. Především – přirozeně zplození potomci se ve sledovaných parametrech nijak nelišili od pozitivních kontrol, a tak bylo možné vyloučit vliv samotného operačního výkonu.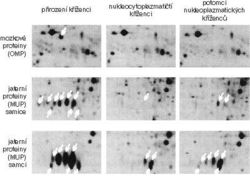
NC hybridi v dospělosti méně vážili; tento kvantitativní znak se snadno pozná, ale není tak zajímavý jako výsledky biochemické a – etologické. Autoři extrahovali proteiny z různých myších orgánů, podrobili je dvourozměrné elektroforéze v polyakrylamidovém gelu, která umožní rozpoznat v jednom vzorku asi 10 tisíc proteinů, a srovnávali takto získaná souhvězdí z kontrolních a pokusných zvířat. V extraktech z jater a mozku chybělo u NC hybridů asi 25 proteinů. V „macešské“ buňce bylo cosi, co mnohem později, v dospělosti, způsobilo změny genové exprese v některých orgánech. NC hybridi nebyli schopni spuštění těchto genů vyvolat, nebo je dokonce záměrně zablokovali. Zdá se, že jde o druhý případ: v oblasti, kde se tyto geny nacházejí, se zvýšila metylace DNA, což bývá charakteristikou trvale vypnutých genů.
O jaké proteiny jde? V játrech je to třída proteinů zvaných MUP (major urinary proteins). Tyto proteiny se vylučují s močí a vážou se tam na feromony, pomocí nichž si jedinci navzájem signalizují svoji přítomnost, míru příbuznosti a připravenost k páření (o tom, jak jsou pachy klíčovou složkou myšího života, viz Vesmír 76, 323, 1997/6). A v mozku to byly proteiny OMP (olfactory marker proteins), které jsou přenášeny na povrch čichových buněk nosní sliznice a fungují tam jako součást receptorů pro komplex MUP-feromon! Myši obou pohlaví jsou proto signalizačně i senzoricky deprivované, neumějí signalizovat svým potenciálním sexuálním partnerům a samy je neumějí rozpoznat. Výsledek – odmítají se pářit.
Překvapením však ještě nebyl konec: Protože NC hybridi produkovali zdravé pohlavní buňky, nebyl problém „zařídit“ umělé oplození normálních samiček spermiemi odebranými z NC hybridů. A ukázalo se, že NC fenotyp, tj. blok v expresi proteinů MUC a OMP, se přes samčí linii, tj. spermiemi, přenáší do další generace! A konečně: analýzou statistických dat se ukázalo, že popsaný fenotyp s určitou pravděpodobností vznikne i u kontrolních myší, tj. myší zplozených „klasicky“.
Epigenetická dědičnost ve formě trvalých modifikací (Dauermodifikationen), které v průběhu generací postupně mizí a linie se vrací k původnímu fenotypu, je dobře popsána u prvoků i rostlin a byla „v módě“ hlavně mezi válkami. Zájemce o současný stav odkazuji na knihu autorek E. Jablonka, M. Lamb o epigenetické dědičnosti (viz recenzi ve Vesmíru 75, 285, 1996/5). Metodicky však bylo dost obtížné navrhnout pokusy s jednoznačnými výsledky a po objevu DNA a genetického kódu většina biologů přešla na studium genů. V popsaném případě jde patrně o první vědecky podložený důkaz epigenetické dědičnosti u savců, a to nejmodernějšími a obecně akceptovanými metodami. Na úrovni čistě popisné existují, pravda, nejméně dva dobře dokumentované případy, které naznačovaly existenci jevu.
Je známo, že telata a jehňata narozená ze zmrazených transplantovaných embryí jsou větší než kontrolní.
Zvláštní náhodou se práce o epigenetické dědičnosti u savců objevila zároveň se zprávou o klonované ovci Dolly, i když mediálně neměla proti Dolly žádnou šanci. K jakému poznání oba objevy vyúsťují? Dolly může být geneticky naprosto totožná se svou matkou (i to má své meze – např. matka má za sebou ontogenezi imunitního systému, která je jedinečná a není přenosná na potomstvo). Nemůže s ní však být totožná epigeneticky: jádro z matčiny tkáně bylo vloženo do jiné vaječné buňky s odlišnou historií, zkušeností.
Je věcí budoucnosti objasnit míru podílu obou typů dědičnosti. Na první pohled jde o nepatrnou odchylku – pár proteinů z desetitisíce. Na druhé straně – málo proteinů je nedůležitých. Příroda se postarala, že téměř každý jedinec dostane do vínku jedinečný soubor genů – genotyp (výjimkou jsou „jednovaječná“ dvojčata). Pokud uměle vyrobíme jedince se shodnými genotypy, ukáže se, že i dědičnost je epigenetická. Žádný genotyp nevstupuje dvakrát do stejné buňky.
Literatura
Jablonka, E., & Lamb, M.J.: Epigenetic inheritance and evolution. The Lamarckian dimentsion. Oxford University Press 1995Reik, W., Romer, I., & et al.: Adult phenotype in the mouse can be affected by epigenetic events in the early embryo. Development, 119, 933–942, 1993
Roemer, I., Reik, W., Dean, W., & Klose, J.: Epigenetic inheritance in the mouse. Curr.Biol. 7, 277–280, 1997
Ke stažení
 Článek ve formátu PDF [370,92 kB]
Článek ve formátu PDF [370,92 kB]

























