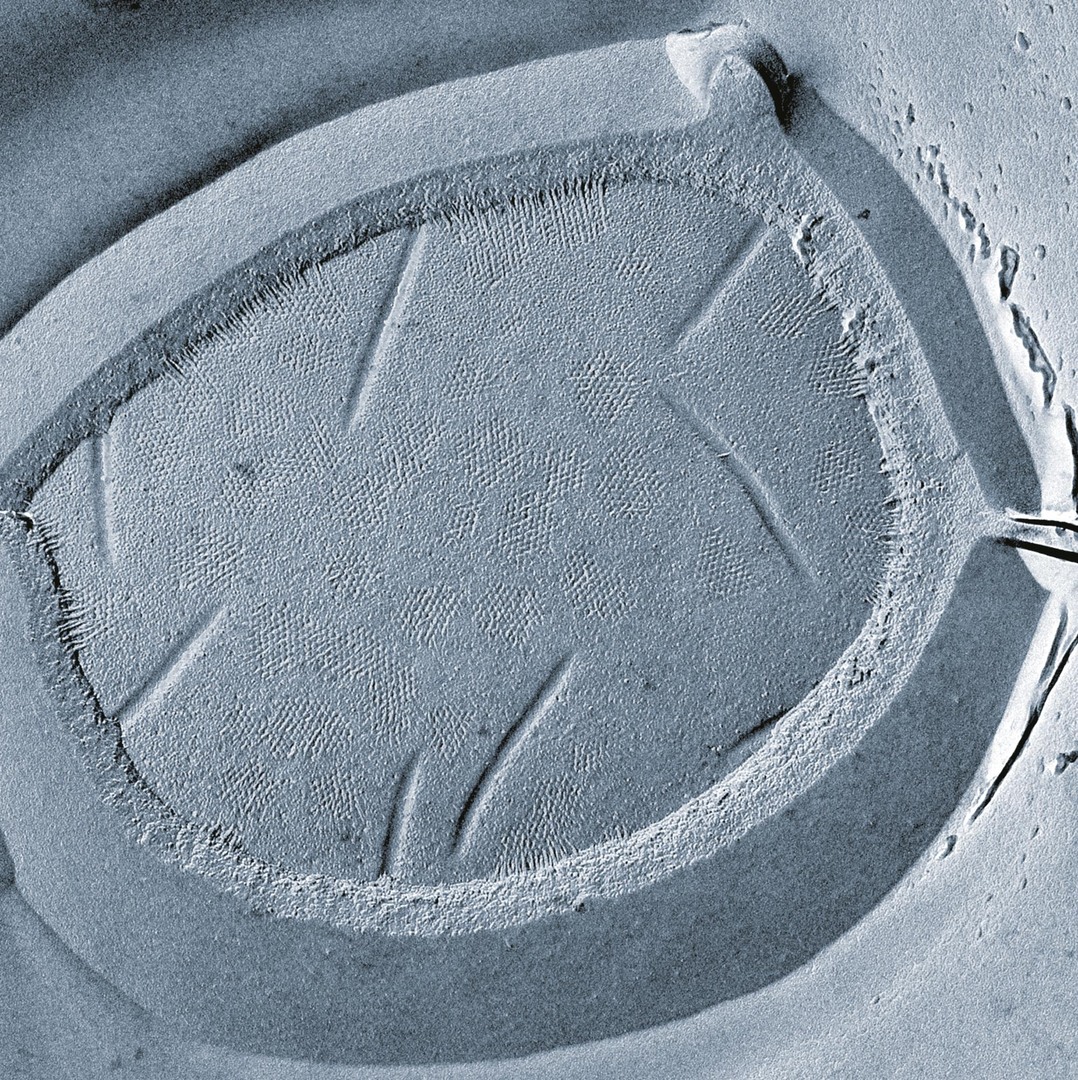
Co dělá kvasinkám vrásky
Všechny živé buňky jsou ohraničeny plazmatickou membránou. Ta zdaleka není pouhou bariérou mezi buňkou a jejím okolím, ale vykonává i řadu biologických funkcí, jako je transport živin, iontů a vody, buněčná signalizace apod. Tato funkční rozmanitost je podmíněna tím, že membrána není homogenní, ale její plocha je rozdělena do funkčních domén. Jednou z nejintenzivněji studovaných membránových domén jsou početné žlábky, jimiž je zvrásněna plazmatická membrána buněk mnohých vřeckovýtrusných hub a jednobuněčných řas.
V laboratorních podmínkách, tj. za stálé teploty a dostatečného přísunu živin, modelové buňky pivovarské kvasinky Saccharomyces cerevisiae příliš netrápí, pokud je například cílenou genetickou manipulací těchto vrásek zbavíme. Ve volné přírodě však opakované zmrazení a rozmrazení na povrchu sněhové závěje přežijí pouze ty řasy, které žlábky mají, zatímco druhy s hladkou membránou rychle hynou. A patogenní houby (např. půdní plíseň Beauveria bassiana, která napadá různé druhy hmyzu, nebo kvasinka Candida albicans, původce obtížných mykóz u savců včetně člověka) při absenci žlábků ztrácejí schopnost prorůstat do tkáně hostitele a stávají se do značné míry neškodnými.
Membránové žlábky bývají jen několik desítek nanometrů hluboké a několik set nanometrů dlouhé. Jakým způsobem dodává tato miniaturní struktura buňce odolnost ve stresových situacích? Nedalo by se faktu, že umíme žlábky narušit, terapeuticky využít? To jsou otázky, kterými se dlouhodobě zabýváme.
Víme například, že při nedostatku některých živin buňka hromadí v membráně svých žlábků specifické transportní proteiny. Tím zajistí, že transportéry nejsou recyklovány předtím, než splní svoji funkci. Teprve když je substrátu dostatek, transportér je ze žlábku uvolněn do okolní membrány a recyklován. Prvním transportérem, u kterého bylo toto chování pozorováno, byl argininový přenašeč Can1. Podle něj dostaly žlábky jméno MCC (z angl. Membrane Compartment of Can1).
Při zvýšeném membránovém napětí, například při mechanickém nebo osmotickém stresu, se některé žlábky MCC rozpadnou. Uvolní se tím proteinové komponenty, které aktivují buněčnou odpověď na membránový stres. Tou je zejména aktivace biosyntézy membránových lipidů, především sfingolipidů. Po doplnění membrány nově syntetizovanými lipidy se žlábky opět obnoví.
Ne všechny vrásky se však při stresu vyrovnávají. Ukázali jsme, že zatímco se jedny žlábky rozpadnou, jiné se naopak formují, jen s poněkud odlišným složením. Ve spolupráci s kolegy ze Slovenské akademie věd jsme prokázali, že pomocí jednoduchých lipidů lze účinně a obousměrně koordinovat adaptaci na vnější stres s aktivitou mitochondrií, tedy buněčným dýcháním. Konkrétně že prekurzory sfingolipidů, ceramidy, regulují metabolismus mitochondriálních fosfolipidů, fosfatidylglycerolu a fosfatidyletanolaminu a že například intenzita degradace fosfatidylglycerolu ovlivňuje množství žlábků MCC na plazmatické membráně.
Kvasinky preferují jako zdroj uhlíku cukr. Když jim dlouhodobě chybí, uloží do žlábků enzym exoribonukleázu, který pro ně bude nezbytný, až se cukr znovu objeví. Kvasinky jsou mistry ve zpracování velkého množství cukru, potřebují k tomu však úplně jiné typy enzymů, než jaké používají k přežití ve stavu nouze. Exoribonukleáza, která rozkládá mRNA, je nezbytná právě tehdy, když je metabolismus buňky třeba od základů přestavět. Její uvolnění ze zásob ve žlábcích poskytne kvasince možnost rychle na změnu prostředí zareagovat. A tady to začíná být obzvlášť zajímavé. Exoribonukleáza je v evoluci zachována od kvasinek po člověka. A před několika lety se podařilo ukázat, že v synapsích potkaních neuronů reaguje na metabolické podněty úplně stejně jako u kvasinek!
Molekulární podstatu jevu, při kterém se molekuly exoribonukleázy shluknou na jednom místě, aby byly v případě potřeby rychle k dispozici, se teprve snažíme objasnit. Zda tím přispějeme ke zmírnění projevů některých neurodegenerativních chorob nebo zda se látka, která dokáže narušit funkčnost membránových žlábků u patogenních hub, stane antimykotikem nové generace, zatím nevíme. Už teď jsme si však jisti, že přijít na to, co dělá kvasinkám vrásky, je důležité.
Oddělení funkčního uspořádání biomembrán se zabývá výzkumem jemné struktury, dynamiky a biologické funkce membránových mikrodomén. Důraz přitom klademe na jejich zapojení do regulace buněčných procesů v reakci na podněty z okolního prostředí. S maximálním využitím výhod geneticky přístupného kvasinkového modelu zkoumáme zejména roli membránových mikrodomén ve vnímání stresu a stresové adaptaci, v signalizaci a v regulaci buněčného metabolismu.
Vedoucí oddělení: doc. RNDr. Jan Malínský, Ph.D.
Ke stažení
 článek ve formátu pdf [348,19 kB]
článek ve formátu pdf [348,19 kB]