Jak se rodí proteiny
| 2. 5. 2018Zrození fascinuje člověka odnepaměti a ona fascinace se projevuje na mnoha úrovních. Zrození proteinu je obtížné vměstnat do jediného okamžiku, čímž se vymyká obecnějším představám. Následující text má za úkol naznačit důvody takové výjimečnosti a ukázat, proč je důležité se ptát, jak se rodí proteiny.
Proteiny1) jsou biopolymery: „bio“, protože zajišťují řadu biologických funkcí, a „polymery“, neboť jsou to velké molekuly složené z jednodušších stavebních jednotek. Těmito stavebními jednotkami jsou aminokyseliny, jichž se v přírodě vyskytuje dvacet základních druhů.2) Jsou spojeny chemickou vazbou, které se říká peptidová. Pokud bychom se na proteiny podívali přes zvětšovací sklo, vypadaly by, obrazně řečeno, jako pestrobarevné korálky navlečené na niti a smotané do klubka. Barev by bylo dvacet. Některé barvy bychom zvětšovacím sklem viděli v několika odstínech, protože aminokyseliny mohou mít na sobě různé přívěsky z cukrů, uhlovodíkových zbytků atp. Přívěsky zvyšují variability základních jednotek, z nichž se proteiny skládají.
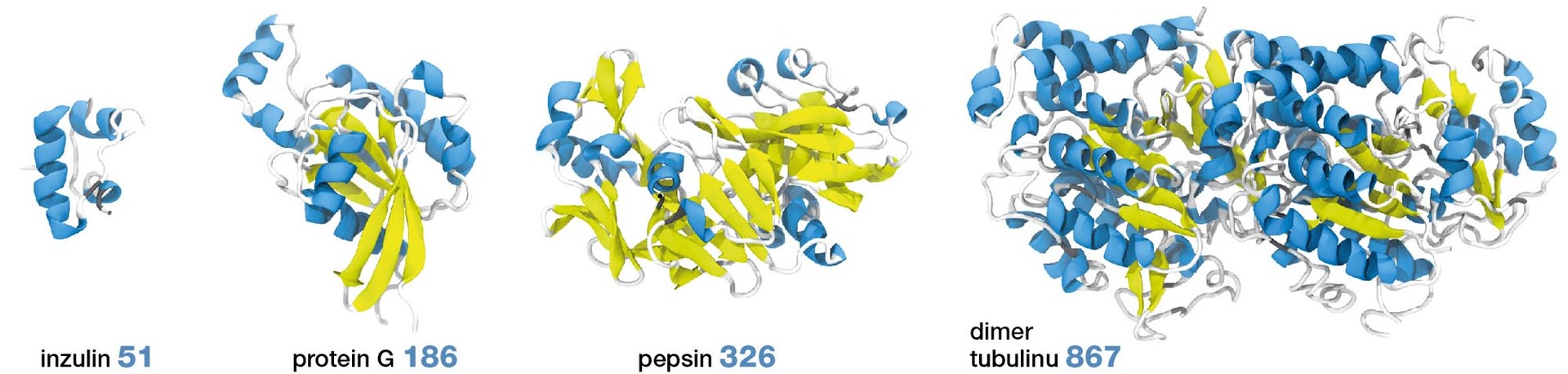
Proteiny jsou nezbytnou součástí života, jak jej dnes chápeme. Vytvářejí stavební struktury v organismech (tubulin), katalyzují chemické reakce (pepsin), jsou zodpovědné za přenos biologických signálů (protein G) či regulují buněčný metabolismus (inzulin; obr. 1). Nepřekvapuje, že nesprávné fungování proteinů souvisí s celou řadou onemocnění od cukrovky po rakovinu. V buňkách proto existují citlivé mechanismy, jež kontrolují syntézu, fungování i degradaci proteinů.
Příroda si vystačí s dvaceti stavebními kameny, z nichž je schopná poskládat rozmanité trojrozměrné struktury. Americký biochemik a nositel Nobelovy ceny Christian Anfinsen formuloval v šedesátých letech 20. století hypotézu, podle níž každé sekvenci aminokyselin náleží za daných vnějších podmínek unikátní trojrozměrná struktura, díky níž plní protein svou funkci. Jiný americký vědec Cyrus Levinthal si následně uvědomil, že možných trojrozměrných uspořádání je astronomické množství,3) a položil tím světu zásadní otázku: Jakým způsobem se řetízek aminokyselin sbalí do právě jedné správné trojrozměrné struktury? Problémem se dodnes zabývá mnoho laboratoří po celém světě. V poslední dekádě ovšem nabralo bádání nový směr, jehož středobodem je ribozom – buněčná továrna na výrobu proteinů.
Ribozom
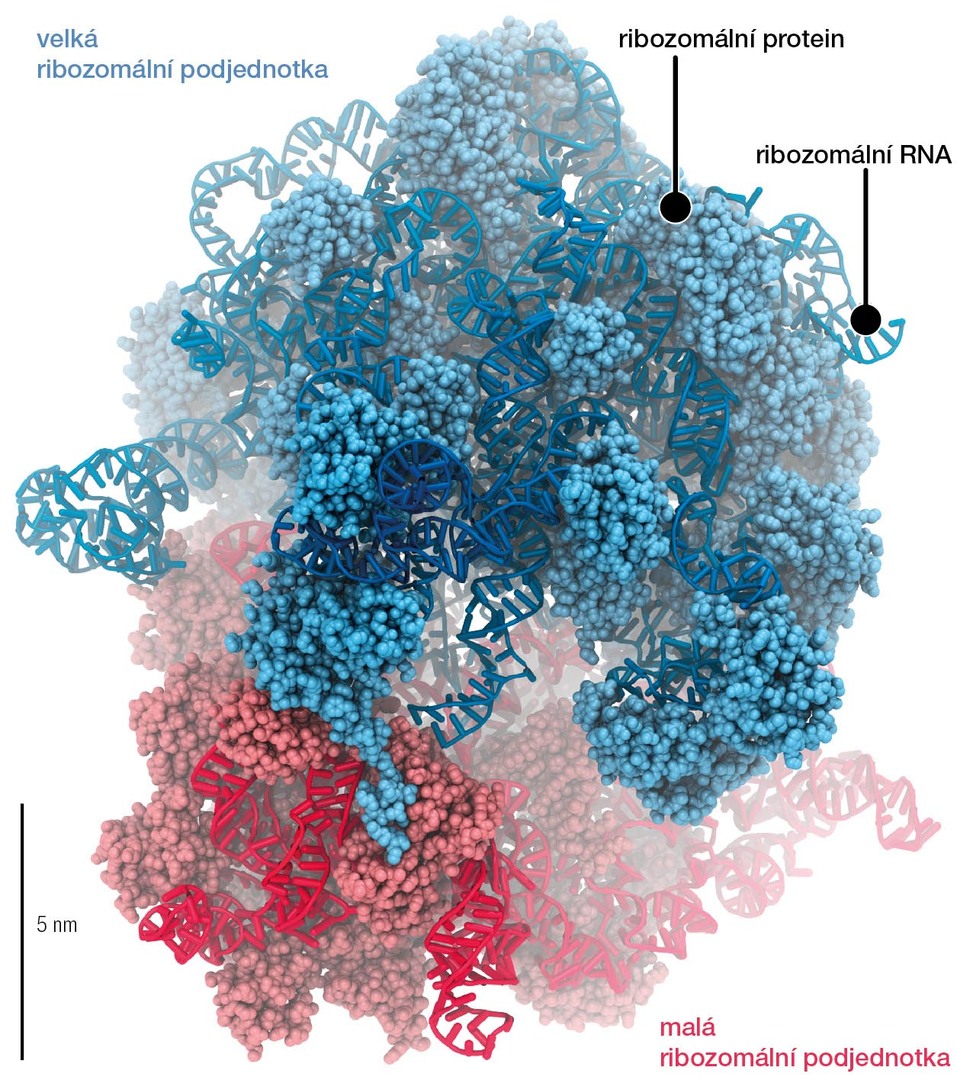
Ribozomy jsou biomolekulové komplexy zodpovědné za syntézu proteinů (obr. 2). Byly objeveny v padesátých letech 20. století jako malé kulovité objekty4) napojené na membránu endoplazmatického retikula. Přelom ve studiu ribozomů nastal v letech 2000 a 2001, kdy vědci z laboratoří v Cambridgi (Spojené království), New Havenu (USA) a Rehovotu (Izrael) rozluštili jejich atomární strukturu5) a položili tím základ detailnímu zkoumání jejich funkce. Protože proteiny jsou v buňce potřeba neustále a ve velkém množství, jsou v ní desítky tisíc ribozomů. Jejich hlavním úkolem je přeložit genetickou informaci ve formě mRNA6) do sekvence aminokyselin v procesu zvaném translace. Ribozomy katalyzují vznik peptidové vazby mezi aminokyselinami. Hotový protein se následně sbalí, je chemicky upraven a transportován do místa použití, přičemž pořadí těchto úkonů se může lišit protein od proteinu.
O proteinech se lidstvu dosud podařilo shromáždit ohromné množství informací. Byť zbývá ještě mnoho otázek zodpovědět a ještě více jich položit, troufnu si tvrdit, že víme, jak proteiny vypadají, co dělají a jak dlouho jim to trvá. Víme, jak rychle se balí, jakou roli v těchto dějích hraje okolní teplota, koncentrace solí atp. Stejně tak rozumíme tomu, jak se proteiny shlukují do složitějších celků i jak zanikají. Většina těchto vědomostí pochází z výzkumů na izolovaných proteinech, což ale, jak se podle aktuálních zjištění zdá, nemusí být zrovna relevantní. Pojďme se proto na chvíli vrátit k ribozomu.
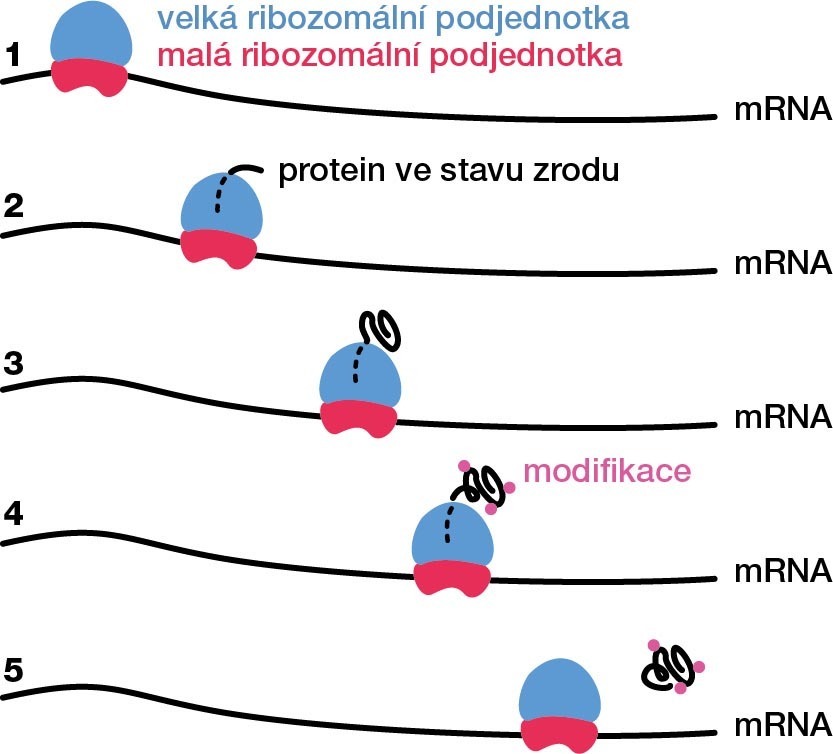
Nejpodstatnější chemická reakce – vznik peptidové vazby – probíhá uvnitř ribozomu. Tam se jedna aminokyselina za druhou zapojuje do řetízku v přesně daném pořadí; u bakterií rychlostí 4 až 20 aminokyselin za vteřinu, u vyšších organismů o něco pomaleji. Z katalytického centra ribozomu vede tunel, kterým se protein ve stavu zrodu (angl. nascent protein) dostane na povrch. Tunel měří asi 10 nm a pojme 20 až 60 aminokyselin. Z uvedeného plyne, že typický protein složený z 250 aminokyselin stráví nějakou dobu připoutaný k ribozomu. Z hlediska „života“ proteinu je tato doba dostatečně dlouhá na to, aby se s proteinem stalo mnoho věcí.
Kotranslační děje
Předně se stále častěji objevují výzkumy, které podporují hypotézu tzv. kotranslačního balení. Proteiny ve stavu zrodu se začínají balit již uvnitř ribozomálního tunelu během translace. Jiné proteiny svou unikátní trojrozměrnou strukturu získávají krátce poté, co tunel opustí, a to ještě ve chvíli, kdy je některá jejich část připoutána k ribozomu. Ribozom a jeho bezprostřední okolí proto hrají důležitou roli v tom, jak se protein sbalí. Pokud se sbalí špatně, snadno ztratí svou funkci. Např. při cystické fibróze postrádá tzv. protein CFTR jednu aminokyselinu (z celkového počtu asi 1500), kvůli čemuž se špatně sbalí a je nefunkční.
Špatně sbalený protein může naopak i novou funkci získat. Jde např. o schopnost shlukovat se s jinými kopiemi téhož proteinu. Ze shluků proteinů vznikají v nervových buňkách tzv. amyloidní plaky, jež souvisejí s neurodegenerativními poruchami, jako jsou Alzheimerova nebo Parkinsonova nemoc. Tyto shluky jsou proto v hledáčku farmaceutických firem, přičemž není jasné, zda proteinové agregáty nemoci způsobují, nebo jsou jejich důsledkem.
Některé proteiny se v buňkách shlukují do funkčních komplexů záměrně. Ostatně i ribozom je biomolekulový komplex složený z několika molekul ribozomální RNA a přibližně 40 proteinů. Toto shlukování je v buňce pečlivě řízeno a zdá se, že ribozom přispívá i k regulaci „záměrného“ shlukování. Poukázal na to nedávný výzkum luciferáz – enzymů zodpovědných za bioluminiscenci. V jejich případě ribozom reguluje navázání dvou proteinových podjednotek do funkčního celku, což se děje během translace druhé podjednotky.7 Další současné výzkumy naznačují, že také „zrání“ některých proteinů probíhá kontranslačně. Protein ve stavu zrodu může být na ribozomu chemicky upraven cukernými zbytky, oxidací chemických skupin obsahujících síru, vazbou malých molekul atp. Shrnuto do jedné věty: kotranslační děje významně promlouvají do biochemie proteinů (obr. 3).
Během pobytů v Jižní Koreji jsem byl několikrát tázán na svůj věk. Po mé odpovědi obvykle následovala další otázka, zda se jedná o „korejský věk“ (korean age), nebo o věk západní. V Koreji totiž počítají stáří osoby od okamžiku početí, nikoli od narození. Korejské děti se tedy rodí 9 měsíců staré, což se běžně zaokrouhluje na 1 rok. Při studiu proteinů naráží člověk na podobné obtíže jako při rozhovoru s Korejci. Je ambiciózní odpovědět na otázku, jak starý protein je nebo v jakém momentě vůbec vznikne.
Pokusme se naplnit tuto ambici a v řeči čísel lépe prozkoumat stáří proteinu. Za moment vzniku proteinu zkusme považovat chvíli, kdy se protein po zabudování poslední aminokyseliny oddělí od ribozomu. Nechť má náš cvičný protein 250 aminokyselin. V pivní kvasince S. cerevisiae je doba života proteinu přibližně 2 hodiny8) a ribozom kvasinky zpracuje 5 aminokyselin za vteřinu. Cvičný protein je tedy k ribozomu připoután alespoň 50 s, což odpovídá 0,7 % doby života proteinu. Pokud by člověk strávil stejnou poměrnou dobu v porodních cestách své budoucí matky, netrvala by finální část lidského porodu několik minut, ale zhruba půl roku.9) Jinými slovy v témže duchu: jakmile se protein oddělí od ribozomu, je podobně starý jako půlroční kojenec. Stejně jako kojenec má i protein spoustu zážitků a člověk nemusí být zrovna z východní Asie, aby „čas nula“ hledal někde jinde. Spoustu vodítek nám v hledání poskytuje molekulární biologie, biochemie a biofyzika. Zvládnou ale přírodní vědy po všech těchto úvahách odpovědět na otázku, jak starý je protein, když se narodí?
Poznámky
1) V textu budu používat výraz „protein“, přestože čeština má pro stejný objekt k dispozici výraz „bílkovina“. Osobně mi bílkovina zní jako něco, co mohu sníst (mléčná bílkovina), nebo s tím ve větším množství manipulovat. Naproti tomu protein vnímám jako malou molekulu, se kterou se (lžící) manipuluje obtížně, neboť je opravdu malá.
2) Za „dvacátou první“ aminokyselinu je považován selenocystein.
3) Tzv. Levinthalův paradox lze demonstrovat výpočtem. Pro jednoduchost předpokládejme, že každé dvě aminokyseliny spojené peptidovou vazbou mohou vůči sobě zaujímat 4 různé orientace. Řetízek o 250 aminokyselinách bude mít 249 takových spojení. Celkový počet možných uspořádání takového řetízku je 4249 = 8 ∙ 10149 (tedy číslice 8 následovaná 149 nulami), přičemž odhadovaný počet atomů ve vesmíru se pohybuje okolo 1080. Paradoxem je, že protein je schopen se sbalit do správné trojrozměrné struktury, a to typicky během milisekund.
4) V roce 1974 získali A. Claude, C. de Duve a G. E. Palade Nobelovu cenu za medicínu za výzkum vnitřní organizace buněk včetně objevu ribozomů.
5) Objevy vedly v roce 2009 k Nobelově ceně za chemii pro V. Ramakrishnana, T. A. Steitze a A. E. Yonathovou. Zbývá dodat, že ribozomy hrály klíčovou roli i v udělení Nobelovy ceny za chemii v roce 2017 za rozvoj kryoelektronové mikroskopie. Jedním z oceněných byl Joachim Frank, jehož hlavním objektem zájmu je právě ribozom.
6) mRNA (messenger RNA) vzniká tzv. transkripcí genetické informace z DNA.
7) DOI: 10.1126/science.aac8171.
8) Výzkumy ukazují, že doba života proteinu se typicky pohybuje mezi 1 hodinou a 2 dny. Závisí to na typu proteinu, ale i na organismu. U jednodušších organismů je doba života kratší. Existují však i případy dlouhověkých proteinů, které v buňce fungují i několik let.
9) Při době dožití 80 let.
Ke stažení
 článek ve formátu pdf [640,79 kB]
článek ve formátu pdf [640,79 kB]
O autorovi
Michal Kolář