Odhalená tvář zlodějů buněk
| 1. 2. 2017„Virus je špatná zpráva zabalená do bílkoviny,“ řekl britský biolog Peter Medawar. Abychom se těmto špatným zprávám dokázali bránit, nestačí umět je přečíst. Musíme také detailně poznat obálky, do nichž jsou zabaleny. V brněnském ústavu CEITEC k tomu přispívá virolog Pavel Plevka. Studuje především pikornaviry (malé RNA viry způsobující řadu nemocí od nachlazení po infekce nervového systému včetně vážných zánětů mozku), ale svůj zájem obrací i k dalším skupinám.
O viry se zajímáte od střední školy. Čím vás zaujaly? — Na gymnáziu se o virech moc nemluvilo, byla to jen taková tenká kapitola v učebnici, ale zalíbily se mi svojí jednoduchostí. Dostal jsem skvělý nápad, že by se daly využít k léčbě rakoviny. Na vysoké škole jsem pak zjistil, že stejný nápad měli už o několik desítek let dříve jiní. Nicméně kvůli tomu jsem se začal o viry zajímat víc a už jsem u nich zůstal.
Považujete je za živé organismy? — Je to filosofická otázka, na kterou není možné jednoznačně odpovědět, ale osobně je za živé považuji. Život není žádný speciální fenomén, definujeme ho jen výčtem vlastností. Viry mají řadu znaků živých organismů. Podléhají evoluci, množí se – mně to stačí. Sice nemají vlastní metabolismus, což je jeden ze znaků života, ale když infikují buňku, veškerý její metabolismus slouží k pomnožení viru.
 Takový dawkinsovský rozšířený fenotyp? — I tak by se to dalo nazvat. Virus buňku převezme, ovládne ji a využije pro své potřeby, takže pro mne je živý dostatečně.
Takový dawkinsovský rozšířený fenotyp? — I tak by se to dalo nazvat. Virus buňku převezme, ovládne ji a využije pro své potřeby, takže pro mne je živý dostatečně.
Jak to zařídí, že je mu buňka po vůli? — Virové proteiny modifikují buňku tak, aby v ní virus mohl efektivně tvořit své kopie. Jeden z proteinů pikornavirů např. vypne translaci buněčných RNA, takže úplně přestane tvorba buněčných proteinů a všechny zdroje buňky jsou k dispozici jen pro výrobu nových virů.
Takový centrální vypínač? — Ano. Další virové proteiny způsobují modifikaci membránových struktur buňky. Pikornaviry většinou využívají membrán endoplazmatického retikula nebo Golgiho aparátu. Vytvoří se na nich malé váčky, na jejichž povrchu se replikují virové RNA a sestavují se dceřiné partikule. Celkově se těmto strukturám říká virové továrny.
Co mají pikornaviry jako hlavní skupina vašeho zájmu společného? Co je definuje? — Důležitý je způsob, jakým je u nich organizován genom, a specifická struktura virové kapsidy. Genom pikornavirů tvoří jednovláknová lineární molekula RNA o délce mezi 7500 až 10 000 nukleotidy. Translaci genomu zajišťuje pikornavirová IRES neboli internal ribosomal entry site, která se v infikované buňce váže na ribozomy. RNA pikornavirů kóduje jeden polyprotein, který se následně štěpí na jednotlivé funkční proteiny. Jejich pořadí v polyproteinu je pro pikornaviry specifické. Kapsida pikornavirů je postavena ze tří až čtyř specifických typů proteinů.
Dá se na pikornaviry dívat jako na monofyletickou skupinu? — Viry se nerozmnožují pohlavně, takže vnímání příbuznosti je u nich jiné, ale pikornaviry určitě mají společný původ. To je zjevné z podobností ve struktuře jejich genomu. Na začátku byl nějaký virus, který zkombinoval několik dobrých nápadů týkajících se RNA, IRES a kapsidových proteinů. Ale třeba sekvenční podobnost je uvnitř čeledi pikornavirů malá. Můžete mezi nimi najít viry, které budou mít v odpovídajících proteinech menší než desetiprocentní shodu v aminokyselinových sekvencích. Sekvence aminokyselin je odlišná, ale výsledné proteiny mají podobnou prostorovou strukturu a stejnou funkci. Je zajímavé pozorovat evoluci, která je u těchto virů velmi rychlá.
 Jsou náchylné k mutacím? — Jejich genom tvoří RNA, která se nikdy nepřepisuje do DNA, ale pouze z varianty „+“ do komplementární varianty „–“. A RNA polymeráza (enzym zajišťující syntézu RNA, pozn. red.) se od DNA polymerázy liší tím, že nemá proof-reading aktivitu. Pokud zařadí chybný nukleotid, nevrátí se a neopraví to. Její chybovost je někde mezi 10–3 a 10–4, kdežto u DNA polymerázy to je asi 10–8. To znamená, že každý jednotlivý virus s genomem dlouhým 10 000 nukleotidů nese v průměru deset mutací.
Jsou náchylné k mutacím? — Jejich genom tvoří RNA, která se nikdy nepřepisuje do DNA, ale pouze z varianty „+“ do komplementární varianty „–“. A RNA polymeráza (enzym zajišťující syntézu RNA, pozn. red.) se od DNA polymerázy liší tím, že nemá proof-reading aktivitu. Pokud zařadí chybný nukleotid, nevrátí se a neopraví to. Její chybovost je někde mezi 10–3 a 10–4, kdežto u DNA polymerázy to je asi 10–8. To znamená, že každý jednotlivý virus s genomem dlouhým 10 000 nukleotidů nese v průměru deset mutací.
Z toho aby se imunitní systém napadeného organismu zbláznil. — No právě, virus neexistuje jako jeden druh definovaný nějakou ideální sekvencí. Na infekci se nepodílejí identické kopie jednoho viru, ale obrovské množství mutantů. Mluví se o kvazidruzích. Proto třeba proti nachlazení nejsou žádné opravdu účinné léky. Ve chvíli, kdy lék podáte, jsou v těle už připraveny rezistentní varianty viru. Pikornaviry jsou velice dobře schopny adaptovat se na různé podmínky. Platí za to tím, že většina mutantů má sníženou schopnost přežít, protože mnoho mutací je škodlivých.
Ale to jim asi moc nevadí, ne? — Nevadí. Množí se rychle, vždycky nějaký funkční virus zůstane.
 Používá se vůbec ve virologii nějaká definice druhu? — Používá. Když se izoluje nový virus z pacienta nebo ze zvířete, popíše se na základě sekvence. A s nástupem metod next generation sequencing je možno i popsat pravděpodobnost, s níž se u toho viru vyskytují různé varianty. Jsou pak různé definice určující, jak moc se nový virus musí od těch už známých lišit, aby mohl být označen za nový druh.
Používá se vůbec ve virologii nějaká definice druhu? — Používá. Když se izoluje nový virus z pacienta nebo ze zvířete, popíše se na základě sekvence. A s nástupem metod next generation sequencing je možno i popsat pravděpodobnost, s níž se u toho viru vyskytují různé varianty. Jsou pak různé definice určující, jak moc se nový virus musí od těch už známých lišit, aby mohl být označen za nový druh.
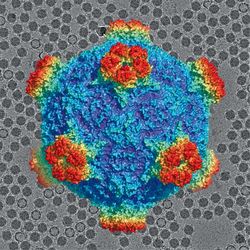
Jak si kapsidu pikornavirů na proteinové úrovni představit? — Kapsida má ikosahedrální strukturu, má tedy pravidelný tvar. Dvacet identických stěn, každá s trojčetnou symetrií, takže se v kapsidě šedesátkrát opakuje stejný motiv, což při studiu struktury s výhodou využíváme. Podjednotku u pikornavirů tvoří tři hlavní proteiny, u některých je ještě jeden doplňkový. Celkový počet proteinů v kapsidě je proto vždy troj- nebo čtyřnásobek šedesáti.
Mgr. Pavel Plevka, Ph.D. (*1979)
Vystudoval molekulární biologii a virologii na Přírodovědecké fakultě Univerzity Karlovy (2002), doktorské studium strukturní biologie dokončil v roce 2009 na Uppsala University ve Švédsku. Další čtyři roky působil u Michaela Rossmanna na Purdue University v USA. Od července 2013 vede výzkumnou skupinu strukturní virologie ve Sředoevropském technologickém institutu (CEITEC ) při Masarykově univerzitě v Brně. V roce 2016 vyhrál Cenu Neuron pro mladé vědce, udělovanou Nadačním fondem Neuron. Na výzkum struktury lidských pikornavirů získal pro roky 2014–2018 prestižní startovací grant Evropské výzkumné rady (ERC ), fágy napadající zlatého stafylokoka studuje v rámci juniorského grantu GA ČR (2015–2017). Disponuje také grantem Evropské organizace pro molekulární biologii (EMBO, 2015–2017). „Ten není tak velký jako grant ERC , ale je u něj skvělé, že ty peníze jsou naprosto flexibilní,“ říká. Věnuje se i virům napadajícím včelstva (blízkým příbuzným pikornavirů). Letos začíná pracovat na dalším grantu GA ČR, díky němuž se zaměří na flaviviry, konkrétně na původce klíšťové encefalitidy a na virus zika.
Co na struktuře kapsidy vlastně studujete? Čím se jednotlivé pikronaviry mezi sebou liší, když všechny mají stejný, matematicky jednoduše popsatelný geometrický tvar? — U virů, které infikují lidi nebo obecně živočichy s imunitním systémem, je různorodost virů dána tím, že se snaží utéct před adaptivním imunitním systémem. Máte- li protilátky proti jednomu typu nachlazení, při následující infekci vám to není nic platné, protože další virus má jiný povrch kapsidy. Na druhou stranu se virus potřebuje navázat na specifické buněčné receptory. Takže nemůže zmutovat tak moc, že by tuto schopnost ztratil. Při studiu pikornavirů se dozvídáme, jak konkrétní virus vyřešil tento problém – nutnost být natolik unikátní, aby ho imunitní systém nerozpoznal, a zároveň natolik konzervativní, aby byl schopen vazby na receptory. A také musí být stabilní, nesmí se v mimobuněčném prostředí samovolně rozpadat. Na povrchu kapsidy jsou navíc proteiny zajišťující rozrušení membrány chránící vnitřní prostředí buňky. Ať už jde o buněčnou membránu, nebo o membránu endozomu, pokud se virus do buňky dostal endocytózou, což je časté.
Snažíte se ale také poznat způsob, jakým kapsida interaguje s genomem pikornaviru. — Molekula RNA je v kapsidě zabalena jen jedna, takže nemůže kopírovat symetrii kapsidy. Jednou z velkých otázek biologie pikornavirů proto je, jak genom uvnitř viru vypadá, jak je tam poskládaný.
Proč to potřebujete vědět? — Je to důležité, protože genom se z virové partikule musí nějak dostat, má-li infikovat buňku. A to, jak se genom z kapsidy uvolňuje, není úplně jasné. Například zmíněná struktura IRES obsahuje dvouvláknové smyčky RNA. Pokud v této podobě existuje i uvnitř viru, musí se v kapsidě udělat poměrně velký otvor, aby se RNA mohla dostat ven. Kdyby tam byla jen jednovláknová RNA, otvor může být mnohem menší. Znalost uspořádání genomu uvnitř viru je tedy důležitá pro pochopení procesu infekce.
Ví se, zda je RNA ve všech virových částicích smotána stejně? — Ani to se neví. Je docela dobře možné, že IRES nebo jiné struktury jsou vždy stejné, ale jejich relativní pozice uvnitř viru jsou jiné a zbytek RNA je strukturovaný v každé virové částici unikátně.
Motivuje vás praktické využití v terapii? K virům jste se dostal díky nápadu léčit jimi rakovinu, nyní můžete k léčbě nemocí skutečně přispět… — Má skupina se věnuje čistě základnímu výzkumu. Ale pokud určíme strukturu viru, je potom snazší studovat jeho komplex s nějakým léčivem. Strukturní informace představuje klíč k tomu, jak navrhnout léčiva, která se na virus budou vázat a bránit mu v replikaci. V tomto smyslu má strukturní biologie blízko k vývoji léčiv, ale není to cíl naší práce. Pokud se nějaký virus způsobující závažná onemocnění začne v populaci šířit, budeme se snažit ho studovat a jako první určit jeho strukturu. Ale vývoj terapeutických látek v rámci akademické laboratoře není reálný. Toho se musí chopit farmaceutické firmy.
Nestudujete pouze pikornaviry, ale například také Leishmania RNA virus 1, který se množí v parazitickém prvokovi.1) Na svém webu píšete, že virus umožňuje leishmanii uniknout před lidským imunitním systémem. Jak to dělá? — Leishmanie je vnitrobuněčný parazit. Když ji pohltí makrofág, dokáže v jeho fagozomu přežít. Nastává boj mezi ní a makrofágem, kdo vydrží déle. V každém případě občas některý z prvoků umře. Pokud je prvok infikován virem, uvolní se z viru jeho dvouvláknová RNA. Makrofág ji detekuje a dojde k závěru, že je napaden virem. A spustí imunitní reakci proti virům, která ale není účinná proti prvokům. Takže makrofágy útočí na falešné cíle a leishmanie v nich mohou lépe přežívat.2)
To je pěkný příklad spolupráce dvou nepříbuzných organismů – budeme-li tedy po vašem vzoru považovat virus za organismus. — V tomto případě je to trochu složitější. Leishmania RNA virus 1 je s leishmanií reprodukčně svázaný. Není znám případ, že by se z jedné leishmanie přenesl na druhou. Buď v příslušném kmeni prvoka přítomen je, nebo není. Pokud ho dceřiná buňka ztratí, neexistuje způsob, jak by ho mohla opět získat. Takže vůbec není zřejmé, zda se na tento virus máme dívat jako na nezávislý organismus, nebo na funkční součást leishmanií.
Loni jste v PNAS publikovali článek týkající se bakteriofága, který napadá zlatého stafylokoka. To je výlet ke zcela odlišné skupině virů. Co vás k fágům a konkrétně k tomuto viru přivedlo? — Buňky zlatého stafylokoka jsou maličké, menší než Escherichia coli. Mají průměr asi jeden mikrometr, takže jsem doufal, že do nich bude vidět kryoelektronovou mikroskopií a budeme moci sledovat procesy spojené s množením fága uvnitř bakterie. To se tak docela nepotvrdilo, buňky jsou pořád moc velké, nicméně jsme u nich už zůstali. A pro fága infikujícího zlatého stafylokoka jsme se rozhodli i proto, že fágy infikující gramnegativní bakterie jako E. coli jsou dobře prostudované, kdežto o fázích infikujících grampozitivní bakterie, jako je právě Staphylococcus aureus, se toho ví málo. Navíc zlatý stafylokok způsobuje relativně vážná lidská onemocnění a bývá rezistentní vůči antibiotikům. Pro pochopení biologie fágů to samozřejmě není důležité, ale pomůže nám to publikovat naše výsledky v lepších časopisech.
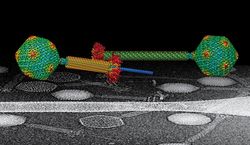
Bakteriofágy jsou pro laika fascinující už tím, jak vypadají. Vždy mi připomínaly přistávací modul Apolla. Vy jste studovali „injekční stříkačku“, s jejíž pomocí „váš“ fág dopravuje svou DNA do bakterie. Na co jste přišli? — Naše zjištění doufám není omezeno jen na toho jednoho bakteriofága, ale pravděpodobně bude platit pro celou čeleď Myoviridae. Bakteriofágy z této rodiny mají dvouvrstvý kontraktilní bičík. Vnější vrstva, bičíková pochva, se zkracuje, čímž fág dosahuje onoho efektu injekční stříkačky: centrální trubička provrtá bakteriální stěnu jako jehla. Fág musí bakterii najít, rozpoznat, navázat se na její povrch a spustit mechanismus uvolnění DNA skladované v hlavičce. My jsme ukázali, že pro uvolnění DNA je zapotřebí nejen kontrakce bičíkové pochvy, ale také strukturní změna centrální trubičky a krčku, který rozhoduje o tom, zda DNA hlavičku opustí. Zjistili jsme tedy, že regulace uvolnění fágové DNA do bakterie je dvoukroková.
Jak by tyto poznatky šlo terapeuticky využít v boji s rezistentními kmeny zlatého stafylokoka? — V žádné ze západních zemí zatím není fágová terapie schválena (Vesmír 85, 750, 2006/12 a 86, 520, 2007/8). Bakteriofág je netypické léčivo, a proto je považován za riziko. Je živý, může mutovat. Má obrovský genom, funkci některých jeho genů stále neznáme. Poznáme-li detailně strukturu fágů, přispějeme k jejich lepšímu pochopení a potenciálně i ke snížení rizik spojených s fágovou terapií. Bakterie se samozřejmě snaží fágové infekci bránit. Mění svůj povrch, aby se na ně fágy nedokázaly vázat. Budeme-li znát strukturu fágového proteinu, který rozpoznává receptor na povrchu bakterie, můžeme ten protein měnit. Budeme pak schopni připravit geneticky modifikované fágy, které se budou vázat na takové povrchy, na jaké budeme chtít.
Strukturní biologie by nemohla existovat bez metod, které vám umožňují objekty vašeho zájmu studovat. Jednou z nich je rentgenová krystalografie. Znamená to, že se viry chovají jako krystaly? — Rentgenová krystalografie je primární metoda, pomocí které se dozvídáme o struktuře makromolekul, a donedávna to byla i hlavní metoda pro studium struktury virů. Využívá se toho, že některé viry jsou krásně pravidelné, a to jim umožňuje tvořit krystaly. Strukturu krystalů studujeme pomocí rentgenového záření, s vlnovou délkou kolem jednoho angströmu (desetiny nanometru, pozn. red.), která odpovídá vzdálenostem mezi atomy v molekule. Na periodické struktuře krystalu pak dochází k difrakci a v určitých směrech se produkuje zesílené rentgenové záření. Na detektoru signál změříme a následně spočítáme, jak vypadá struktura, na níž k difrakci došlo.
Jak krystaly z virů připravujete? — Nachystáme si vyčištěný virus, z něj připravíme množství drobných kapek a v každé z nich namícháme jiné složení roztoku. Do jedné dáme jeden druh soli, do další jiný, měníme pH a iontovou sílu roztoků. Takto otestujeme stovky nebo tisíce podmínek a s trochou štěstí se v některé z kapek začnou krystaly viru tvořit. Tisíce podmínek, to je spousta práce.
Předpokládám, že netrávíte dny a noci pipetováním. — Naštěstí ne, máme na to robotiku.
Trochu jsem se bál, že řeknete: „Máme na to studenty.“ — Student by možná fungoval stejně dobře. Výhoda robotiky je ale v tom, že dokáže přesně pipetovat mnohem menší objemy roztoků než student, takže šetříme materiál.
A také nebohé studenty. Říkal jste, že rentgenová krystalografie byla donedávna hlavní metodou studia struktury virů. Už to neplatí? — Ve strukturní biologii proběhla revoluce. Metoda, která v posledních třech nebo pěti letech krystalografii z velké části nahradila, je kryoelektronová mikroskopie. Zasloužilo se o to zvýšení kvality elektromagnetických čoček mikroskopů i detektorů pro elektrony. Kryoelektronová mikroskopie dnes poskytuje podobné rozlišení jako krystalografie, přičemž není třeba připravovat krystaly, takže potřebujeme mnohem menší množství materiálu.
Od tradiční elektronové mikroskopie se už podle názvu liší využitím nízkých teplot. — Tradiční elektronová mikroskopie používá barvení těžkými kovy. Kryoelektronová mikroskopie se bez nich obejde. Vzorky se velmi rychle v tenké vrstvě zamrazí, takže voda nestihne vykrystalizovat. Získáme viry uvězněné v amorfním ledu, jehož struktura je velmi podobná tekuté vodě. A v něm viry pozorujeme přímo. Využíváme skutečnosti, že hustota proteinů se od hustoty okolní vody trochu liší, takže při zobrazení mírně mimo ideální zaostření vzniká v obrázku kontrast.
Zmínil jste, že ani do malých buněk zlatého stafylokoka se vám takto nahlédnout nepodařilo. Kryoelektronovou mikroskopii lze tedy využít jen pro studium izolovaných virových částic? — Když chceme studovat viry ve vysokém rozlišení, musíme je studovat mimo buňku. Buď samotné, nebo například v komplexu s izolovanými molekulami receptorů nebo s protilátkami. U virů můžeme využít skutečnosti, že všechny částice jednoho druhu viru vypadají stejně. Takže jich můžeme vyfotit několik desítek tisíc a pak z nich počítat rekonstrukci, jako by to všechno byly obrázky jedné virové částice v různých orientacích. Každá buňka je však unikátní a takto u ní postupovat nelze. Musíme využívat tomografii a rozlišení, které získáme, je horší. Ale zase vidíme, co se děje v buňce, což je samozřejmě zajímavé. Kryoelektronová mikroskopie se však stále vylepšuje a v budoucnu dost možná půjde studovat viry a makromolekuly přímo v buňce.
Takže díky technickému pokroku dnes můžete získat poznatky, které by ještě před několika lety nebyly myslitelné? — Je to tak. A netýká se to jen virologie, ale obecně strukturní biologie. Třeba chápání toho, jak funguje ribozom, je dnes úplně jiné než v době, kdy bylo třeba ribozomy krystalizovat.
Pořád se bavíme o pozorování virových struktur. Jak moc se dají přímo vypočítat ze znalosti sekvence dědičné informace? Nešlo by určit pořadí aminokyselin ve virových proteinech a v počítači namodelovat, jak kapsida přesně vypadá? — Naštěstí ne. Predikovat strukturu proteinů na základě sekvence zatím nejde.
Naštěstí pro vás, nebo pro vědu? — Pro nás jako strukturní biology. Kdyby struktury šlo spočítat, tak naši laboratoř můžeme zavřít. Pro bioinformatiky a pro zbytek lidstva je to samozřejmě špatné, protože výpočet by byl levnější a rychlejší než experimentální určování struktur.
Myslíte, že ještě nějaký ten rok můžete být v klidu? — Skládání proteinů do trojrozměrné struktury stále dostatečně nerozumíme. Ten systém je velmi komplexní, hraje v něm roli mnoho faktorů a současnými metodami ho ani nelze dobře studovat. Víme například, že hydrofobní aminokyseliny nebudou na povrchu proteinu, ale potřebujeme znát více pravidel. Existuje bezpočet možností trojrozměrného uspořádání proteinů. Takže myslím, že zatím můžeme být v klidu.
Poznámky
1) O leishmanii (česky ničivce) více v článku Jovany Sádlové a Jana Votýpky Jak zničit ničivku, Vesmír 93, 280, 2014/5.
2) O nutnosti vhodné volby imunitních zbraní více v seriálu o imunologii (Vesmír 96, 74, 2017/2).
Ke stažení
 článek ve formátu pdf [387,31 kB]
článek ve formátu pdf [387,31 kB]
O autorovi
Ondřej Vrtiška


























