Buněčná senescence
Zhruba před 700 miliony let dostal život nový rozměr. A to doslova. Objevily se první mnohobuněčné organismy, které těžily z ekonomických výhod kolektivní velikosti a možnosti specializovat jednotlivé buňky na různé činnosti. Díky tomu se záhy úspěšně prosadily v konkurenčním prostředí a dodnes jsou dominantami ve většině ekosystémů. Mnohobuněčnost, stejně jako jakékoliv jiné kolektivní soužití, má však i své stinné stránky. Jednotlivé buňky už nedokážou přežívat samostatně a stávají se plně závislými na fungování organismu jako celku. Žijí si ve stabilním vnitřním prostředí, mají stálý přísun energie a na oplátku vykonávají vysoce specializovanou činnost. Veškerý jejich osud je určován shora a podřízen zájmům celku. Tak extrémní prostředí samozřejmě může fungovat pouze tehdy, pokud nikdo nepodvádí. A protože život je boj, podvodníci, kteří by chtěli zadarmo čerpat sociální výhody, se vždycky najdou. Jsou to rakovinné buňky.
Rakovinné bujení je jedním ze zásadních problémů, se kterými se mnohobuněčné organismy musí vyrovnat. I v dospělém organismu, který už neroste, se totiž určité druhy buněk pořád dělí, aby zajistily krvetvorbu, obnovu epitelů, regeneraci tkání a zarůstání ran. Jejich dělení je přísně kontrolováno a v podstatě na objednávku. Rakovinné buňky mají ve své DNA mutace, kterými této kontrole uniknou, a dělí se živelně a samoúčelně. Tím samozřejmě ohrožují fungování celku. Proto si mnohobuněčné organismy během své evoluce vytvořily řadu mechanismů, které jim to bezuzdné množení mají překazit.
 Nejznámějším, nejelegantnějším a také pro vědu nejdříve objeveným je tzv. Hayflickův limit. Ten funguje asi takhle: Každá buňka v sobě má metr, ze kterého si při každém dělení ustřihne jeden dílek. Když už není co stříhat, spustí se mechanismy, které buňce další dělení zakážou. Jediné buňky, pro které zákon neplatí, jsou buňky pohlavní. Ty se samozřejmě musí dělit dál, aby daly vzniknout novému organismu. Dílků, které lze ustřihnout, je asi padesát, to je ten Hayflickův limit. Pro normální fungování organismu padesát dělení stačí, pro vznik rakoviny to je málo. A stříhaný metr není nic menšího než volné konce chromozomů zvané telomery. Faktorem, který způsobuje, že pohlavním buňkám se metr nezkracuje, je enzym telomeráza, který zkrácené telomery po každém buněčném dělení zase prodlužuje.
Nejznámějším, nejelegantnějším a také pro vědu nejdříve objeveným je tzv. Hayflickův limit. Ten funguje asi takhle: Každá buňka v sobě má metr, ze kterého si při každém dělení ustřihne jeden dílek. Když už není co stříhat, spustí se mechanismy, které buňce další dělení zakážou. Jediné buňky, pro které zákon neplatí, jsou buňky pohlavní. Ty se samozřejmě musí dělit dál, aby daly vzniknout novému organismu. Dílků, které lze ustřihnout, je asi padesát, to je ten Hayflickův limit. Pro normální fungování organismu padesát dělení stačí, pro vznik rakoviny to je málo. A stříhaný metr není nic menšího než volné konce chromozomů zvané telomery. Faktorem, který způsobuje, že pohlavním buňkám se metr nezkracuje, je enzym telomeráza, který zkrácené telomery po každém buněčném dělení zase prodlužuje.
Za objev telomerázy, telomer, jejich zkracování a významu pro rakovinu byla roku 2009 udělena Nobelova cena za fyziologii a medicínu. Tím ale celá záležitost neskončila. Ukázalo se, že buňky, kterým bylo další dělení zakázáno, nekončí jen tak někde zapomenuty na skládce, ale získávají nový specifický fenotyp zvaný senescence.
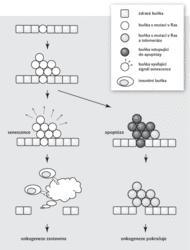
Jejich hlavním znakem je, že produkují do svého okolí značné množství signálních molekul, především volných radikálů a cytokinů. Tím přilákají buňky imunitního systému, které je následně odklidí (fagocytují). Důvod, proč buňky vstupují do senescence a nechávají se odklidit imunitním systémem, místo aby spáchaly buněčnou sebevraždu (apoptózu), která se obvykle používá k likvidaci nepotřebných buněk a nepotřebuje žádnou asistenci, není zřejmý na první pohled. Nesmíme však zapomenout, že nádorová buňka nevznikne hned tak na zelené louce.
Většina odborníků se shoduje, že úspěšná rakovinná buňka musí ve své DNA shromáždit alespoň deset konkrétních mutací v konkrétních genech. Toho nikdy nelze dosáhnout náhodným akumulováním mutací v jedné buňce. Předpokládá se, že onkogeneze (vznik rakoviny) obvykle postupuje tak, že nějaká buňka získá nešťastnou náhodou (nepřesným přepisem, působením karcinogenů) mutaci, která jí umožňuje vymknout se kontrole a začít se samoúčelně množit. Stane se tak zakladatelem populace buněk, které tuto mutaci nesou. Tato populace, základ budoucího nádoru, se množí tak dlouho, dokud nenarazí na některou z protirakovinných bariér, které v sobě má připravené, třeba na Hayflickův limit. Tam většina buněk své množení zastaví a přejde do senescence.
Pokud však během růstu kolonie alespoň jedna buňka získá mutaci, která jí umožní bariéru překonat, onkogeneze běží dál. Například Hayflickův limit lze překonat tak, že rakovinná buňka v sobě aktivuje zapovězený enzym telomerázu. Kdyby v ten okamžik všechny buňky, které nepřekonaly bariéru, spáchaly apoptózu, vypadalo by to, jako že se nic neděje. Původní kolonie nesoucí jednu mutaci by zmizela a postupně by ji nahradila nová kolonie, pocházející z buňky nesoucí dvě mutace. Tak by to pokračovalo až do okamžiku, kdy by rakovinné buňky překonaly všechny bariéry a dostaly se zcela mimo kontrolu.
Naštěstí je tu senescence. Buňky, které narazí na Hayflickův limit a neumějí ho obejít, začnou signalizovat, že se tu děje něco podivného. Přilákají buňky imunitního systému, které je nejen fagocytují, ale když už tam jsou, rovnou zkontrolují i jejich sousedy. Když tam senescentních buněk najdou víc, spustí poplach a vyčistí celé okolí včetně schovaných rakovinných buněk se dvěma mutacemi. Tím se onkogeneze zastaví hned v počátcích. Senescence je tedy chytrý poplašný signál, vlastně určitá forma buněčného udavačství, označující možná ložiska rakovinného bujení.
Výzkum senescence je starý více než padesát let, ale až poslední dobou, kdy se podařilo charakterizovat jeho molekulární podstatu, příčiny a následky, se dostal do popředí zájmu vědců. Opravdu zajímavé výsledky nám přinesly pokusy na laboratorních zvířatech, u nichž byla schopnost senescence modifikována metodami genového inženýrství. Asi nejvíc pozornosti vzbudily experimenty s délkou telomer a telomerázou. První ukázal, že myši se zkrácenými telomerami, a tedy i velmi nízkým Hayflickovým limitem, sice nikdy neonemocněly rakovinou, zato stárly mnohem rychleji a také dříve umíraly než kontrolní zvířata. Druhý experiment zase sledoval přežívání myší, jejichž všechny buňky měly zapnutou telomerázu, tudíž pro ně Hayflickův limit vůbec neplatil. U těchto myší se objevovaly četné nádory již v mladém věku, ale ty, co náhodou rakovině unikly, stárly mnohem pomaleji než normální zvířata. Vypadalo to, že mezi rychlostí stárnutí a výskytem rakoviny je nepřímá úměra a že je za ni odpovědná senescence.
V té době se vědělo, že stárnutí a s ním spojené choroby jsou charakterizovány zvýšenou (i když špatně cílenou) aktivitou imunitního systému a masovým odumíráním buněk, ale příčina tohoto jevu nebyla známa. Teorií vysvětlujících stárnutí bylo hned několik a všechny vycházely z předpokladu, že jde o pasivní důsledek celoživotní akumulace chyb v organismu, například hromadění nespecifických mutací, oxidačního poškození či nerozpustných proteinových agregátů. Senescence vše obrátila naruby. Stále více vědců nyní akceptuje teorii, že stárnutí je předem připravený program, který naše tělo ochraňuje před rakovinou.
Mělo by to fungovat asi takto: Jak běží čas, stále více buněk naráží na Hayflickův limit a stále více buněk někde přijde k mutaci, která jim přikazuje se neomezeně množit. Proto v tkáni přibývá senescentních buněk, lákajících aktivované buňky imunitního systému, které pak okolo sebe šíří zkázu. V tkáni se pozvolna vyčerpávají zásoby buněk schopných dalšího dělení a zároveň se rozjíždí chronický zánět. To všechno vede ke známým příznakům stárnutí. Úbytek svalové hmoty, zhoršené hojení ran, artróza kloubů a pokles psychické výkonnosti vedoucí až k různým demencím jsou způsobeny celkovým nedostatkem buněk v tkáni i jejich sníženou schopností se podle potřeby dělit. Obezita, diabetes a choroby srdce a cév jsou spíše důsledkem chronického zánětu tkáně. A protože senescentních buněk je ve stárnoucím organismu opravdu hodně, imunitní systém je už nelikviduje tak účinně a zvyšuje se pravděpodobnost, že někde proběhne kompletní onkogeneze. Proto se i přes veškerou zničující snahu zvyšuje ve stáří riziko vzniku rakoviny. Pořád ale platí, že pokud by senescence byla vypnutá a stárnutí neprobíhalo, rakovina by se v organismu objevila mnohem dříve.
Tento objev udělal čáru přes rozpočet vědcům pokoušejícím se rozkrýt tajemství dlouhověkosti a vyléčit nemoci spojené se stářím. Znamená to snad, že si musíme vybrat mezi stárnutím a rizikem rakoviny? Najde se způsob, který by lidem umožnil prodloužit aktivní fázi života tak, že by zpomalil stárnutí a oddálil nástup s ním spojených chorob včetně rakoviny? Připomínám, že vzhledem k demografické situaci ve vyspělých státech je tento výzkum vnímán jako vysoce prioritní. Jak z bludného kruhu ven?
Cestu naznačila další rafinovaná zvířecí studie. Vědci tentokrát sledovali přežívání myší, které měly zároveň zesílenou aktivitu tří genů. Dva z nich se zapínaly při senescenci a utvrzovaly buňku, že je opravdu potřeba vyslat varovný signál. Třetí z nich byla naše známá telomeráza, která posouvala Hayflickův limit o něco dál. Buňky tedy vysílaly signál senescence při sebemenším podezření na onkogenezi, ale ty, které byly v pořádku, zase měly povolení dělit se víckrát, než je obvyklé. Myší organismus tedy tvrdě trestal sebemenší odchylku od normy, zato konformní buňky plující ve středním proudu byly vyzdvihovány. Myši s touto genetickou manipulací žily o polovinu déle než ty obyčejné. Unikly onkogenezi i stárnutí.
Jenže jak tyto výsledky využít? Doba zatím nedozrála k tomu, aby člověk podstupoval tak složité genetické manipulace. Nehledě na to, že celý přístup může mít vedlejší účinky, které zatím nebyly objeveny, třeba průběžné resetování paměti v mozku. Přinejmenším ale teď víme, že řešení existuje. Otevřela se tím cesta k nalezení způsobu, jak léčit, nebo aspoň jak oddalovat starosti spojené se stárnutím. Vzhledem k tomu, že se blíží doba, kdy lidé budou nastupovat do práce na prahu třicítky a do důchodu budou odcházet po sedmdesátce, o něj jistě bude zájem.
Literatura
Collado M. et. al.: Senescence in tumours: evidence from mice and humans. Nat. Rev. Cancer 10, 51–57, 2010; doi: 10.1038/nrc2772.
Tomás-Loba A. et. al.: Telomerase reverse transcriptase delays aging in cancer-resistant mice. Cell 135, 6098–622, 2008/4.
Ke stažení
 článek ve formátu pdf [542,59 kB]
článek ve formátu pdf [542,59 kB]















