Autofagie ve vztahu k nemoci
| 13. 1. 2011Stálost vnitřního prostředí buňky je udržována řadou hierarchicky uspořádaných mechanismů. Jsou-li mechanismy narušeny, mění se růst a vývoj buněk, což může vést k závažným patologickým stavům. Jedním z těchto procesů je vyrovnaná bilance proteinů, která spočívá v rovnováze mezi jejich syntézou a degradací. Mechanismus tvorby bílkovin (proteosyntézy) je všeobecně znám, horší je to s jejich rozkladem (proteolýzou), přestože má pro buňku i organismus význam přinejmenším stejně velký.
 Procesy rozpadu v buňce lze rozdělit do několika skupin. Obecně se dá říci, že za běžných podmínek vnějšího prostředí je rozpad buněčných proteinů nezávislý na lyzozomech. Tento typ degradace probíhá v proteazomech po předchozím označení proteinů určených k likvidaci. Značkou určující typ a povahu rozpadu bývá buď ubikvitin (viz Vesmír 84, 73, 2005/2), nebo jemu podobné proteiny. Rozkladem v proteazomu jsou odbourávány proteiny s krátkou životností. Délka života jednotlivých proteinů se totiž liší v závislosti na jejich N-koncovém zbytku. Aminokyseliny jako methionin, serin, alanin, treonin, valin, glycin nebo cystein proteiny stabilizují, a tím se prodlužuje jejich poločas rozpadu na více než 20 hodin. Naopak proteiny bohaté na prolin nebo kyselinu glutamovou jsou rozloženy již za 10–30 minut (viz tab. I).
Procesy rozpadu v buňce lze rozdělit do několika skupin. Obecně se dá říci, že za běžných podmínek vnějšího prostředí je rozpad buněčných proteinů nezávislý na lyzozomech. Tento typ degradace probíhá v proteazomech po předchozím označení proteinů určených k likvidaci. Značkou určující typ a povahu rozpadu bývá buď ubikvitin (viz Vesmír 84, 73, 2005/2), nebo jemu podobné proteiny. Rozkladem v proteazomu jsou odbourávány proteiny s krátkou životností. Délka života jednotlivých proteinů se totiž liší v závislosti na jejich N-koncovém zbytku. Aminokyseliny jako methionin, serin, alanin, treonin, valin, glycin nebo cystein proteiny stabilizují, a tím se prodlužuje jejich poločas rozpadu na více než 20 hodin. Naopak proteiny bohaté na prolin nebo kyselinu glutamovou jsou rozloženy již za 10–30 minut (viz tab. I).
Zejména při hladovění se uplatňuje lyzozomální rozklad proteinů – autofagie. Ta ovšem plní i další role. Pomineme-li vstřebávání (endocytózu a pinocytózu) pomáhající odstranit mimobuněčné proteiny, zbývá autofagie jako jediný známý mechanismus rozkladu vysokomolekulárních nitrobuněčných proteinů a organel.
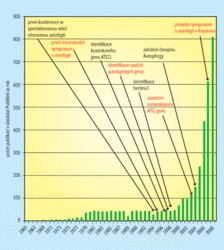
 Evolučně je autofagie velmi stará, má tedy velký význam pro nižší i vyšší organismy. Slovo je odvozeno z ř. „auto“ a „phagy“ (sám sebe jíst), jeho význam je však mnohem komplexnější, zejména u vyšších organismů. Výzkumu autofagie se věnuje značná pozornost a počet vědeckých publikací na toto téma výrazně stoupá (tab. II, obr. 1). Rozklad proteinů je jedním z mechanismů podílejících se na stárnutí a smrti buňky.
Evolučně je autofagie velmi stará, má tedy velký význam pro nižší i vyšší organismy. Slovo je odvozeno z ř. „auto“ a „phagy“ (sám sebe jíst), jeho význam je však mnohem komplexnější, zejména u vyšších organismů. Výzkumu autofagie se věnuje značná pozornost a počet vědeckých publikací na toto téma výrazně stoupá (tab. II, obr. 1). Rozklad proteinů je jedním z mechanismů podílejících se na stárnutí a smrti buňky.
V tomto širším kontextu je třeba také autofagii chápat. Od roku 1858, kdy Virchow poprvé popsal buněčnou smrt, kterou nazval nekróza, vznikla řada klasifikačních systémů. V dnešní době se nejčastěji používá klasifikace typů buněčné smrti podle P. G. Clarka z roku 1990, i když je pochopitelné, že se jednotlivé typy buněčné smrti mohou vzájemněprolínat. Navíc od té doby byly objeveny další typy buněčné smrti. Clark rozlišuje buněčnou smrt podle morfologických charakteristik na typ I (apoptózu), typ II (autofagii) a typ III (nekrózu/onkózu).1) Apoptóza je spojena s kolapsem cytoskeletárních struktur a štěpením DNA v časných fázích buněčné smrti. Organely degradují až v pozdějších fázích.U autofagie je tomu naopak. Organely se rozpadají v raných fázích, cytoskeletární systém později. Rovněž aktivita kaspáz jako jeden ze základních znaků programované buněčné smrti je časově oddělena. U apoptózy se projevuje časně, u autofagie v pozdějších fázích. Na rozdíl od nekrózy nejsou apoptóza ani autofagie provázeny zánětlivou odezvou.
Tři typy autofagie
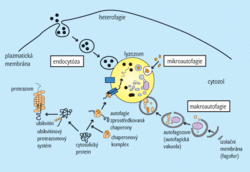
- Makroautofagie organely autofagozomy. Ty vznikají poté, coje neselektivní proces rozpadu proteinů, na němž se podílejí buněčné je část buněčného obsahu uzavřena membránou. Pak splynou autofagozomy s lyzozomy za vzniku autolyzozomů (autofagolyzozomů), v nichž probíhá hydrolýza bílkovin.
- Mikroautofagie. Při ní jsou likvidovány jen cytosol, inkluze (jako glykogen) a organely (např. ribozomy nebo peroxizomy), a to vchlípením lyzozomální membrány.
- Autofagie zprostředkovaná chaperony (viz Vesmír 77, 15, 1998/1). Rozpadají se cytoplazmatické proteiny obsahující konzervativní pentapeptidový motiv KFERQ. Tyto proteiny jsou přepravovány přes lyzozomální membránu, kde se vážou na lyzozomálně asociovaný membránový protein (viz obr. 2).
Molekulární mechanismy autofagie
 Na autofagii se podílí aktivita kinázy mTOR (zapíná a vypíná autofagické dráhy podle nutričního stavu buněk), eukaryotický iniciační faktor 2α (eIF2 ), kinázy Gcn2 a transkripční transaktivátor Gcn4. Dalšími významnými autofagickými procesy jsou vznik, zrání a recyklace autofagozomů. Podílejí se na nich především proteiny Atg (kódované geny Atg), popř. jejich kvasinková obdoba Vps. Všechny tyto procesy jsou podmíněny tvorbou: komplexu serin/threoninových kináz (zprostředkovává indukční signály), kinázového komplexu (podílí se na tvorbě membránových struktur vedoucích ke vzniku autofagozomů), proteinového komplexu (podílí se na zvětšování autofagozomů) a komplexu proteinů zajišťujícího recyklaci proteinů Atg ze zralých autofagozomů.
Na autofagii se podílí aktivita kinázy mTOR (zapíná a vypíná autofagické dráhy podle nutričního stavu buněk), eukaryotický iniciační faktor 2α (eIF2 ), kinázy Gcn2 a transkripční transaktivátor Gcn4. Dalšími významnými autofagickými procesy jsou vznik, zrání a recyklace autofagozomů. Podílejí se na nich především proteiny Atg (kódované geny Atg), popř. jejich kvasinková obdoba Vps. Všechny tyto procesy jsou podmíněny tvorbou: komplexu serin/threoninových kináz (zprostředkovává indukční signály), kinázového komplexu (podílí se na tvorbě membránových struktur vedoucích ke vzniku autofagozomů), proteinového komplexu (podílí se na zvětšování autofagozomů) a komplexu proteinů zajišťujícího recyklaci proteinů Atg ze zralých autofagozomů.
Role autofagických procesů
- Fyziologický význam. Autofagie probíhá za fyziologických podmínek a nevede nutně k zániku buňky. Jde o evolučně velmi starý jev, jímž je eukaryotickým buňkám zajišťována především recyklace intracelulárních proteinů. Z fylogenetického hlediska jde o adaptační mechanismus nutný k přežívání za nepříznivých podmínek, a to jak extracelulárních (nedostatek živin, hypoxie, vysoká teplota), tak intracelulárních (nahromadění poškozených nebo nadbytečných organel). V podmínkách hladovění se rozpadají proteiny, nukleové kyseliny a organely (peroxizomy, mitochondrie, endoplazmatické retikulum) na nukleotidy, aminokyseliny a volné mastné kyseliny, a tím se obnovuje syntéza makromolekulárních látek i energetického metabolismu. U mnohobuněčných organismů má autofagie zvláštní význam a podílí se na regulaci embryonálního a novorozeneckého vývoje. Rovněž má význam v odezvě na nedostatek živin, v kontrole růstu buněk, v mechanismech zpomalujících stárnutí a imunitních reakcích. Podílí se také na odstraňování poškozených a nadbytečných proteinů, což má význam zejména při vzniku neurogenerativních onemocnění. Nezastupitelná je její úloha v tkáňově specifických funkcích nebo při nitrobuněčné biosyntéze povrchově aktivních molekul u pneumocytů či při biosyntéze neuromelaninu.
- Autofagie v patologii. S autofagozomálními procesy se pojí etiopatogeneze řady chorob nervového a svalového systému, popř. chorob infekčních. Velký význam má autofagie v karcinogenezi.
- Autofagie v neurogenerativních onemocněních, myopatiích a infekcích. Odumírání nervových buněk je běžný proces, který se vyskytuje během ontogeneze nebo je důsledkem patologických neurodegenerativních procesů. Přestože nejlépe prostudovaným typem buněčné smrti u neurodegenerativních chorob je apoptóza, byly uvedeny rovněž příklady účasti autofagické buněčné smrti. Při neurogenerativních chorobách (Parkinsonově nemoci, Huntingtonově nemoci či při spinocerebrální ataxii) hraje významnou roli nahromadění poškozených či toxických proteinů (např. huntingtinu a α-synukleinu) do agrezomů. Funkce těchto agregátů není ještě objasněna, neví se, zda působí toxicky, či naopak chrání, popřípadě zda není jejich význam pro neurodegenerativní onemocnění neutrální. Jisté však je, že se autofagie na odstranění těchto nežádoucích proteinů podílí. S akumulací autofagických a lyzozomálních vakuol jsou spojena některá dědičná svalová onemocnění, např. Danonova choroba.2)
 Autofagické procesy se podílejí na rozpadu nitrobuněčných patogenů, zahrnujících bakterie3) i viry.4) Také mohou být zapojeny při zneškodňování mimobuněčných patogenů, např. streptokoků. Dále má autofagie význam pro průnik některých bakterií do hostitelských tkání. Replikace a virulence bakterie způsobující brucelózu skotu5) a bakterie podílející se na paradontóze u člověka6) jsou pravděpodobně spojeny s jejich lokalizací v pozdních autofagozomech (amfizomech). Nejčastěji se o vztahu autofagie a infekci hovoří v souvislosti s tuberkulózou (autofagie umožňuje zneškodnit mykobakterie ve fagozomech). Významnou úlohou autofagie je její role v transportu cytoplazmatických antigenů v procesech antigenní prezentace hlavního histokompatibilního komplexu II u adaptivní imunity (viz např. Vesmír 78, 565, 1999/10). V některých případech se podílí také na přežívání nebo odumírání T-buněk imunitního systému.
Autofagické procesy se podílejí na rozpadu nitrobuněčných patogenů, zahrnujících bakterie3) i viry.4) Také mohou být zapojeny při zneškodňování mimobuněčných patogenů, např. streptokoků. Dále má autofagie význam pro průnik některých bakterií do hostitelských tkání. Replikace a virulence bakterie způsobující brucelózu skotu5) a bakterie podílející se na paradontóze u člověka6) jsou pravděpodobně spojeny s jejich lokalizací v pozdních autofagozomech (amfizomech). Nejčastěji se o vztahu autofagie a infekci hovoří v souvislosti s tuberkulózou (autofagie umožňuje zneškodnit mykobakterie ve fagozomech). Významnou úlohou autofagie je její role v transportu cytoplazmatických antigenů v procesech antigenní prezentace hlavního histokompatibilního komplexu II u adaptivní imunity (viz např. Vesmír 78, 565, 1999/10). V některých případech se podílí také na přežívání nebo odumírání T-buněk imunitního systému. - Autofagie a nádory. Podstatou nádorového onemocnění je nekontrolované množení buněk v nejrůznějších tkáních a orgánech. Růst nádoru zahrnuje dvě odchylky od normálního stavu: povzbuzení podnětů k množení buněk a potlačení buněčné smrti. Je známo, že nádory vykazují poškození apoptotických drah. U nádorů byly ovšem zaznamenány také změny drah vedoucích k neapoptotickému typu buněčné smrti, z nichž autofagie patří k nejvýznamnějším.
O souvislosti mezi autofagickou buněčnou smrtí a nádorovým onemocněním se v poslední době často diskutuje. Během růstu nádoru jsou nádorové buňky vystaveny metabolickému stresu v důsledku narušeného nebo nedostatečného cévního zásobení živinami, růstovými faktory a kyslíkem. Nádory překonávají tyto metabolické stresy tím, že v hypoxických částech nádoru spouštějí autofagii. Bylo prokázáno, že různé typy nádorů vykazují různý stupeň autofagické aktivity. Snížení autofagické degradace transformovaných buněk oproti netransformovaným bylo prokázáno například u nádorů jater, slinivky břišní a prsu. Naopak vysokou autofagickou aktivitu vykazovaly buňky nádorů tlustého střeva a plic. Navíc bylo prokázáno, že autofagická aktivita vzrůstá během přechodu z prekancerózního stavu do stavu nádorového. Na stupni autofagie se tedy podepisuje nejen původ nádorových buněk, ale také jejich diferenciační stav. Není zcela jasné, zda autofagie působí jako mechanismus bránící vzniku nádorů, nebo zda se podílí na jejich růstu. Víme však, že autofagie způsobuje adaptaci na metabolický stres jak u nádorových, tak u normálních buněk. Proto v poslední době převažuje názor, že autofagie může působit jako mechanismus bránící hromadění poškozených proteinů, organel a DNA, čímž rozvoj nádoru potlačuje. Situace ovšem není zdaleka tak jednoznačná. Autofagie se významně podílí na využití živin u rychle se množících nádorových buněk, které se nacházejí v hypoxickém nebo metabolickém stresu. Může se také podílet na degradaci mitochondrií, které spouštějí apoptotické dráhy buněčné smrti. V neposlední řadě působí autofagie jako protektivní mechanismus před poškozením buňky volnými radikály tím, že odstraňuje organely, které jsou zdrojem nebo cílem působení reaktivních iontů. Všechny tyto funkce autofagie hovoří spíše o její úloze při podpoře růstu a přežívání nádorových buněk. Obecně přijatou hypotézou je, že zpočátku autofagie spíše vývoj nádoru potlačuje, kdežto v pokročilých stadiích spíše podporuje jeho růst.
Vztahy autofagie s apoptózou
Další otázkou, která se nabízí při studiu autofagického typu buněčné smrti, jsou její vztahy s apoptózou. Jde o procesy, které působí spolu, proti sobě, nebo se navzájem neovlivňují? Ani tato otázka není uspokojivě vyřešena. V roce 1997 publikovali L. Jia a jeho kolegové práci, která se zabývala vztahem autofagické a apoptotické smrti buňky v buňkách T-lymfoblastické leukemie. Práce prokázala, že potlačením tvorby autofagozomů lze bránit štěpení DNA a rozpuštění buněk. Když však byla autofagie potlačena v pozdějších fázích, ochranný efekt nebyl pozorován. To potvrzuje domněnku, že uzavření cytoplazmatického obsahu do autofagozomu během autofagie je podmínkou pro apoptózu, a tedy cestou k potlačení růstu nádoru. Pozdější studie C. Bauvyho a jeho spolupracovníků však prokázala zvýšenou citlivost buněk linie HT-29 (odvozené od karcinomu tlustého střeva) k apoptóze u buněk, které měly sníženou autofagickou aktivitu.
Tyto závěry dokládají, že autofagie může brzdit apoptózu pravděpodobně tím, že odstraní mitochondriální faktory zprostředkovávající smrt buněk. Třetí možností vzájemného vztahu autofagie a apoptózy je, že se typy buněčné smrti „přepínají“. Například autofagie u buněk zhoubného gliomu potlačená bafilomycinem A1 vede k apoptóze a zablokování apoptózy inhibitorem kaspáz u neuronů vede naopak k autofagickému odstranění mitochondrií.
Naskýtá se otázka, zda by se modulace autofagických drah nedala využít v protinádorové terapii. Existuje široké spektrum látek a postupů spouštějících autofagii v systémech in vitro: tamoxifen u buněčných linií odvozených z karcinomu prsu, trioxid arzeničitý u buněk maligního gliomu a další. A co nabízejí vztahy mezi autofagií a apoptózou? Ovlivňování proteinů podílejících se na apoptóze zvyšuje účinek protinádorové léčby i přežívání pacientů. Vzhledem k četným genetickým změnám apoptotických drah by mohla aktivovaná autofagie kupříkladu zvýšit terapeutický efekt nebo překonat lékovou rezistenci. Autofagie přesahuje do různých dějů ovlivňujících život organismu – a každý z přesahů by zasluhoval samostatný článek.
Tento výzkum byl podpořen grantem MŠM 619 895 9216
Literatura
Virchov R. L. K.: Die Cellularpathologie in ihrer Begründung auf physiologische und pathologische Gewenbenlehre, Hirchwald, Berlin 1859
Kroemer G. et al.: Classification of cell death, Cell Death and Differentiation 16, 3–11, 2009
Schmid D., Munz C.: Iannate and adaptive immunity through autophagy, Immunity 27, 11–21, 2007
Jia L. et al.: Inhibition of autophagy abrogates tumor necrosis factor alpha induced apoptosis in human T-lymphoblastic leukaemic cells, Br. J. Haematol 98, 673–685, 1997
Bauvy C. et al.: Autophagy delays sulindac sulfide-induced apoptosis in the human colon cancer cell line HT-29, Exp. Cell Res. 268, 39–149, 2001
Poznámky
1) V roce 2009 doporučila terminologická komise pro buněčnou smrt rozšířit tyto základní typy o mitotickou katastrofu, anoikis, exitotoxicitu, walleriánskou degeneraci, paraptózu, pyroptózu, pyronekrózu, entózu a kornifikaci. V těchto případech jde ovšem o typy buněčné smrti vyskytující se ve specifických buněčných nebo tkáňových systémech.
2) Jde o hypertrofickou kardiomyopatii s mírnou mentální retardací. Onemocnění vzniká v důsledku mutace genu lamp2a. Bylo prokázáno, že u dědičného svalového onemocnění – Danonovy choroby – nesplynou autofagické vakuoly s lyzozomy.
3) Např. Shigella flexneri a Mycobacterium tuberculosis.
4) Alfaviry a Herpes simplex.
5) Brucella abortus.
6) Porfyromonas gingivalis.
OVLIVŇOVÁNÍ AUTOFAGICKÝCH DRAH
Prvním přístupem ve farmakologickém využití modulace autofagických drah je ovlivňování dráhy mTOR rapamycinem. Rapamycin je vhodný pro dlouhodobou terapii při odmítání transplantované ledviny a jeho analoga jsou ve třetí fázi zkoušení pro léčbu gliomů a pokročilých karcinomů ledvin. Preklinické a klinické zkoušky prokázaly, že také deriváty rapamycinu mohou být efektivní při potlačování růstu širokého spektra nádorů (maligních gliomů, nádorů prsu, karcinomu ledvin a dalších). Účinnost této protinádorové terapie může být zvyšována ozařováním, chemoterapií i antiangiogenní terapií. Autofagie může být v některých případech vyvolána mechanismem nezávislým na dráze mTOR, a to snížením hladiny inositol-1,4,5-trifosfátů. Na této možnosti je založena terapie lithiem, carbamezapinem a valproátem sodným, které snižují aktivitu inositolového metabolismu. Tyto látky jsou rovněž používány v dlouhodobé terapii.
Ke stažení
 článek ve formátu pdf [584,93 kB]
článek ve formátu pdf [584,93 kB]















