Zabít, nebo tolerovat?
Úkolem imunitního systému je chránit organizmus před mikroby a pomáhat při odstraňování některých poškozených buněk. Základními zbraněmi imunity jsou: fagocyty (požírají mikroby a jiné cizorodé částice), komplement (sérové proteiny, které se mohou na cizorodé částice navázat a přispět k jejich odstranění), lektiny (proteiny, které se vážou na sacharidové struktury mikroorganizmů), protilátky (imunoglobuliny), cytotoxické a NK-lymfocyty (vyhledávají a zabíjejí virově infikované a snad i nádorové buňky) a pomocné T-lymfocyty (pomáhají jiným buňkám imunitního systému vyrábět protilátky nebo vyvolávat zánět či zabíjet mikroorganizmy). Má-li tento systém fungovat, musí rozeznávat, co je organizmu vlastní a co je mu cizí. Děje se to několika způsoby:
- Fagocyty mají na povrchu molekuly, které rozeznávají chemické struktury přítomné pouze na mikrobech, ale ne na vlastních buňkách. Krom toho mají receptory, které umožňují rozeznávat částice obalené protilátkami.
- Většina B-lymfocytů produkujících protilátky, které reagují se strukturami v organizmu, je eliminována během vývoje v kostní dřeni.
- NK-buňky poznají vadnou buňku podle toho, že má na povrchu abnormálně málo proteinů MHC.
- Cytotoxické a pomocné T-lymfocyty, které by svými povrchovými receptory rozeznávaly zdravé vlastní buňky, jsou odstraněny během vývoje v brzlíku.
Galerie peptidů na povrchu buňky
Při obraně proti virům i jiným parazitům v buňce mají velký význam T-lymfocyty. Rozeznávají infikované buňky díky proteinům MHC. Ty vystavují na povrchu téměř všech buněk organizmu vzorky fragmentů proteinů, které buňka syntetizuje. Je to jakási galerie tisíců komplexů proteinů MHC (obrázek). A T-lymfocyty se specializují právě na rozeznávání těchto komplexů. Používají k tomu povrchové T-receptory, které jsou strukturou podobné protilátkám. Jestliže je buňka zdravá, má na povrchu jen normální komplexy proteinů MHC s peptidy, a proto Tlymfocyty buňku ignorují (ty, které by ji neignorovaly, byly zahubeny již v brzlíku). Jestliže však je buňka infikována (např. virem), objevují se na jejím povrchu komplexy MHC-proteinů s virovými peptidy. Ty už specifické T-lymfocyty vnímají jako cizorodé. Imunitní systém takto infikované buňky neléčí, ale rovnou je zabíjí. Dokonce se někdy stává, že útok T-lymfocytů infikovanou tkáň poškodí víc, než by ji poškodil samotný virus. V populaci existují proteiny MHC v mnoha formách, které se liší jen tím, jaké peptidové fragmenty vážou. Díky tomu nemůže virus uniknout imunitnímu systému tak, že by se žádné peptidové fragmenty z jeho proteinů na proteiny MHC nenavázaly. Na druhé straně je právě rozmanitost proteinů MHC příčinou problémů při orgánových transplantacích. Spektrum normálních komplexů proteinů MHC a peptidových fragmentů je u geneticky odlišných jedinců různé. Když transplantujeme ledvinu, T-lymfocytům geneticky odlišného příjemce se transplantát jeví jako infikovaný a snaží se jej zničit. Tato nežádoucí aktivita příjemcova imunitního systému se tlumí léky potlačujícími obrannou reakci (imunospresivy).
V populaci existují proteiny MHC v mnoha formách, které se liší jen tím, jaké peptidové fragmenty vážou. Díky tomu nemůže virus uniknout imunitnímu systému tak, že by se žádné peptidové fragmenty z jeho proteinů na proteiny MHC nenavázaly. Na druhé straně je právě rozmanitost proteinů MHC příčinou problémů při orgánových transplantacích. Spektrum normálních komplexů proteinů MHC a peptidových fragmentů je u geneticky odlišných jedinců různé. Když transplantujeme ledvinu, T-lymfocytům geneticky odlišného příjemce se transplantát jeví jako infikovaný a snaží se jej zničit. Tato nežádoucí aktivita příjemcova imunitního systému se tlumí léky potlačujícími obrannou reakci (imunospresivy).
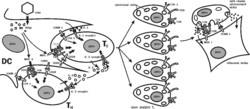 Aby T-lymfocyty vyvinuly obrannou reakci proti infikovaným buňkám, musí naivní T-lymfocyty (ty, které se ještě nesetkaly s antigenem) nejprve rozeznat komplex proteinů MHC s virovým peptidem na povrchu specializovaných buněk vystavujících ve své „galerii“ antigen, 1) a teprve po kontaktu s těmito buňkami se T-lymfocyt probudí z naivního spánku a začne se dělit a diferencovat (obrázek). Nejlepšími vystavovateli antigenu jsou dendritické buňky, obsažené ve většině tkání a v lymfatických uzlinách.
Aby T-lymfocyty vyvinuly obrannou reakci proti infikovaným buňkám, musí naivní T-lymfocyty (ty, které se ještě nesetkaly s antigenem) nejprve rozeznat komplex proteinů MHC s virovým peptidem na povrchu specializovaných buněk vystavujících ve své „galerii“ antigen, 1) a teprve po kontaktu s těmito buňkami se T-lymfocyt probudí z naivního spánku a začne se dělit a diferencovat (obrázek). Nejlepšími vystavovateli antigenu jsou dendritické buňky, obsažené ve většině tkání a v lymfatických uzlinách.
Jak obelstít imunitní systém
Výsledkem spolupráce buněk prezentujících antigen a T-lymfocytů jsou klony tisíců zralých efektorových buněk (buď cytotoxického, nebo pomocného typu), které odpovídají na podráždění receptoru. Ty mohou začít napadat infikované tkáně. Efektorové T-lymfocyty žijí jen několik dní; z některých však vzniknou paměťové T-lymfocyty, které v těle zůstanou pro případ opakované infekce.Cytotoxické T-lymfocyty mají na povrchu protein CD8, kdežto pomocné T-lymfocyty protein CD4. Oba proteiny (koreceptory) spolupracují s receptory Tlymfocytů při rozpoznávání proteinů MHC.
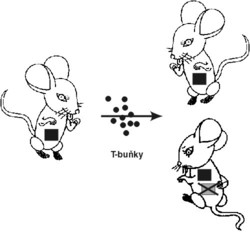 T-receptory byly definovány teprve r. 1983 a fakt, že MHC-proteiny vážou peptidové fragmenty, byl potvrzen až v letech 1985–87. Funkce T-lymfocytů se začala studovat asi před 30 lety (viz též J. Plachý, Vesmír 76, 425, 1997/8 a Vesmír 76, 489, 1997/9). Šlo o to pochopit jejich úlohu při virových infekcích a potlačit nežádoucí transplantační odhojovací reakce. Jako model sloužila často transplantace kousků kůže z myší jednoho inbredního kmene (geneticky uniformního, vzniklého příbuzenskou plemenitbou) na myši jiného inbredního kmene. Brzy se ukázalo, že imunitní systém lze obelstít a navodit imunologickou toleranci. Když se příjemcův imunitní systém experimentálně oslabí ozářením či imunosupresivy, v některých případech si na cizorodý transplantát „zvykne“. Transplantát z kmene A byl tak tolerován příjemcem z kmene B. Jestliže se tolerantnímu příjemci transplantoval druhý kousek kůže z kmene A, byl tolerován i ten. Nebyl však tolerován transplantát z odlišného kmene C (obrázek), tj. nebyla pouze celkově oslabena imunita. Tuto specifickou toleranci bylo možno prostřednictvím T-lymfocytů přenést do naivního zvířete kmene B. Také sekundární příjemce pak toleroval transplantáty z kmene A, aniž bylo třeba oslabovat jeho imunitní systém. Obzvlášť účinně se specifická transplantační tolerance dala navodit u novorozených myší. Tyto jevy byly vysvětlovány existencí zvláštních, tlumivých (supresorových) Tlymfocytů.
T-receptory byly definovány teprve r. 1983 a fakt, že MHC-proteiny vážou peptidové fragmenty, byl potvrzen až v letech 1985–87. Funkce T-lymfocytů se začala studovat asi před 30 lety (viz též J. Plachý, Vesmír 76, 425, 1997/8 a Vesmír 76, 489, 1997/9). Šlo o to pochopit jejich úlohu při virových infekcích a potlačit nežádoucí transplantační odhojovací reakce. Jako model sloužila často transplantace kousků kůže z myší jednoho inbredního kmene (geneticky uniformního, vzniklého příbuzenskou plemenitbou) na myši jiného inbredního kmene. Brzy se ukázalo, že imunitní systém lze obelstít a navodit imunologickou toleranci. Když se příjemcův imunitní systém experimentálně oslabí ozářením či imunosupresivy, v některých případech si na cizorodý transplantát „zvykne“. Transplantát z kmene A byl tak tolerován příjemcem z kmene B. Jestliže se tolerantnímu příjemci transplantoval druhý kousek kůže z kmene A, byl tolerován i ten. Nebyl však tolerován transplantát z odlišného kmene C (obrázek), tj. nebyla pouze celkově oslabena imunita. Tuto specifickou toleranci bylo možno prostřednictvím T-lymfocytů přenést do naivního zvířete kmene B. Také sekundární příjemce pak toleroval transplantáty z kmene A, aniž bylo třeba oslabovat jeho imunitní systém. Obzvlášť účinně se specifická transplantační tolerance dala navodit u novorozených myší. Tyto jevy byly vysvětlovány existencí zvláštních, tlumivých (supresorových) Tlymfocytů.
Tabu slušné imunologické společnosti
Převažovalo mínění, že některé supresorové buňky tlumí aktivitu pomocných T-lymfocytů, jiné aktivitu cytotoxických T-buněk. Byly popisovány tlumivé faktory, které údajně vyměšovaly tlumivé T-lymfocyty. Tyto faktory měly rozeznávat antigeny, tj. měly být jakousi rozpustnou formou T-receptorů. Krom toho byly popisovány nespecifické tlumivé faktory (dnes bychom řekli cytokiny). Přesto se stále nedařilo izolovat tlumivé buňky v čistém stavu a odlišit je od cytotoxických T-lymfocytů, ani spolehlivě biochemicky charakterizovat jimi vylučované tlumivé faktory. Jako významný pokrok se proto jevil objev molekuly, která byla údajně pouze na povrchu tlumivých T-lymfocytů. Zmíněný specifický znak byl nazván IJ; gen kódující tento protein byl lokalizován do genového komplexu MHC, v němž jsou soustředěny geny kódující MHC-proteiny. Byly popisovány tlumivé faktory, jejichž jednu podjednotku údajně tvořil protein I-J. Většina těchto prací byla založena na použití myších protilátek získaných imunizací myší kmene 5R buňkami myší kmene 3R; zmíněné kmeny se podle genetických údajů měly lišit právě jen v oblasti genu kódujícího záhadný protein I-J. V 70. a 80. letech bylo o těchto pozoruhodných regulačních buňkách publikováno více než tisíc vědeckých prací. Mezi jejich autory byli nejlepší světoví imunologové, včetně několika nositelů Nobelovy ceny. Tímto výzkumem však v první polovině 80. let otřásly výsledky sekvencování genového komplexu MHC na myším 17. chromozomu: ukázalo se, že tam, kde měl být gen I-J (mapovaný klasickými genetickými metodami), ve skutečnosti žádný gen nebyl. Zároveň se ukázalo, že fyzicky neexistují ani dva další geny (I-B a I-C), které s ním měly sousedit a o nichž se předpokládalo, že se také účastní regulace imunitní odpovědi. Počet vědeckých prací věnovaných tlumivým T-buňkám klesl téměř na nulu a výraz „supresorová T-buňka“ se stal ve slušné imunologické společnosti tabu.Shodou okolností právě v té době několik laboratoří ukázalo, jak je většina těch klonů T-lymfocytů, které by mohly být autoreaktivní, odstraňováno už v brzlíku. Zjistilo se také, že autoreaktivní T-lymfocyty, které svému osudu v brzlíku uniknou, upadají za určitých okolností po setkání s autoantigenem do stavu naprosté letargie, v němž nemohou projevit své škodlivé sklony. Zdálo se, že těmito dvěma mechanizmy lze vysvětlit téměř všechny významné aspekty imunologické tolerance. Aktivní mechanizmy založené na tlumivých buňkách byly odloženy jako nepotřebné. Jevy, na jejichž základě byly tlumivé Tbuňky popsány, však nebylo možno jednoduše smést se stolu. A tak se po několika letech hypotéza tlumivých buněk otřepala z porážky a začala se pomalu vracet na scénu.
Očištěná pověst tlumivých buněk
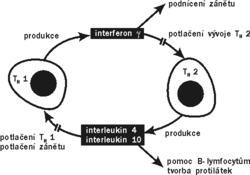
Několik imunologů zjistilo, že tlumivé T-buňky by mohly být prostě funkčně umlčené buňky, jejichž tlumivé působení je založeno na tom, že ostatním Tbuňkám vyjídají růstové faktory a cytokiny. Později se objevila teorie regulace imunitních dějů prostřednictvím dvou druhů pomocných T-buněk (TH1 a TH2), podle níž první pomocné buňky silně podporují zánětlivé reakce, které jsou podstatnou složkou odhojování transplantátů, druhé hlavně pomáhají B-lymfocytům vyrábět protilátky. Podstatné je, že cytokiny (imunitní regulační hormony, viz M. Lipoldová, Vesmír 71, 509, 1992/9) produkované TH2 buňkami silně brzdí vývoj a aktivitu buněk TH1, a naopak cytokiny TH1 brzdí buňky TH2. Jako supresorové T-lymfocyty by tedy mohly působit buňky TH2, které by prostě svými cytokiny (interleukinem-4 a interleukinem-10) tlumily buňky TH1, a tím potlačovaly odhojování transplantátů. Později byly identifikovány ještě pomocné T-lymfocyty TH3, které produkují obzvlášť účinnou směs cytokinů tlumících vývoj TH1, ale i cytotoxických T-buněk, a podporují produkci protilátek IgA. Za normálních okolností buňky TH3 zřejmě klíčovým způsobem regulují imunitní odpovědi na sliznicích a brání tomu, aby sliznice nebyly poškozovány záněty.Experimentální postupy, které byly původně popsány pro povzbuzení tlumivých buněk a navození stavu imunologické tolerance, by tak selektivně vyvolávaly pomnožení a aktivaci klonů typu TH2 nebo TH3, a tím automaticky brzdily aktivaci klonů typu TH1. V tomto pojetí by pak „transplantační“ tlumivé T-buňky byly totožné s buňkami TH2, či spíše TH3. Tento názor dnes převládá (viz obrázek).
 Zatímco tlumivé buňky se dočkaly určité rehabilitace, jejich údajné antigenně spcifické produkty (tlumivé faktory) se očištění nedočkaly – dosud nikdo nevyklonoval geny, které by je měly kódovat. V posledních letech se však objevilo několik publikací, které naznačují, že by snad přece mohly existovat nějaké formy rozpustných T-receptorů působících jako tlumivé faktory.
Zatímco tlumivé buňky se dočkaly určité rehabilitace, jejich údajné antigenně spcifické produkty (tlumivé faktory) se očištění nedočkaly – dosud nikdo nevyklonoval geny, které by je měly kódovat. V posledních letech se však objevilo několik publikací, které naznačují, že by snad přece mohly existovat nějaké formy rozpustných T-receptorů působících jako tlumivé faktory.
Infekční tolerance T-buněk
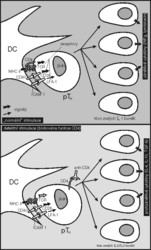
Počátkem 90. let skupina Hermana Waldmanna v Oxfordu zjistila, že transplantační toleranci lze u myší a potkanů navodit monoklonálními protilátkami vázajícími se na koreceptory T-buněk CD4 a CD8. Tyto protilátky (na rozdíl od jiných imunosupresiv) nepůsobí úbytek T-lymfocytů. Zdá se, že navázáním na koreceptorovou molekulu pouze blokují její normální funkci, takže příslušný T-lymfocyt dostane po rozeznání antigenu jen neúplný signál. Dáme-li dospělému experimentálnímu zvířeti kmene B injekci protilátek proti CD4 a zároveň mu transplantujeme kousek kůže z geneticky odlišného kmene A, transplantát se odhojí buď mnohem později, nebo vůbec. Dokonalého přežívání transplantátu se dá docílit i při značných genetických rozdílech mezi kmeny A a B, a to jedinou injekcí protilátky. Vypadá to jako úžasně jednoduché navození trvalé tolerance.Takto navozenou toleranci lze přenést na dalšího příjemce. Jestliže se T-buňky (CD4) z tolerantního zvířete přenesou do naivního příjemce, jemuž je opět transplantován kousek kůže z kmene A, po několika týdnech je možno odebrat druhému tolerantnímu zvířeti T-lymfocyty, injikovat je dalšímu naivnímu jedinci a transplantovat mu kousek kůže kmene A. To lze opakovat nejméně desetkrát za sebou a v každé generaci je dosaženo dokonalé tolerance (obrázek). Důležité je, že kromě prvního zvířete v experimentu už u dalších nejsou použity tlumivé protilátky proti CD4 či CD8. Po několika opakovaných přenosech již mezi přenášenými buňkami nejsou žádné buňky z prvního zvířete. Přitom tolerovány jsou nejen transplantáty z kmene A, ale i transplantáty z kříženců kmene A a nějakého geneticky úplně odlišného kmene C. Když ale transplantujeme na zvíře kmene B tolerizované proti kmeni A dva oddělené kousky kůže z kmenů A a C, udrží se jen kousek z kmene A, zatímco kousek z kmene C je rychle odhojen. Zdá se, že přenášené tlumivé buňky v novém příjemci vyvolávají vznik buněk stejných vlastností, tj. „infikují“ naivní T-buňky a dělají z nich buňky tlumivé.
Nejpřijatelnější vysvětlení je založeno na kombinaci několika základních imunologických principů: Dostane-li první zvíře transplantát a zároveň dostatečnou dávku blokující protilátky proti CD4, rozeznají jeho T-lymfocyty příslušné cizorodé antigeny na povrchu dendritických buněk vystavujících antigen (viz obrázek). V této úvodní fázi, kdy se rozhoduje o tom, jak budou T-buňky na rozeznání antigenu reagovat, zabrání protilátka anti-CD4 účasti molekuly CD4 na přenosu signálu. T-buňka tak dostane pozměněný signál, který způsobí, že se začne dělit a diferencovat na buňku typu TH2 či TH3. Za normálních okolností by se diferencovala na TH1, která by pak v transplantátu vyvolala destruktivní zánět (viz obrázek). Tento mechanizmus (viz rámeček) také vysvětluje, proč bude jakýkoli další příjemce tolerovat i transplantát pocházející z křížence kmenů A a C. Je tomu tak proto, že na buňkách vystavujících antigen se v takovém transplantátu budou shlukovat naivní Tbuňky, z nichž některé rozeznávají antigeny A, jiné antigeny C, ale všechny budou ve stejném cytokinovém prostředí vytvořeném přenesenými buňkami TH2/TH3. Když ale jednomu zvířeti dáme dva oddělené transplantáty, jeden z kmene A a druhý z kmene C, přenesené buňky TH2/TH3 se budou hromadit a vytvářet potřebné „tolerogenní“ cytokinové prostředí jen v transplantátu A, nikoli v transplantátu C. (V něm bude nerušeně probíhat vývoj prozánětlivých buněk typu TH1, které nakonec způsobí jeho odhojení.)
 Z neznámých důvodů protilátky (anti-CD4) fungují nejlépe u myší a potkanů. Transplantační centra se nemohou dopustit žádného riskantního zákroku na lidech – ostatně úspěšnost transplantací je vysoká, standardní imunosupresiva fungují docela dobře. Bohužel je však pacient musí brát doživotně, a tím je celkově oslaben jeho imunitní systém. Klinické pokusy spočívají jen v modifikacích standardního postupu. Takovou modifikací by tedy bylo použití anti-CD4 navíc k běžně používanému imunosupresivu (např. cyklosporin A). Ale to jsou přesně podmínky, za nichž anti-CD4 nemůže fungovat! Princip použití této protilátky je totiž založen na tom, že Tbuňky normálně fungují – jsou-li brzděny standardním léčivem, účinek protilátky se nemůže projevit. Takže na případné klinické využití těchto vědecky neobyčejně zajímavých objevů si asi budeme muset ještě počkat. Zatím probíhají klinické studie použití anti-CD4 v léčbě některých autoimunitních onemocnění.
Z neznámých důvodů protilátky (anti-CD4) fungují nejlépe u myší a potkanů. Transplantační centra se nemohou dopustit žádného riskantního zákroku na lidech – ostatně úspěšnost transplantací je vysoká, standardní imunosupresiva fungují docela dobře. Bohužel je však pacient musí brát doživotně, a tím je celkově oslaben jeho imunitní systém. Klinické pokusy spočívají jen v modifikacích standardního postupu. Takovou modifikací by tedy bylo použití anti-CD4 navíc k běžně používanému imunosupresivu (např. cyklosporin A). Ale to jsou přesně podmínky, za nichž anti-CD4 nemůže fungovat! Princip použití této protilátky je totiž založen na tom, že Tbuňky normálně fungují – jsou-li brzděny standardním léčivem, účinek protilátky se nemůže projevit. Takže na případné klinické využití těchto vědecky neobyčejně zajímavých objevů si asi budeme muset ještě počkat. Zatím probíhají klinické studie použití anti-CD4 v léčbě některých autoimunitních onemocnění.
 Zbývá také ještě otázka, jestli se nově omilostněné tlumivé T-buňky uplatňují i při normální regulaci tolerance vůči autoantigenům, nebo jestli jsou to jen jakési experimentální artefakty vyvolané nepřirozenými zásahy. Zdá se, že jsou.
Zbývá také ještě otázka, jestli se nově omilostněné tlumivé T-buňky uplatňují i při normální regulaci tolerance vůči autoantigenům, nebo jestli jsou to jen jakési experimentální artefakty vyvolané nepřirozenými zásahy. Zdá se, že jsou.
Zdánlivě chytré hypotézy
Historie kolem tlumivých T-buněk, I-J a tlumivých faktorů poodhalila některé negativní stránky toho, jak se někdy lehkomyslně přejímají svůdně znějící hypotézy. Určitě se neblaze projevilo i to, že před 15–20 lety zdaleka nebyly metody molekulární biologie na dnešní úrovni. Dnes je nemyslitelné, aby se příliš spekulovalo o nějakém „faktoru“, aniž by byl klonován a důkladně molekulárně charakterizován. Pozoruhodná byla i tabuizace tématu, když se ukázalo, že s tlumivými buňkami je něco v nepořádku. Celkově ale ona aféra přinesla i něco pozitivního – lidé si znova připomněli, že musí být trochu opatrnější s přejímáním zdánlivě chytrých hypotéz a že se v biologických vědách neobejdeme bez solidních molekulárních základů. Doufejme, že se přece jen dočkáme praktického využití znalostí o oněch regulačních T-buňkách při transplantacích či léčbě autoimunitních onemocnění a snad také naopak při imunoterapii nádorových onemocnění. 2) , 3)Poznámky
Pravděpodobný mechanizmus vzniku „infekční tolerance“
Regulační buňky vylučují cytokiny (IL-4, IL-10. TGF-β), které brání rozvoji zánětu a diferenciaci prozánětlivých TH1. Přeneseme-li regulační buňky do nového příjemce, který dostane stejný transplantát jako první příjemce, přenesené regulační buňky TH2 nebo TH3 se shluknou okolo buněk vystavujících antigen, rozeznají cizorodé antigeny a začnou vylučovat tlumivé cytokiny. Zároveň se kolem stejných buněk vystavujících antigen začnou shlukovat příjemcovy naivní T-buňky a poznávat cizorodé antigeny. Pod vlivem cytokinového prostředí vytvořeného přenesenými buňkami TH2 či TH3 se začnou diferencovat opět na buňky typu TH2/TH3, a nikoli TH1 – tj. tato směs cytokinů má na vývoj naivních, antigenně specifických T-buněk shodou okolností podobný vliv jako protilátka blokující funkci CD4. Po nějaké době se tedy v novém příjemci namnoží opět antigenně specifická populace TH2/TH3, která chrání transplantát před útokem TH1, a tu zase můžeme přenést do dalšího příjemce, kde v přítomnosti transplantátu vyvolá opět vznik tlumivých buněk.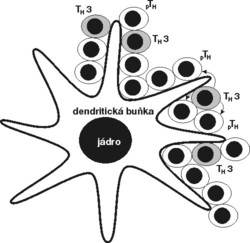
Ke stažení
 DATA A SOUVISLOSTI - Imunitní systém [1,07 MB]
DATA A SOUVISLOSTI - Imunitní systém [1,07 MB] Článek ve formátu PDF [432,55 kB]
Článek ve formátu PDF [432,55 kB]
O autorovi
Václav Hořejší
















