Ribozom – továrna na proteiny
Jedním ze základních buněčných procesů je translace. Při translaci, jak název napovídá, je informace zapsaná v pořadí nukleotidů mRNA překládána do sekvence aminokyslin proteinů. Hlavní továrnou na výrobu proteinů jsou u prokaryot i eukaryot ribozomy. Proteiny v buňkách obstarávají většinu práce, a proto se jejich vzniku věnovala vždy velká pozornost. Stranou nezůstala ani komise pro udělování Nobelovy ceny, za translaci jich udělila hned několik. Jednu z nich obdrželi v roce 1968 Robert Holley, Gobind Khorana a Marshall Nirenberg za rozluštění genetického kódu. Další, spojenou s ribozomem, dostali v roce 1974 Albert Claude, Christian de Duve a George E. Palade za rozvoj elektronové mikroskopie a ultracentrifugačních technik.1)
Roku 2009 obdrželi Nobelovu cenu za chemii Ada E. Yonathová, Venkatraman Ramakrishnan a Thomas A. Steitz za své „studie struktury a funkce ribozomu“ (viz životopisný rámeček). Odpověděli na otázky: Jak získat strukturu velkého nesymetrického makromolekulárního komplexu? Jak dosahuje ribozom své spolehlivosti při překladu mRNA do proteinu? Jak vzniká peptidická vazba (je její tvorba katalyzována proteinem, nebo RNA)?
Cesta za strukturou
Skupiny Yonathové, Ramakrishnana i Steitze získaly nezávisle na sobě trojrozměrné struktury malé a velké podjednotky prokaryotického ribozomu s přesností, která umožňovala určit polohu valné většiny atomů celé podjednotky (s výjimkou vodíkových atomů).
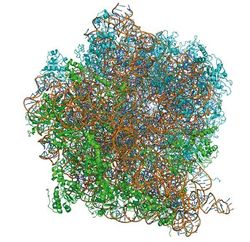
 Struktury malé i velké podjednotky byly určeny rentgenovou krystalografií. Nutnou a často obtížně splnitelnou podmínkou pro použití rentgenové krystalografie je získání krystalu sloučeniny, proteinu či komplexu proteinů, které chceme studovat. Krystal si lze představit jako naprosto pravidelné, často symetrické uspořádání až tisíců miliard molekul. Podmínky, za kterých látky krystalizují, nejsou dosud podrobně objasněny, ale obecně lze říci, že čím je látka menší a jednodušší, tím snáze krystalizuje (všichni známe z kuchyně krystaly jedlé soli). Naopak čím je větší (a v případě komplexů i nesymetričtější), tím obtížnější je připravit z ní krystaly. Strukturní biologové sice už od sedmdesátých let určují struktury virových kapsid, které jsou často mnohonásobně větší než ribozom, ale virové kapsidy se skládají obvykle jen z několika málo často se opakujících proteinů s velkou vnitřní symetrií. Ribozom je naproti tomu složen ze dvou podjednotek. Malá podjednotka ribozomu má molekulovou hmotnost okolo 800 000 daltonů (to se rovná hmotnosti 66 666 atomů uhlíku) a skládá se z 20 proteinů a z molekuly RNA dlouhé asi 1600 nukleotidů (16S RNA). Velká podjednotka ribozomu má velikost asi 1 500 000 daltonů a skládá se z 33 proteinů a dvou molekul RNA. Větší molekula RNA (23S RNA) je dlouhá okolo 2900 nukleotidů a ta menší (5S RNA) asi 120 nukleotidů. Jde o komplexy tak velké, že k jejich popisu přestal stačit standardní formát pro popis a ukládání do databáze struktur makromolekul – proteinové databanky. Tento formát se s úspěchem používal 30 let, ale jeho tvůrci nepočítali s tím, že může být kdy určena struktura, která má více než 100 000 atomů. Proto musí být v databázi struktury ribozomů formálně rozděleny do několika substruktur, aby mohly být popsány standardním formátem. O symetrii nemůže být v případě ribozomu ani řeči.
Struktury malé i velké podjednotky byly určeny rentgenovou krystalografií. Nutnou a často obtížně splnitelnou podmínkou pro použití rentgenové krystalografie je získání krystalu sloučeniny, proteinu či komplexu proteinů, které chceme studovat. Krystal si lze představit jako naprosto pravidelné, často symetrické uspořádání až tisíců miliard molekul. Podmínky, za kterých látky krystalizují, nejsou dosud podrobně objasněny, ale obecně lze říci, že čím je látka menší a jednodušší, tím snáze krystalizuje (všichni známe z kuchyně krystaly jedlé soli). Naopak čím je větší (a v případě komplexů i nesymetričtější), tím obtížnější je připravit z ní krystaly. Strukturní biologové sice už od sedmdesátých let určují struktury virových kapsid, které jsou často mnohonásobně větší než ribozom, ale virové kapsidy se skládají obvykle jen z několika málo často se opakujících proteinů s velkou vnitřní symetrií. Ribozom je naproti tomu složen ze dvou podjednotek. Malá podjednotka ribozomu má molekulovou hmotnost okolo 800 000 daltonů (to se rovná hmotnosti 66 666 atomů uhlíku) a skládá se z 20 proteinů a z molekuly RNA dlouhé asi 1600 nukleotidů (16S RNA). Velká podjednotka ribozomu má velikost asi 1 500 000 daltonů a skládá se z 33 proteinů a dvou molekul RNA. Větší molekula RNA (23S RNA) je dlouhá okolo 2900 nukleotidů a ta menší (5S RNA) asi 120 nukleotidů. Jde o komplexy tak velké, že k jejich popisu přestal stačit standardní formát pro popis a ukládání do databáze struktur makromolekul – proteinové databanky. Tento formát se s úspěchem používal 30 let, ale jeho tvůrci nepočítali s tím, že může být kdy určena struktura, která má více než 100 000 atomů. Proto musí být v databázi struktury ribozomů formálně rozděleny do několika substruktur, aby mohly být popsány standardním formátem. O symetrii nemůže být v případě ribozomu ani řeči.
Pokusy o krystalizaci ribozomu
 Na začátku osmdesátých let, kdy Ada Yonathová začínala s pokusy o krystalizaci ribozomu, byla jednou z mála lidí, kteří věřili, že vůbec půjde krystaly ribozomu (difraktující do vysokého rozlišení) připravit. Jedním ze zásadních příspěvků Ady Yonathové bylo použití ribozomů bakterií z extrémně teplých pramenů (Geobacillus stearothermophilus) a Mrtvého moře (Haloarcula marismortui). Podobné bakterie sehrály přibližně v téže době zásadní roli při vynálezu polymerázové řetězové reakce (PCR). Jde přinejmenším o druhý případ, kdy studium zdánlivě obskurních organismů vedlo k objevu oceněnému Nobelovou cenou. Yonathová očekávala, že tyto bakterie budou mít stabilnější ribozomy než bakterie běžně studované (jako E. coli) a že poskytnou větší šanci získat krystal. Její očekávání se potvrdila, už v polovině osmdesátých let získala krystaly s rozlišením okolo 6Å, ty však nestačily k získání informace o poloze jednotlivých atomů. Ještě větší přesnosti dosáhla Yonathová dalším vylepšováním purifikace a krystalizace a hlavně zmražením vzniklých krystalů v tekutém dusíku. Zmražené krystaly mají totiž větší trvanlivost v paprsku rentgenového záření, což usnadňuje sběr dat a snižuje požadavky na množství materiálu. Data z jednoho zmraženého krystalu mohla být sbírána i šest dní.
Na začátku osmdesátých let, kdy Ada Yonathová začínala s pokusy o krystalizaci ribozomu, byla jednou z mála lidí, kteří věřili, že vůbec půjde krystaly ribozomu (difraktující do vysokého rozlišení) připravit. Jedním ze zásadních příspěvků Ady Yonathové bylo použití ribozomů bakterií z extrémně teplých pramenů (Geobacillus stearothermophilus) a Mrtvého moře (Haloarcula marismortui). Podobné bakterie sehrály přibližně v téže době zásadní roli při vynálezu polymerázové řetězové reakce (PCR). Jde přinejmenším o druhý případ, kdy studium zdánlivě obskurních organismů vedlo k objevu oceněnému Nobelovou cenou. Yonathová očekávala, že tyto bakterie budou mít stabilnější ribozomy než bakterie běžně studované (jako E. coli) a že poskytnou větší šanci získat krystal. Její očekávání se potvrdila, už v polovině osmdesátých let získala krystaly s rozlišením okolo 6Å, ty však nestačily k získání informace o poloze jednotlivých atomů. Ještě větší přesnosti dosáhla Yonathová dalším vylepšováním purifikace a krystalizace a hlavně zmražením vzniklých krystalů v tekutém dusíku. Zmražené krystaly mají totiž větší trvanlivost v paprsku rentgenového záření, což usnadňuje sběr dat a snižuje požadavky na množství materiálu. Data z jednoho zmraženého krystalu mohla být sbírána i šest dní.
Dalším významným příspěvkem k získání struktury ribozomu byl i vynález CCD2) detektorů, urychlujících a zpřesňujících sběr dat.3)
S pomocí těchto inovací se týmu Ady Yonathové povedlo v roce 1991 dospět až ke krystalům difraktujícím na hranici atomárního rozlišení (3Å).
Trvalo však dalších devět let, než byly dobře difraktující krystaly proměněny ve skutečné struktury ribozomu. Novou výzvou bylo najít způsob, jak se zorientovat v nepřehledném shluku skvrn, tedy v obrazu difraktujícího krystalu. K řešení tohoto fázového problému přispěli další dva nositelé loňské Nobelovy ceny. Především využití dat z kryoelektronové mikroskopie vedlo v roce 2000 k určení atomární struktury podjednotek ribozomu všemi třemi skupinami nezávisle na sobě.
Na téměř dvacetileté cestě za strukturou ribozomu zmínění laureáti objevili či rozvinuli řadu metodik, které jsou dnes neodmyslitelnou součástí určování struktur i mnohem menších proteinů.
Molekulární pravítko
Jedním z dalších tajemství zůstával i po desetiletích studia způsob, jímž dosahuje ribozom přesnosti při čtení kodonů a jejich překladu. K čtení využívá molekuly tRNA, které na jedné straně nesou aminokyselinu, na druhé straně mají trojici nukleotidů (antikodon), kerá se může párovat s kodonem mRNA (viz slovníček na předchozí straně). S jedním kodonem se však může efektivně párovat více antikodonů (viz obr. 1), neboť na třetí pozici kodonu jsou párovací pravidla mnohem mírnější než klasická watson-crickovská, která se uplatňují na prvních dvou pozicích.
Struktury určené skupinou Venkiho Ramakrishnana vysvětlují tento jev velice elegantně. Specifické nukleotidy 16S RNA, konkrétně A1492, G530 a A1493, totiž vytvářejí vodíkové můstky s nukleotidy kodonu i antikodonu pouze tehdy, pokud dojde k jejich správnému párování a geometrické orientaci. Nukleotidy podjednotky 16S tvoří „molekulární pravítko“, které „měří“ správnost párování, a zvyšují přesnost čtení, jež je určena komplementaritou nukleotidů kodonu a antikodonu. Na třetí pozici 16S RNA nic nekontroluje, a proto je na ní tolerováno více párů než na prvních dvou pozicích.
Vznik peptidické vazby
Peptidická kovalentní vazba, která spojuje dvě aminokyseliny, vzniká ve velké podjednotce ribozomu (viz obr. 2), v oblasti zvané peptidyl-transferázové centrum. Struktura podjednotky 50S ze Steitzovy laboratoře poněkud překvapivě ukázala, že se v peptidyl-transferázovém centru vyskytuje pouze 23S RNA. Zdálo se tedy, že jednu z nejvýznamějších reakcí v buňce nekatalyzuje žádný protein, ale molekula RNA. Tento nález dále podpořil představu, že na začátku historie života mohla hrát RNA zásadní roli. Mohla být nejen nositelem informace, ale i katalyzátorem reakcí. Až pozdější biochemické a simulační studie objasnily detailní reakční mechanismus vzniku peptidické vazby. Ribozom nesnižuje aktivační entalpii nutnou pro vznik peptidické vazby, jeho příspěvěk je spíše entropický. Peptidyl-transferázové centrum je stabilizováno síti vodíkových můstků, přes které je transportován proton vznikající po ataku aminoskupiny jedné aminokyseliny na esterovou vazbu tRNA, vázající druhou aminokyselinu. Právě tato síť vodíkových můstků je odpovědná za snížení aktivační energie reakce v ribozomu.
Teprve nové, přesnější struktury ze Steitzovy laboratoře ukázaly, že se na vzniku klíčové sítě vodíkových můstků podílí nejen 23S RNA, jak se původně předpokládalo, ale i molekula tRNA nesoucí aminokyselinu, molekuly vody a ribozomální proteiny. Ribozom je tedy unikátním komplexem, kde se setkává svět RNA se světem proteinů. Až 50 % všech současných antibiotik ovlivňuje překlad nukleových kyselin do proteinu.
Všichni tři letošní nositelé také určili několik struktur ribozomu v komplexu s různými antibiotiky. Tyto struktury nejen blíže vysvětlují mechanismus, který překladu brání, ale především poskytují nástroj pro vývoj nových antibiotik, jichž je nám s rostoucí rezistencí bakterií třeba. Tento přínos spolu s rozvojem krystalografických metod a objasněním mechanismu, jímž vzniká peptidická vazba či je rozpoznáván kodon mRNA, dobře ilustrují, že je Nobelova cena v dobrých rukou.4) V roce 2009 ji už po třinácté získali strukturní biologové.5)
Poznámky
1) Palade byl první, který na
začátku padesátých let pozoroval
ribozomy.
2) CCD – charge-coupled devices (zařízení s vázanými náboji).
3) Shodou okolností byl i vynález těchto detektorů odměněn r. 2009 Nobelovou cenou (za fyziku).
4) V roce 2007 byla udělena Nobelova cena za struktury spojené s přepisem (transkripcí), loni za struktury spojené s překladem (translací), a tak by se dala očekávat Nobelova cena za struktury objasňující poslední část centrálního dogmatu molekulární biologie – replikaci. Thomas Steitz je opět horkým kandidátem, spolu s ním je v pořadí i John Kuriyan…
5) Každý příběh má své „vojevůdce“, kteří se těší uznání, ale taky pěšáky, kteří odvedli kus práce, bez níž by nebylo slávy. Pravidla pro udělování Nobelových cen (sdílet cenu můžou nanejvýš tři lidé) „upřela“ toto vyznamenání i několika „vojevůdcům“. Velkou zásluhu má například Harry Noller, jehož skupina jako první určila strukturu celého ribozomu, nebo Joachim Frank, jehož snímky ribozomu pořízené elektronovým mikroskopem umožnily vyřešit fázový problém při určování struktur ribozomu.
(Weizmann Institute of Science, Izrael)
*22. 6. 1939 v Jeruzalémě. Její rodiče se tam přistěhovali z Polska. V dětství neměla žádné vlastní knížky. Jako středoškolská studentka (Tichon Chadaš v Tel Avivu) si přivydělávala doučováním. Vzorem jí byla Marie Curie- Sklodowská. Po maturitě studovala Hebrejskou univerzitu v Jeruzalémě, kde získala titul bakaláře z chemie (1962) a titul magistra z biochemie (1964). V roce 1968 obdržela Ph.D. z rentgenové krystalografie ve Weizmannově ústavu v Rechovotu. Mj. spolupracovala s NASA při výzkumech ve vesmíru.
(MRC Laboratory of Molecular Biology, Cambridge, Velká Británie)
*1952 v Čidambaramu v jihoindickém státě Tamilnadu. Má americké občanství. Doktorandské studium v oboru fyzika absolvoval na Ohijské univerzitě v USA (1976). Je vedoucím vědeckým pracovníkem ve výzkumné laboratoři molekulární biologie na Cambridgeské univerzitě ve Velké Británii.
(Yaleova univerzita, New Haven, CT, USA)
*1940 v Milwaukee. V roce 1966 získal doktorský titul v oboru molekulární biologie a biochemie na Harvardově univerzitě. Působí na Yaleově univerzitě v New Havenu a v tamějším Lékařském institutu Howarda Hughese.
SLOVNÍČEK
kodon – trojice nukleotidů v mRNA určující zařazení jedné aminokyseliny v proteinu
antikodon – trojice nukleotidů v tRNA vázající se na kodon, je specifický pro každý typ tRNA
mRNA – molekula představující přepis genu, podle něhož je syntetizován protein
tRNA – transferová RNA; molekula nesoucí vždy jednu aminokyselinu do místa syntézy proteinu; každá aminokyselina má svou vlastní tRNA
Ke stažení
 článek ve formátu pdf [723,16 kB]
článek ve formátu pdf [723,16 kB]


















