Viry, které uzdravují
Viry byly odedávna považovány za démony nemoci a smrti a dodnes mohou být vnímány jako jedna z hlavních hrozeb lidstva. Díky dostupností vakcín a antivirotik však již viry pro naši západní civilizaci poněkud ztratily démonický charakter a málokdo z nás se obává, že jeho život skončí v důsledku neléčitelné virové infekce. Ve statistikách příčin úmrtí totiž v západní euroatlantické civilizaci dávno nefigurují na předních příčkách mor a neštovice, ale kardiovaskulární onemocnění a karcinomy. Léta výzkumu věnovaného protinádorové terapii přinesla mnohé účinné diagnostické a léčebné postupy, ale dodnes neexistuje spolehlivá léčba pro všechny typy a stadia choroby. Proto znovu ožívá myšlenka stará téměř 100 let – použití virů k léčbě rakoviny.
Od psího kousnutí k léčbě rakoviny
 Za zakladatele viroterapie je považován italský gynekolog N. G. DePace. Ten ve své případové studii z roku 1912 poprvé detailně popsal ústup karcinomu děložního čípku u pacientky, která byla pokousána psem a očkována proti vzteklině vakcínou obsahující živý oslabený virus vztekliny. V průběhu následujících let se postupně množily zprávy o ústupu nádorů (převážně leukemických) v důsledku přirozených virových infekcí, způsobených například virem spalniček, virem chřipky nebo viry hepatitid.
Za zakladatele viroterapie je považován italský gynekolog N. G. DePace. Ten ve své případové studii z roku 1912 poprvé detailně popsal ústup karcinomu děložního čípku u pacientky, která byla pokousána psem a očkována proti vzteklině vakcínou obsahující živý oslabený virus vztekliny. V průběhu následujících let se postupně množily zprávy o ústupu nádorů (převážně leukemických) v důsledku přirozených virových infekcí, způsobených například virem spalniček, virem chřipky nebo viry hepatitid.
Všechna tato pozorování posléze vyústila v nápad využívat viry k léčbě nádorů. V padesátých letech minulého století bylo provedeno několik (z dnešního pohledu poněkud hazardních) klinických studií. Pro léčbu onkologických pacientů v nich byly často používány neoslabené virové izoláty z tělních tekutin a tkání pacientů prodělávajících závažné infekční onemocnění. Ve studii z roku 1949, kdy byl pro léčbu Hodgkinovy choroby použit virus hepatitidy,1) bylo sice u 7 z 22 pacientů zaznamenáno klinické zlepšení choroby, ale 14 jich po léčbě prodělalo hepatitidu. Ještě horší výsledky byly s použitím viru západonilské horečky, kdy ke klinickému zlepšení onkologické choroby u pacientů téměř nedošlo, zato encefalitidu prodělala řada z nich. Ukázalo se, že minimální vedlejší následky a velmi dobrou účinnost má použití adenoviru, který byl však brzy imunitním systémem pacientů odstraněn a více než polovina jich několik měsíců po zahájení studie nádorovému bujení podlehla. Nejslibnější výsledky poskytla japonská studie z roku 1974, v níž byl pro léčbu pacientů v terminálním stadiu nádorového onemocnění (nádorů plic, žaludku a dělohy) použit neoslabený virus příušnic. U 37 z 90 pacientů byl zaznamenán kompletní nebo více než poloviční ústup nádoru a u 9 výrazné zlepšení klinických příznaků. Vedlejší následky léčby byly minimální. I tento virus byl sice záhy imunitním systémem odstraněn, trvalé klinické výsledky však byly přičteny na vrub povzbuzené protinádorové imunitě. Problémem zůstává, že při této studii neexistovala žádná kontrolní skupina a že se výsledky nikdy nepodařilo zopakovat.
Něco na tom viru je
 V době, kdy pionýrské studie probíhaly, byla virologie ještě v plenkách. Až do objevu technik pěstování buněk a tkání in vitro nebylo snadné viry v laboratoři množit, a tedy ani pochopit jejich životní cyklus či mechanismus jejich patogenního účinku. Dnes však máme k dispozici sofistikované metody, které nám dovolují viry důkladně analyzovat a manipulovat s jejich genomy. Je tedy naděje, že by viry bylo možno použít v léčbě nádorů? Odpověď zní: ano.
V době, kdy pionýrské studie probíhaly, byla virologie ještě v plenkách. Až do objevu technik pěstování buněk a tkání in vitro nebylo snadné viry v laboratoři množit, a tedy ani pochopit jejich životní cyklus či mechanismus jejich patogenního účinku. Dnes však máme k dispozici sofistikované metody, které nám dovolují viry důkladně analyzovat a manipulovat s jejich genomy. Je tedy naděje, že by viry bylo možno použít v léčbě nádorů? Odpověď zní: ano.
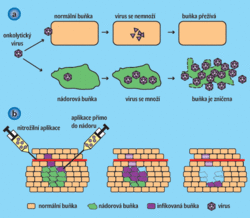
Viry se dokážou množit pouze uvnitř hostitelské buňky a využívají k tomu její biosyntetický aparát. Pro vznik svého potomstva potřebuje virus udržovat tento aparát v aktivním stavu, a proto je pro mnoho virů výhodné, když je hostitelská buňka ve stavu buněčného dělení. Možná proto některé viry dávají pro svou replikaci přednost nádorovým (nepřetržitě se dělícím) buňkám před normálními. Běžné viry však nemůžou spoléhat na to, že náhodou infikují nádorovou buňku, a proto bývají vybaveny různými možnostmi jak dělení hostitelské buňky nastartovat. Výsledkem takové virové infekce pak může být naopak proměna v nádor. Tyto viry jsou označovány jako viry onkogenní. Pro účely viroterapie je proto nutné používat viry, u nichž je výsledkem virové infekce vždy zničení (lýza) hostitelské buňky. Viry, které tuto schopnost mají a přednostně se množí v rakovinných buňkách, jsou označovány jako viry onkolytické (viz obr. 1).
 Normální hostitelská buňka však nečeká na virus „s rukama v klíně“ a dokáže se virové infekci účinně bránit. V součinnosti s imunitním systémem organismu zachytí signály (interferon I) o přítomnosti viru v těle a reaguje většinou zástavou buněčného cyklu (a tedy i dělení), celkovým omezením biosyntézy nebo řízenou buněčnou smrtí.
Normální hostitelská buňka však nečeká na virus „s rukama v klíně“ a dokáže se virové infekci účinně bránit. V součinnosti s imunitním systémem organismu zachytí signály (interferon I) o přítomnosti viru v těle a reaguje většinou zástavou buněčného cyklu (a tedy i dělení), celkovým omezením biosyntézy nebo řízenou buněčnou smrtí.
Rakovinné buňky však mívají celkově narušenou antivirovou obranu: nedokážou reagovat na interferonové signály a mají vážné poruchy v buněčné signalizaci. Řada nádorů má nefunkční (mutovaný) gen p53, který je jinak dobrým „strážcem genomu“ a dokáže buněčné dělení zastavit. Krom toho se povrch nádorových buněk liší od normálních přítomností nezvyklých povrchových bílkovin (nádorových antigenů).
A toho všeho onkolytické viry využívají. Některé pro vstup do hostitelské buňky přednostně používají jako receptory právě nádorové povrchové antigeny, jiné se dokážou účinně pomnožit pouze v buňkách, kde selhává interferonová obrana, nebo je selektivní replikace viru v nádorové buňce dána jejím mikroprostředím. Onkolytické viry tak teoreticky představují ideální možnost léčby nádorových chorob – množí se výhradně v rakovinných buňkách, kde se jejich koncentrace na místě potřeby prudce a přirozeně zvyšuje, a navíc lze předpokládat, že po uvolnění do krevního řečiště dokážou vyhledat a infikovat i metastázující buňky. Skutečnost je však poněkud složitější a přílišný optimismus zatím není na místě.
O virech, myších a lidech
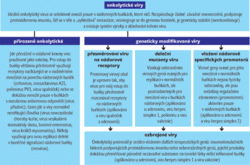
- První problém tkví ve virech samotných. Virus, který by se množil výhradně v nádorových buňkách, by v evoluci neměl přílišnou naději na úspěch. Proto většina přirozeně se vyskytujících onkolytických virů sice dává nádorovým buňkám přednost, ale normální buňky dokáže infikovat též, třeba s menší pravděpodobností. Tím se poněkud zmenšuje okruh lidských virů na ty, které jsou použitelné pro viroterapii, ale nezpů buňky, což je jev zcela nežádoucí. Nicméněsobují závažná onemocnění. Jako zajímavá možnost se ukázalo použití živočišných virů, které za normálních okolností lidské buňky neinfikují, a přesto mají onkolytický potenciál. I zde je však na místě opatrnost. Viry dokážou svou genetickou informaci rychle změnit (mutovat) a přizpůsobit se novému prostředí. Náhodné zavlečení živočišného viru do lidské populace stálo zřejmě u zrodu nejedné epidemie. Krom toho se ukázalo, že vytipované živočišné viry většinou infikují stejně ochotně lidské nervové i nádorové i tak se zdá, že kupříkladu virus newcastleské choroby kuřat (NDV), virus vesikulární stomatitidy skotu (VSV) nebo virus králičí myxomatózy existují spolu s lidskou populací bez nežádoucích důsledků natolik dlouho, že se jejich využití ve viroterapii zdá být bezpečné. V dnešní době však již bohudík není nutné spoléhat na přirozeně se vyskytující viry. Pomocí metod genového inženýrství (viz obr. 2) je možno cíleně upravovat i potenciálně nebezpečné (a třeba i onkogenní) viry tak, aby získaly nebo rozvinuly svůj onkolytický potenciál.2) Genové inženýrství nám dnes umožňuje přesměrovat viry na jiné než přirozené receptory a posílat je do nádorových buněk. Dovoluje nám také vyžít zkušenosti z genové terapie a vytvářet ozbrojené viry, které neničí nádorové buňky pouze v důsledku své vlastní replikace, ale přinášejí do infikovaných buněk „zbraně“ (například molekuly podporující protinádorovou imunitu nebo sebevražedné geny). Podobně lze dnes upravit v podstatě kterýkoli virus. Arzenál virů, které by mohly být onkolytické, se zdá být téměř nevyčerpatelný, a to i při zajištění všech bezpečnostních kritérií.
- Druhý problém spočívá v testování účinnosti vybraných onkolytických virů. Pro preklinické studie jsou používány zvířecí (hlavně myší) modely lidských nádorů. Aby bylo možno vyvolat růst lidského nádoru v myším organismu, je nutno používat myší kmeny s nedostatečně vyvinutou imunitou (imunodeficientní). A právě imunitní systém sehrává v úspěšnosti viroterapie zásadní roli. Často může virus, který se výborně osvědčí na myším modelu, zcela selhat v klinickém experimentu, kde je aktivní imunitní systém hostitele. A naopak – použité onkolytické viry se často množí hůře v myších než v lidských buňkách, a z preklinických experimentů je pak obtížné usuzovat na bezpečnost použití při léčbě. Dnes se nabízí možnost vytvářet transgenní myší kmeny, které dovolují mnohem spolehlivější testování.
- Třetí problém viroterapie souvisí s faktem, že po úspěšném prvotním zaléčení začne nádor opět růst. Virus musí uvnitř těla čelit různým nástrahám, a to hlavně (ale nejen) ze strany imunitního systému. Již první výše zmiňované klinické studie jasně naznačovaly, že viroterapie má největší naději na úspěch u leukemických pacientů, jejichž imunitní systém je značně podlomen. Za normálních okolností může být zřejmě virus z těla vyloučen dříve, než se vůbec k nádoru dostane.3) Kromě toho je v některých případech pro virus obtížné překonat fyzické bariéry okolo nádoru (opouzdření, pojivovou tkáň, zvýšený mezibuněčný tlak). Důležitá je i velikost nádoru, protože virus se lépe šíří v menších nádorech. Ve velkém nádoru obtížně proniká do středu a rychlost, s níž nádorové buňky likviduje, může být menší než přírůstek způsobený nekontrolovaným dělením. Byly popsány i případy, kdy se v průběhu léčby staly nádorové buňky vůči viru rezistentní. Badatelské úsilí se v tomto oboru nyní tedy hlavně soustřeďuje na hledání způsobů, jak vhodně dopravovat virus do těla a překonávat antivirovou obranu organismu.4)
Zajímavá je také možnost využít onkolytické viry pro stimulaci protinádorové imunity. Viry totiž mohou nabudit imunitní odpověď nejen proti sobě, ale i proti nádorovým buňkám, které ničí, což je situace velmi žádoucí. Povzbudivé výsledky byly v osmdesátých letech minulého století získány s virovým onkolyzátem při léčbě časných stadií melanomu.5)
Viroterapie včera, dnes a zítra
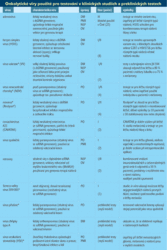
Jaké jsou tedy perspektivy viroterapie? Zdá se, že poměrně slibné. V preklinických studiích se testují stále nové terapeutické varianty virů. Do dnešního dne proběhlo již více než 50 klinických studií (viz tab. I.) s 9 různými onkolytickými viry a 14 studií právě probíhá. Vesměs jde o první či druhou fázi klinického testování.6 Náklady na léčbu rakoviny každoročně stoupají, přestože procenta dlouhodobě přeživších pacientů trpících nejčastějšími typy nádorů se zvýšila od roku 1950 jen nepatrně. Zvláště léčba metastázujících nádorů je stále v nedohlednu. Proto se dnes dostává viroterapie opět do popředí zájmu vědců i farmaceutických firem. Zkušenosti zatím ukazují, že žádný onkolytický virus se asi nestane tím kýženým univerzálním a jediným lékem na rakovinu. Síla viroterapie však může spočívat v možnosti individualizované léčby virovými onkolyzáty nebo v zesílení účinků jiných forem léčby nádorů (chemo-, radio-, imunoterapie). Genové inženýrstvínám dnes dává možnosti jak viry upravovat a cílit do nádorových buněk. A pokud by se podařilo chytře překonat problémy spojené s antivirovou obranou organismu při vnášení onkolytických virů do těla, měli bychom v rukou naději, která kdysi bývala pro lidstvo hrozbou. I v medicíně by tak mohlo platit biblické Nedej se přemoci zlému, ale přemáhej v dobrém zlé (Epištola sv. Pavla k Římanům 12.21, kralický překlad).
Poznámky
1) Pro léčbu byla použita séra od osob trpících žloutenkou a obsahovala pravděpodobně viry hepatitidy A i B; za klinické zlepšení Hodgkinovy choroby byl však u pacientů odpovědný tehdy ještě neznámý virus hepatitidy B.
2) Příkladem může být klinicky velmi úspěšný adenovirus ONYX 015, vyvinutý firmou ONYX Pharmaceuticals. Ten vznikl úpravou divokého typu adenoviru tak, že z jeho genomu byl odstraněn gen pro protein (E1B 55KDa), který je odpovědný za vyvazování a deaktivaci buněčného proteinu p53. Tím bylo dosaženo toho, že se ONYX 015 nemůže množit v normálních buňkách (v nichž je protein p53 aktivní, a zastavuje buněčné dělení infikované buňky nutné pro virovou replikaci), ale bez problémů se množí v nádorových buňkách (kde je p53 sám o sobě neaktivní) a ničí je.
3) Hlavně v případech, kdy už má organismus proti viru protilátky.
4) Doporučuje se opakované dávkování viru, mírná imunosuprese organismu, podávání vazodilatačních látek při nitrožilní aplikaci nebo přímá aplikace viru do nádoru. Již dnes existují sofistikované metody jak virus k nádoru dopravovat pomocí plastikových cévek (metodou convection-enhanced delivery neboli CED) či pomocí tělu vlastních a virem infikovaných buněk, které tak fungují jako trojské koně pro přepravu onkolytických virů. Jinou možností je obalit virus inertními polymerními látkami, které nevyvolávají protilátkovou odpověď a dovolují jeho dlouhodobou cirkulaci v těle. Nevýhoda tohoto přístupu spočívá v tom, že virus takto ztrácí svou infektivitu a musí být pomocí další uměle připojené molekuly cílen na nádorový receptor.
5) Pro přípravu onkolyzátu byly pacientům zúčastněným ve studii odebrány nádorové buňky a ozářeny tak, aby ztratily svůj onkogenní potenciál, ale umožňovaly infekci a replikaci viru. Ozářené buňky byly poté infikovány virem newcastleské choroby kuřat a takto připravený onkolyzát byl opakovaně podáván pacientům v prodlužujících se intervalech. Po pěti letech přežívalo 68 z 83 pacientů. Studie neobsahovala kontrolní skupinu, ale byla vztahována ke skupině pacientů se stejnou chirurgickou léčbou bez doplňkové onkolytické terapie, kde po pěti letech přežívalo jen 17 pacientů. Na podobném principu je založen i účinek ozbrojených virů nesoucích geny pro imunostimulační molekuly.
6) Jediný virus, který úspěšně prošel do třetí fáze klinických zkoušek, je adenovirus ONYX 015, ale na jeho brzké použití v praxi se bohužel těšit nemůžeme. Jeho vývoj a testování byly z finančních důvodů výrobcem zastaveny. Projektu se však ujala čínská firma Shangai Sunway Biotech, která vyrobila obdobný virus H101, úspěšně jej otestovala v klinické praxi a v roce 2005 byl v Číně oficiálně schválen pro léčbu spinocelulárního karcinomu hlavy a krku. Používá se v kombinované léčbě s chemoterapií a publikované výsledky jsou velmi dobré. Jde tedy o první onkolytický virus standardně používaný v léčbě nádorů.
Ke stažení
 článek ve formátu pdf [426,4 kB]
článek ve formátu pdf [426,4 kB]

























